草酸铁铵[(NH4)3Fe(C2O4)3]是一种常用的金属着色剂,易溶于水,常温下其水溶液的pH介于4.0~5.0之间。某兴趣小组设计实验制备草酸铁铵并测其纯度。
(1)甲组设计由硝酸氧化葡萄糖制取草酸,其实验装置(夹持及加热装置略去)如图所示。
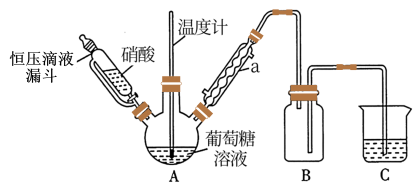
①仪器a的名称是________________ 。
②55~60℃下,装置A中生成H2C2O4,同时生成NO2和NO且物质的量之比为3:1,该反应的化学方程式为__________________________ 。
③装置B的作用是______________________ ;装置C中盛装的试剂是______________ 。
(2)乙组利用甲组提纯后的草酸溶液制备草酸铁铵。
将Fe2O3在搅拌条件下溶于热的草酸溶液;滴加氨水至__________ ,然后将溶液________ 、过滤、洗涤并干燥,制得草酸铁铵产品。
(3)丙组设计实验测定乙组产品的纯度。
准确称量5.000g产品配成100mL溶液,取10.00mL于锥形瓶中,加入足量0.1000mol·L-1稀硫酸酸化后,再用0.1000mol·L-1KMnO4标准溶液进行滴定,消耗KMnO4溶液的体积为12.00mL。
①滴定终点的现象是_______________________ 。
②滴定过程中发现褪色速率开始缓慢后迅速加快,其主要原因是____________________ 。
③产品中(NH4)3Fe(C2O4)3的质量分数为____________ %。[已知:(NH4)3Fe(C2O4)3的摩尔质量为374g·mol-1]
(1)甲组设计由硝酸氧化葡萄糖制取草酸,其实验装置(夹持及加热装置略去)如图所示。

①仪器a的名称是
②55~60℃下,装置A中生成H2C2O4,同时生成NO2和NO且物质的量之比为3:1,该反应的化学方程式为
③装置B的作用是
(2)乙组利用甲组提纯后的草酸溶液制备草酸铁铵。
将Fe2O3在搅拌条件下溶于热的草酸溶液;滴加氨水至
(3)丙组设计实验测定乙组产品的纯度。
准确称量5.000g产品配成100mL溶液,取10.00mL于锥形瓶中,加入足量0.1000mol·L-1稀硫酸酸化后,再用0.1000mol·L-1KMnO4标准溶液进行滴定,消耗KMnO4溶液的体积为12.00mL。
①滴定终点的现象是
②滴定过程中发现褪色速率开始缓慢后迅速加快,其主要原因是
③产品中(NH4)3Fe(C2O4)3的质量分数为
2020·山东临沂·一模 查看更多[4]
更新时间:2020/05/01 21:38:50
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】某化学兴趣小组的几位同学探究原电池原理的应用时,做了如图的实验:
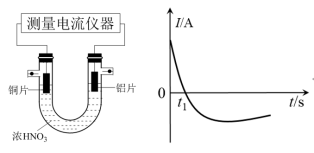
(1)甲同学利用打磨过的铜片和铝片设计了如图的实验装置,并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转),则图中t1时刻之后阶段,负极材料是___________ 。
II.铜与浓硝酸反应探究
(2)乙同学将铜片直接放入浓硝酸中:
①实验现象为___________ ,溶液显绿色。
②待反应停止后,若铜有剩余,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是___________ (用离子方程式表示)。
(3)电化学降解NO 的原理如图所示。
的原理如图所示。
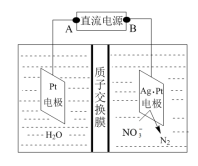
电源正极为___________ (填“A”或“B”),阳极的电极反应式为___________ 。若电解过程中转移了2mol电子,则膜两侧电极液的质量变化差(△m左-△m右)为___________ 。
(1)甲同学利用打磨过的铜片和铝片设计了如图的实验装置,并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转),则图中t1时刻之后阶段,负极材料是

II.铜与浓硝酸反应探究
(2)乙同学将铜片直接放入浓硝酸中:
①实验现象为
②待反应停止后,若铜有剩余,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是
(3)电化学降解NO
 的原理如图所示。
的原理如图所示。
电源正极为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
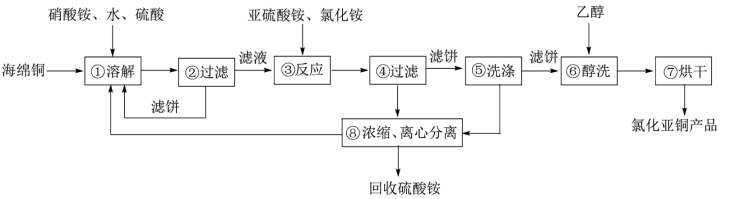
【推荐2】硒(Se)和铜(Cu)在生产生活中有广泛的应用。硒可以用作光敏材料、电解锰行业的催化剂,也是动物体必需的营养元素和对植物有益的营养元素等。氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下所示:
请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是____________ 。
(2)写出步骤③中主要反应的离子方程式:____________________________________ 。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是__________ (写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是_____________ 。
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:_____ 。
(6)氯化亚铜产率与温度、溶液pH关系如下图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是____________________________________ ;温度过高、pH过大也会影响CuCl产率的原因是_______________________________ 。
(7)用NaHS作污水处理的沉淀剂,可以处理工业废水中的Cu2+。已知:25℃时,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15,CuS的溶度积为Ksp(CuS)=6.3×10-36。反应Cu2+(aq)+HS-(aq) CuS(s)+H+(aq)的平衡常数K=
CuS(s)+H+(aq)的平衡常数K=__________ (结果保留1位小数)。
请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是
(2)写出步骤③中主要反应的离子方程式:
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是
(4)上述工艺中,步骤⑥和⑦的作用是
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:
(6)氯化亚铜产率与温度、溶液pH关系如下图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是
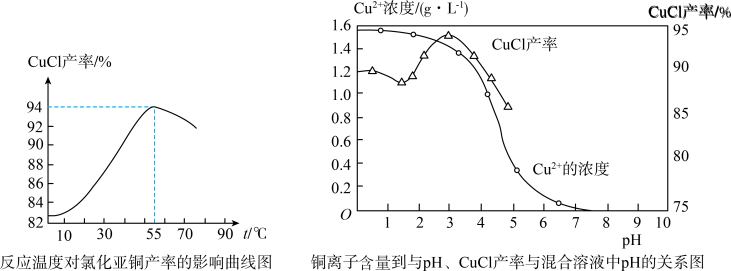
(7)用NaHS作污水处理的沉淀剂,可以处理工业废水中的Cu2+。已知:25℃时,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15,CuS的溶度积为Ksp(CuS)=6.3×10-36。反应Cu2+(aq)+HS-(aq)
 CuS(s)+H+(aq)的平衡常数K=
CuS(s)+H+(aq)的平衡常数K=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
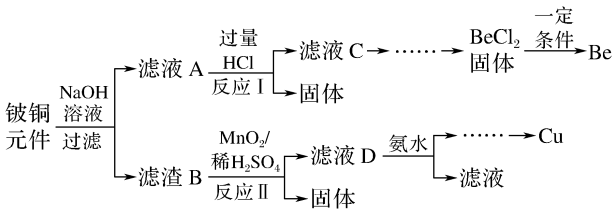
【推荐3】铍铜是广泛应用于制造高级弹性元件的良好合金,某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:
已知:I.铍、铝元素化学性质相似;II.常温下部分难溶物的溶度积常数如下表。
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)。
(2)滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤及顺序为___________ 。
a. 加入过量的氨水 b. 通入过量的CO2 c. 加入过量的NaOH
d. 加入适量的HCl e. 洗涤 f. 过滤
(3)①MnO2能将金属硫化物中的硫元素氧化为单质(MnO2还原成Mn2+)。写出反应II中CuS发生反应的化学方程式:____________________________________________ 。
②若用浓HNO3溶解金属硫化物,缺点是_________________________ (任写一条)。
(4)滤液D中c(Cu2+) = 2.2 mol·L-1、c(Fe3+) = 0.008 mol·L-1、c(Mn2+) = 0.021 mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是____________ (填离子符号),若忽略溶液体积变化,使Cu2+完全沉淀分离时常温下调节溶液pH应控制的范围是_______________ (已知lg2 = 0.3,lg5 = 0.7,通常溶液中离子浓度低于10-5 mol/L则认为沉淀完全)。
(5)用石墨电极电解NaCl-BeCl2混合熔盐可制备金属铍,已知混合熔盐中存在[BeCl4] 2-,阴极上得到Be的电极反应式为____________________________________________ 。

已知:I.铍、铝元素化学性质相似;II.常温下部分难溶物的溶度积常数如下表。
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 4.0×10-20 | 4.0×10-38 | 2.1×10-13 |
(2)滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤及顺序为
a. 加入过量的氨水 b. 通入过量的CO2 c. 加入过量的NaOH
d. 加入适量的HCl e. 洗涤 f. 过滤
(3)①MnO2能将金属硫化物中的硫元素氧化为单质(MnO2还原成Mn2+)。写出反应II中CuS发生反应的化学方程式:
②若用浓HNO3溶解金属硫化物,缺点是
(4)滤液D中c(Cu2+) = 2.2 mol·L-1、c(Fe3+) = 0.008 mol·L-1、c(Mn2+) = 0.021 mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是
(5)用石墨电极电解NaCl-BeCl2混合熔盐可制备金属铍,已知混合熔盐中存在[BeCl4] 2-,阴极上得到Be的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】三草酸合铁酸钾晶体K3[Fe(C2O4)3]•3H2O可用于摄影和蓝色印刷;已知三草酸合铁酸钾晶体在110℃可完全失去结晶水,继续升高温度可发生分解反应。某化学研究小组对其受热分解生成的气体产物和固体产物进行探究。
(1)实验所需的仪器装置如图所示,各装置的连接顺序为:_______ 。
a接______、_____接____、i接_____、______接______、_____接_______
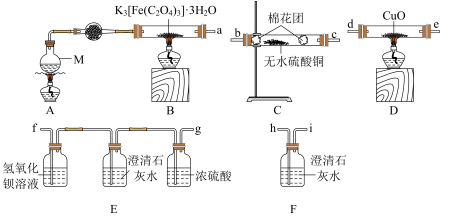
(2)检验装置的气密性后,先通一段时间N2,其目的是___________ 。
(3)装置E中澄清石灰水的作用是___________ 。
(4)有资料介绍“在含Fe2+的溶液中,先滴加少量新制饱和氯水,然后滴加KSCN溶液,溶液呈红色;若再滴加过量氯水,却发现红色褪去”。假设溶液中的+3价铁还能被氯水氧化为更高价的 ,试写出该反应的离子方程式
,试写出该反应的离子方程式___________ 。
(5)固体产物中铁元素存在形式的探究。
①提出合理假设:
假设1:只有Fe;
假设2:只有FeO;
假设3:___________ 。
②设计实验方案并实验验证
步骤1:取适量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体。
步骤2:取少量上述不溶固体放入试管中,加入足量___________ 溶液,充分振荡。若固体无明显变化,则假设2成立;若有暗红色固体生成,则反应的离子方程式为___________ 。
步骤3:取步骤2所得暗红色固体于试管中,滴加过量___________ ,振荡后静置。若溶液基本无色,则假设___________ 成立;若溶液呈___________ ,则假设3成立。
(1)实验所需的仪器装置如图所示,各装置的连接顺序为:
a接______、_____接____、i接_____、______接______、_____接_______

(2)检验装置的气密性后,先通一段时间N2,其目的是
(3)装置E中澄清石灰水的作用是
(4)有资料介绍“在含Fe2+的溶液中,先滴加少量新制饱和氯水,然后滴加KSCN溶液,溶液呈红色;若再滴加过量氯水,却发现红色褪去”。假设溶液中的+3价铁还能被氯水氧化为更高价的
 ,试写出该反应的离子方程式
,试写出该反应的离子方程式(5)固体产物中铁元素存在形式的探究。
①提出合理假设:
假设1:只有Fe;
假设2:只有FeO;
假设3:
②设计实验方案并实验验证
步骤1:取适量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体。
步骤2:取少量上述不溶固体放入试管中,加入足量
步骤3:取步骤2所得暗红色固体于试管中,滴加过量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某化学小组为测定样品有机物G 的组成和结构,设计如图实验装置:
① 搭建装置,检测装置的气密性;
② 准确称取4.3g样品有机物G放于电炉中;
③ 打开K1;关闭K2,让A装置反应一段时间后,再关闭K1打开K2;
④ 电炉通电,充分燃烧后产物只有水和二氧化碳,且被充分吸收;
⑤ 样品完全燃烧后,电炉断电,继续让A装置反应一段时间后再停止;
⑥ 测定装置D质量增加2.7g,U形管E质量增加8.8g;
⑦ 拿样品G去相关机构做质谱、红外光谱和核磁共振氢谱,谱图如下所示。
(1)装双氧水的仪器的名称是______ 。装置F 中碱石灰的作用是______ 。
(2)有机物G的分子式为______ ,结构简式为 _______ 。
(3)有机物G的一些同分异构体能与碳酸氢钠溶液发生反应有气体生成,写出符合条件的G的所有同分异构体的结构简式(不考虑立体异构)______ 。
(4)下列说法正确的是

① 搭建装置,检测装置的气密性;
② 准确称取4.3g样品有机物G放于电炉中;
③ 打开K1;关闭K2,让A装置反应一段时间后,再关闭K1打开K2;
④ 电炉通电,充分燃烧后产物只有水和二氧化碳,且被充分吸收;
⑤ 样品完全燃烧后,电炉断电,继续让A装置反应一段时间后再停止;
⑥ 测定装置D质量增加2.7g,U形管E质量增加8.8g;
⑦ 拿样品G去相关机构做质谱、红外光谱和核磁共振氢谱,谱图如下所示。

(1)装双氧水的仪器的名称是
(2)有机物G的分子式为
(3)有机物G的一些同分异构体能与碳酸氢钠溶液发生反应有气体生成,写出符合条件的G的所有同分异构体的结构简式(不考虑立体异构)
(4)下列说法正确的是
| A.若删除装置A,改成通空气,对分子式测定实验结果无影响 |
| B.装置B和D 都可以用装有碱石灰的装置E 替代 |
| C.如果没有CuO,可能导致装置E所测物质的质量偏低 |
| D.如果没有步骤⑤,导致测量的分子式中氧元素含量偏高 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】某盐X 由四种短周期元素组成。现有如下转化关系。已知有毒气体C在标况下的密度为 1.25g·L −1.
请回答.
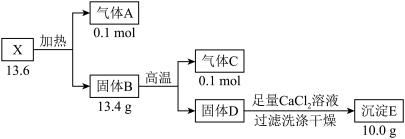
(1)组成X 的四种元素是 C、O 和_____ (填元素符号)。
(2)D 溶液中加入过量 AlCl3 溶液的离子方程式_____ 。
(3)写出一个B 参加反应的复分解反应_____ 。
(4)固体D 中加入足量 CaCl2 溶液,判断CaCl2溶液已足量的操作是_____ 。
(5)溶液X 与酸性KMnO4溶液混合, 被还原为 Mn2+,写出该反应的离子方程式为
被还原为 Mn2+,写出该反应的离子方程式为_________ 。
请回答.

(1)组成X 的四种元素是 C、O 和
(2)D 溶液中加入过量 AlCl3 溶液的离子方程式
(3)写出一个B 参加反应的复分解反应
(4)固体D 中加入足量 CaCl2 溶液,判断CaCl2溶液已足量的操作是
(5)溶液X 与酸性KMnO4溶液混合,
 被还原为 Mn2+,写出该反应的离子方程式为
被还原为 Mn2+,写出该反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
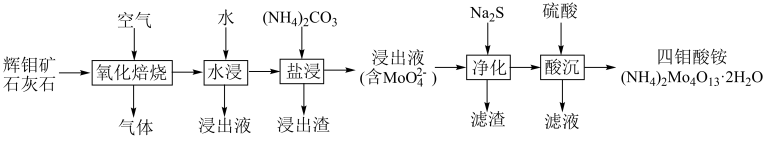
【推荐1】一种以辉钼矿(主要成分为MoS2,含少量Ca、Fe、Cu等元素)为原料制备多钼酸盐的生产工艺如图所示。
ii.K稳[Cu(NH3) ]=
]= =2.0×1013
=2.0×1013
(1)“氧化焙烧”过程:
①MoS2主要转化为CaSO4、____ (填化学式)。
②加入石灰石,有利于降低焙烧温度、____ (从环保角度答题)。
(2)“盐浸”过程,生成MoO 的离子方程式为
的离子方程式为____ 。
(3)“盐浸”过程,少量CuO转化为Cu(NH3) ,“净化”过程进一步转化为CuS除去。计算反应Cu(NH3)
,“净化”过程进一步转化为CuS除去。计算反应Cu(NH3) (aq)+S2-(aq)
(aq)+S2-(aq) CuS(s)+4NH3(aq)的K=
CuS(s)+4NH3(aq)的K=____ 。
(4)“酸沉”过程MoO 会发生聚合生成多钼酸根。
会发生聚合生成多钼酸根。
①生成(NH4)2Mo4O13·2H2O的离子方程式为____ 。
②可以从“滤液”中回收副产品____ (填化学式)。
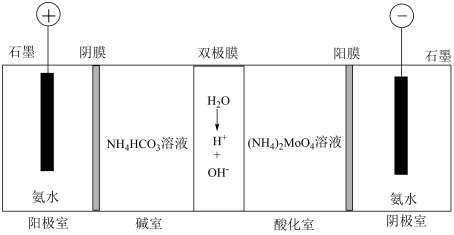
(5)可通过电渗析法制备八钼酸铵[(NH4)4Mo8O26],工作原理如图。其中,阳膜和阴膜分别只允许阳离子、阴离子通过;双极膜中间层中的水解离为H+和OH-,并在直流电场作用下分别向两极迁移。____ 。
②分析酸化室可得到Mo8O 的原因:
的原因:____ 。
| 难溶物 | CaMoO4 | CaCO3 | CaSO4 | FeS | CuS |
| Ksp | 4.1×10-3 | 2.8×10-9 | 5.1×10-5 | 6.3×10-18 | 1.0×10-36 |
 ]=
]= =2.0×1013
=2.0×1013(1)“氧化焙烧”过程:
①MoS2主要转化为CaSO4、
②加入石灰石,有利于降低焙烧温度、
(2)“盐浸”过程,生成MoO
 的离子方程式为
的离子方程式为(3)“盐浸”过程,少量CuO转化为Cu(NH3)
 ,“净化”过程进一步转化为CuS除去。计算反应Cu(NH3)
,“净化”过程进一步转化为CuS除去。计算反应Cu(NH3) (aq)+S2-(aq)
(aq)+S2-(aq) CuS(s)+4NH3(aq)的K=
CuS(s)+4NH3(aq)的K=(4)“酸沉”过程MoO
 会发生聚合生成多钼酸根。
会发生聚合生成多钼酸根。①生成(NH4)2Mo4O13·2H2O的离子方程式为
②可以从“滤液”中回收副产品
(5)可通过电渗析法制备八钼酸铵[(NH4)4Mo8O26],工作原理如图。其中,阳膜和阴膜分别只允许阳离子、阴离子通过;双极膜中间层中的水解离为H+和OH-,并在直流电场作用下分别向两极迁移。
②分析酸化室可得到Mo8O
 的原因:
的原因:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】氯化钠是家庭日常生活中必不可少的一种调味品,海水制盐是氯化钠来源的一种途径。海水晒盐工业流程中,得到的粗盐常含有Mg2+、Ca2+、SO42-等杂质工业提纯粗盐的流程如图所示:
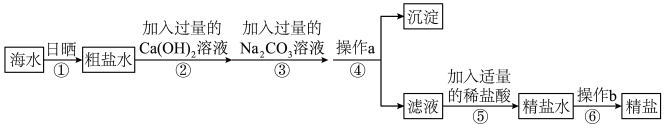
(1)步骤④操作中需要用到玻璃棒,玻璃棒的作用是____________ ;步骤⑥中操作b实验室用到的可直接加热的仪器名称叫____________ 。
(2)如果按以上操作步骤及顺序进行了,则制得的精盐不纯。要获得纯净的精盐,还需添加的试剂是(填化学式)____________ ;该步骤作应该放在(填序号)____________ 之前。
(3)室温下,电解1mol/L500mL的NaCl溶液,当溶液的pH=13时停止电解;写出该电解过程的离子方程式(忽略溶液体积变化,惰性电极):________________________________________________________ ;
要使电解后的溶液恢复到原浓度,需加入(通入)____________ mol____________ (填物质名称)。
(4)用氯碱工业的产物氢氧化钠配制成0.1mol/L的标准溶液,滴定20mL未知浓度的盐酸溶液,需用作____ 指示剂,判定要达到滴定终点的现象:_________________________________ 。

(1)步骤④操作中需要用到玻璃棒,玻璃棒的作用是
(2)如果按以上操作步骤及顺序进行了,则制得的精盐不纯。要获得纯净的精盐,还需添加的试剂是(填化学式)
(3)室温下,电解1mol/L500mL的NaCl溶液,当溶液的pH=13时停止电解;写出该电解过程的离子方程式(忽略溶液体积变化,惰性电极):
要使电解后的溶液恢复到原浓度,需加入(通入)
(4)用氯碱工业的产物氢氧化钠配制成0.1mol/L的标准溶液,滴定20mL未知浓度的盐酸溶液,需用作
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】请阅读下列资料,回答问题。
(1)18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。该反应的化学方程式为_______ 。某同学拟用该原理按如下装置制备并收集纯净的氯气,在虚线框内选用的发生装置_______ “甲”“乙”或“丙”)。
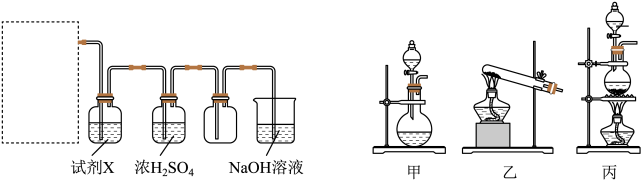
产生的氯气中除水蒸气外还含有_______ (填化学式),试剂X是_______ ,可用NaOH溶液吸收尾气,反应的离子方程式为_______ 。
(2)使用氯气消毒易产生危害人体健康的有机氯化物。用氯气和亚氯酸钠(NaClO2)溶液可制备新的绿色消毒剂二氧化氯(ClO2),反应中还可得到氯化钠。该反应的化学方程式为_______ 。
(1)18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。该反应的化学方程式为

产生的氯气中除水蒸气外还含有
(2)使用氯气消毒易产生危害人体健康的有机氯化物。用氯气和亚氯酸钠(NaClO2)溶液可制备新的绿色消毒剂二氧化氯(ClO2),反应中还可得到氯化钠。该反应的化学方程式为
您最近一年使用:0次



