室温下,向20.00 mL 0.1000mol·L−1HA中滴加0.1000mol·L−1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知Ka(HA)=5×10-4。
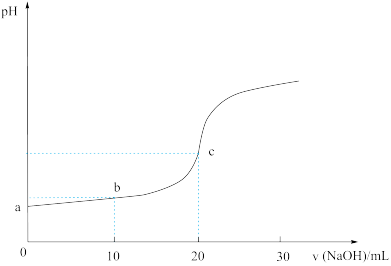
下列说法不正确 的是( )

下列说法
| A.b点时,HA的电离大于A- 的水解,溶液呈酸性 |
| B.从题给数据中无法计算a点时溶液的pH |
| C.忽略溶液混合体积变化,c点时pH近似为8 |
| D.该滴定宜选择酚酞作为终点判断的指示剂 |
更新时间:2020-05-05 12:06:45
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】已知25℃时二元酸 的
的 .下列说法正确的是
.下列说法正确的是
 的
的 .下列说法正确的是
.下列说法正确的是A.在等浓度的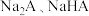 溶液中,水的电离程度前者小于后者 溶液中,水的电离程度前者小于后者 |
B.取 的 的 溶液 溶液 ,加蒸馏水稀释至 ,加蒸馏水稀释至 ,则该溶液 ,则该溶液 |
C.向 溶液中加入 溶液中加入 溶液至 溶液至 ,则 ,则 |
D.向 的 的 溶液中通入HCl气体(忽略溶液体积的变化)至 溶液中通入HCl气体(忽略溶液体积的变化)至 ,则 ,则 的电离度为0.013% 的电离度为0.013% |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】室温下,下列说法正确的是
| A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>b>c |
| B.KNO3溶液和CH3OOONH4溶液pH均为7,但两溶液中水的电离程度不相同 |
| C.5.0×10-3mol·L-1KHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A) |
D.已知某分散系中存在:M(OH)2(s) M2+(aq)+2OH-(aq),K=a,c(M2+)=bmol·L-1时,溶液的pH等于 M2+(aq)+2OH-(aq),K=a,c(M2+)=bmol·L-1时,溶液的pH等于 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】常温下,下列有关叙述正确的是( )
A. 溶液和 溶液和  溶液等体积混合: 溶液等体积混合: |
B. 的 的 溶液与 溶液与 的NaOH溶液等体积混合: 的NaOH溶液等体积混合: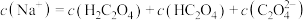 |
C.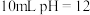 的氢氧化钠溶液中加入 的氢氧化钠溶液中加入 的HA溶液至pH刚好等于7,所得溶液体积 的HA溶液至pH刚好等于7,所得溶液体积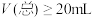 |
D.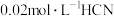 溶液与 溶液与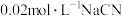 溶液等体积混合,已知混合溶液中 溶液等体积混合,已知混合溶液中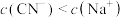 ,则 ,则 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
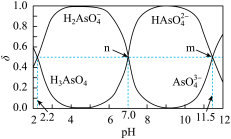
【推荐2】实验室用0.1mol·L-1的NaOH溶液滴定20mL0.1mol·L-1的HAuCl4溶液。溶液中,含氯微粒a、b的分布系数δ、NaOH溶液体积V(NaOH)与pH的关系如图所示。[比如HAuCl4的分布系数,δ(HAuCl4)= 。下列叙述错误的是
。下列叙述错误的是

 。下列叙述错误的是
。下列叙述错误的是
| A.X点对应溶液的pH约为5 |
B.p点对应的溶液中,c(HAuCl4)+c(H+)=c(AuCl )+c(OH-) )+c(OH-) |
C.微粒b为AuCl ,n点对应的溶液中,c(Na+)=c(AuCl ,n点对应的溶液中,c(Na+)=c(AuCl ) ) |
D.滴定到q点时,溶液中c(Na+)>c(AuCl )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】已知在100℃的温度下(本题涉及的溶液其温度均为100℃),水的离子积KW=1.0×10-12mol2·L-2,下列说法中正确的是
| A.将pH=5的H2SO4溶液稀释100倍,pH=7 |
| B.0.001mol·L-1的H2SO4溶液,pH=3 |
| C.0.005mol·L-1的H2SO4溶液与0.01mol·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性 |
| D.将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液的pH=7,则Ba(OH)2溶液与稀盐酸的体积比为2:9 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下、用浓度为0.100mol/L的NaOH溶液分别逐滴加入到20.00mL0.1000mol/L的HX、HY一元酸溶液中,pH随NaOH溶液体积的变化如图。下列说法正确的是


A.V(NaOH)=10.00mL时, |
| B.HX、HY两种酸都是弱酸 |
C.V(NaOH)=20.00mL时,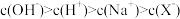 |
D.pH=7时,两份溶液中,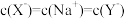 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL 浓度均为0.1000mol/L 的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法不正确的是
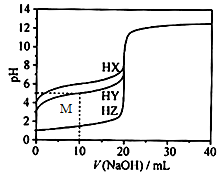

| A.该滴定过程能选择酚酞作为指示剂 |
| B.HZ是强酸 |
| C.HX消耗NaOH溶液20.00mL时,溶液pH>7 |
| D.M 点处的溶液中c(Na+)>c(Y-)>c(H+)>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】25℃时,有c(HA)+c(A-)=0.1mol/L 的一组HA、KA 混合溶液,溶液中c(HA)、c(A-)与pH的关系如下图所示。下列叙述不正确的是

| A.pH= 5.75 的溶液中: c(K+)>c(A- )>c(HA)>q(H+)>c(OH- ) |
| B.欲得W 点所示溶液,起始所加溶液应符合c(HA)+c(A-)=0.1mol/L 且c(KA)<c(HA) |
| C.pH=3.75的溶液中:c(K+)+c(H+)-c(OH-)+c(HA)=0.1mol/L |
| D.若A-的水解常数为Kb 则lgKb=-9.25 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】下列叙述正确的是( )
| A.常温下,pH等于14与pH等于12的NaOH溶液等体积混合后,c(H+)=(10-14+10-10)/2 |
| B.常温下,pH等于5的盐酸加水稀释1000倍后pH等于8 |
| C.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
| D.常温下, pH等于1的盐酸溶液中水的电离程度与pH等于13的Ba(OH)2溶液中水的电离程度相等 |
您最近一年使用:0次



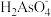 )+2c(
)+2c(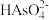 )+3c(
)+3c( )+c(OH-)
)+c(OH-)

