一定条件下,恒容密闭容器中发生某可逆反应,A、B、C三种气体的物质的量浓度随时间的变化如图所示。请回答下列问题:
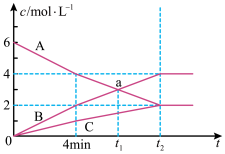
(1)此反应的化学方程式为___ 。
(2)反应从开始至4min末,用A表示的平均反应速率为____ 。
(3)t2的值___ 8(填“大于”、“等于”或“小于”),其原因是___ 。
(4)某同学经分析得出如下结论,其中正确的是___ (填选项序号)。
①该反应在t1时刻达到了反应限度
②保持条件不变,延续足够长的时间,容器中将可能不存在A物质
③该反应达到了反应限度后物质B的质量将保持不变
④改变反应条件将可能改变反应的限度

(1)此反应的化学方程式为
(2)反应从开始至4min末,用A表示的平均反应速率为
(3)t2的值
(4)某同学经分析得出如下结论,其中正确的是
①该反应在t1时刻达到了反应限度
②保持条件不变,延续足够长的时间,容器中将可能不存在A物质
③该反应达到了反应限度后物质B的质量将保持不变
④改变反应条件将可能改变反应的限度
更新时间:2020-06-07 18:35:08
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),5min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(L•min)。
xC(g)+2D(g),5min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(L•min)。
(1)B的反应速率v(B)=__________________ X=____________
(2)A在5min末的浓度是________________
(3)此时容器内的压强与开始时之比为:___________ 。
(4)二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a. 写出它的电子式______________ ;
b. 指出它分子内的键型______________ 。
c. 指出硫元素的化合价为______________ 。
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________ 。Se2Cl2常用作分析试剂,其结构式为_______ 。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________ (填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
c.推测SeO2的化学性质(任写一条即可)_______________________________ 。
 xC(g)+2D(g),5min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(L•min)。
xC(g)+2D(g),5min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(L•min)。(1)B的反应速率v(B)=
(2)A在5min末的浓度是
(3)此时容器内的压强与开始时之比为:
(4)二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a. 写出它的电子式
b. 指出它分子内的键型
c. 指出硫元素的化合价为
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
c.推测SeO2的化学性质(任写一条即可)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如表(累计值):
①哪一时间段反应速率最大_______ min(填0~1、1~2、2~3、3~4、4~5)。反应开始后反应速率先增大的原因是__________ 。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率_______ (设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是( )
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图

①该反应的化学方程式是____________ 。
②该反应达到平衡状态的标志是_________ 。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变 D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为__________ 。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如表(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 100 | 240 | 464 | 576 | 620 |
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图

①该反应的化学方程式是
②该反应达到平衡状态的标志是
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变 D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为
您最近一年使用:0次
【推荐3】氮元素可形成多种化合物,在工业生产中具有重要价值。请回答下列问题:
(1)一定温度下,2L密闭容器中充入0.40molN2O4,发生反应:N2O4(g) 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
①20s内,v(NO2)=___________ mol·L-1·s-1。
②升高温度时气体颜色加深,则正反应是___________ (填“放热”或“吸热”)反应。
③该温度下反应的化学平衡常数数值为___________ 。
④相同温度下,若开始向该容器中充入0.80molNO2,则达到平衡后:c(NO2)___________ 0.30mol·L-1(填“>”、“=”或“<”)。
⑤下列可用于判断该反应达到平衡状态的依据是___________ 。
A.容器中气体压强不再变化
B.容器中气体的密度不再变化
C.容器中气体平均摩尔质量不再变化
D.v(NO2)=v(N2O4)
(2)已知2C(s)+2NO2(g) N2(g)+2CO2(g)△H<0的正反应速率方程为v正=k正p2(NO2),逆反应速率方程为v逆=k逆p(N2)p2(CO2),其中k正、k逆分别为正逆反应速率常数。如图(lgk表示速率常数的对数,
N2(g)+2CO2(g)△H<0的正反应速率方程为v正=k正p2(NO2),逆反应速率方程为v逆=k逆p(N2)p2(CO2),其中k正、k逆分别为正逆反应速率常数。如图(lgk表示速率常数的对数, 表示温度的倒数)所示a、b、c、d四条斜线中,能表示lgk正随
表示温度的倒数)所示a、b、c、d四条斜线中,能表示lgk正随 变化关系的斜线是
变化关系的斜线是___________ ,能表示lgk逆随 变化关系的斜线是
变化关系的斜线是___________ 。

(1)一定温度下,2L密闭容器中充入0.40molN2O4,发生反应:N2O4(g)
 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:| 时间/s | 20 | 40 | 60 | 80 | 100 |
| c(NO2)(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
②升高温度时气体颜色加深,则正反应是
③该温度下反应的化学平衡常数数值为
④相同温度下,若开始向该容器中充入0.80molNO2,则达到平衡后:c(NO2)
⑤下列可用于判断该反应达到平衡状态的依据是
A.容器中气体压强不再变化
B.容器中气体的密度不再变化
C.容器中气体平均摩尔质量不再变化
D.v(NO2)=v(N2O4)
(2)已知2C(s)+2NO2(g)
 N2(g)+2CO2(g)△H<0的正反应速率方程为v正=k正p2(NO2),逆反应速率方程为v逆=k逆p(N2)p2(CO2),其中k正、k逆分别为正逆反应速率常数。如图(lgk表示速率常数的对数,
N2(g)+2CO2(g)△H<0的正反应速率方程为v正=k正p2(NO2),逆反应速率方程为v逆=k逆p(N2)p2(CO2),其中k正、k逆分别为正逆反应速率常数。如图(lgk表示速率常数的对数, 表示温度的倒数)所示a、b、c、d四条斜线中,能表示lgk正随
表示温度的倒数)所示a、b、c、d四条斜线中,能表示lgk正随 变化关系的斜线是
变化关系的斜线是 变化关系的斜线是
变化关系的斜线是
您最近一年使用:0次
【推荐1】二氧化碳的过量排放可对环境造成很大影响。

(1)写出图 1 中岩溶的化学方程式:
(2)CO2是引起温室效应的主要物质,可用于生产甲醇。在恒容的密闭容器中,通入2molCO2和 3molH2,发生的反应为 CO2(g)+3H2(g)  CH3OH(g)+H2O (g) △H <0。
CH3OH(g)+H2O (g) △H <0。
①下列叙述中能说明上述反应处于平衡状态的是
A.生成 3 mol H—H 键的同时生成 6 mol C—H 键
B.v正(CO2)=v逆(H2)
C.气体平均相对分子质量不变
D.二氧化碳和甲醇的物质的量相等
②反应测得 CO2的转化率随温度和压强的变化如图 2,X 代表的物理量是
③保持温度不变,反应达到平衡后,测得气体压强 p 为起始压强 p0的 0.8 倍,反应平衡常数KP=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】工业上,通过丁烷裂解可以获得乙烯、甲烷和丙烯等化工原料:
① (丁烷,g)
(丁烷,g)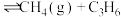 (丙烯,g)
(丙烯,g)
② (丁烷,g)
(丁烷,g)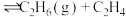 (乙烯,g)
(乙烯,g)
向一体积为2L的恒容密闭容器中充入2mol丁烷,在一定温度和催化剂作用下发生上述2个反应,测得丁烷、丙烯的物质的量与时间关系如图所示。

(1)下列情况表明上述反应达到平衡状态的是_______(填标号)。
(2)0~4min内,乙烷的平均反应速率为_______  。
。
(3)在该条件下,丁烷的平衡转化率为_______ 。
(4)平衡体系中,n(乙烯)∶n(丙烯)_______ 。
①
 (丁烷,g)
(丁烷,g)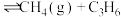 (丙烯,g)
(丙烯,g)②
 (丁烷,g)
(丁烷,g)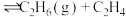 (乙烯,g)
(乙烯,g)向一体积为2L的恒容密闭容器中充入2mol丁烷,在一定温度和催化剂作用下发生上述2个反应,测得丁烷、丙烯的物质的量与时间关系如图所示。

(1)下列情况表明上述反应达到平衡状态的是_______(填标号)。
| A.混合气体密度不随时间变化 |
| B.混合气体平均摩尔质量不随时间变化 |
| C.混合气体总压强不随时间变化 |
| D.混合气体中碳原子总数不随时间变化 |
 。
。(3)在该条件下,丁烷的平衡转化率为
(4)平衡体系中,n(乙烯)∶n(丙烯)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】I.将2molSO2、1molO2和1molSO3投入恒温恒容的密闭容器中发生:2SO2(g)+O2(g)⇌2SO3(g)反应,下列说明反应达到平衡状态的是_______ (填序号)。
①气体密度不变;
②混合气体的总物质的量不变;
③混合气体的平均相对分子质量不变;
④SO2和O2的物质的量之比不变;
⑤消耗的SO2与消耗SO3的速率相等;
⑥2v(SO2)消耗=v(O2)生成;
达到平衡时,n(SO3)的取值范围_______ 。
II.某温度时,在一个2L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)该反应的化学方程式为_______ ;
(2)反应开始至2min,以气体Y表示的平均反应速率为_______ ,X的转化率_______ ,生成的Z的体积百分含量_______ ,(保留三位有效数字)2min时容器内压强是反应开始时的_______ 倍。
(3)4min时,正反应速率_______ 逆反应速率(填“>”“<”或“=”)。
(4)amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=_______ 。
①气体密度不变;
②混合气体的总物质的量不变;
③混合气体的平均相对分子质量不变;
④SO2和O2的物质的量之比不变;
⑤消耗的SO2与消耗SO3的速率相等;
⑥2v(SO2)消耗=v(O2)生成;
达到平衡时,n(SO3)的取值范围
II.某温度时,在一个2L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)该反应的化学方程式为
(2)反应开始至2min,以气体Y表示的平均反应速率为
(3)4min时,正反应速率
(4)amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】已知:2NO2(g) N2O4(g)。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示:
N2O4(g)。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示:

(1)25min时,增加了__ (填化学式);
(2)a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是___ 。
 N2O4(g)。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示:
N2O4(g)。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示:
(1)25min时,增加了
(2)a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】NO2(红棕色)和N2O4(无色)之间发生反应: 。将一定量N2O4气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
。将一定量N2O4气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
(1)该反应为吸热反应,则反应物的化学键断裂要吸收的能量_______ (填“>”、“<”或“=”)生成物的化学键形成要放出的能量。
(2)下列可以说明该反应达到平衡的是_______。
(3)在温度为T的条件下,向该恒容密闭容器中充入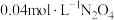 ,
,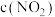 随时间的变化曲线如图所示:
随时间的变化曲线如图所示: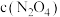 随时间的变化曲线
随时间的变化曲线__________ 。
ii.1~4四个点中, 的点有
的点有_______ 。
iii.反应进行到16min时,N2O4的转化率是_______ %。
 。将一定量N2O4气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
。将一定量N2O4气体充入体积为2L的恒容密闭容器中,控制反应温度为T。(1)该反应为吸热反应,则反应物的化学键断裂要吸收的能量
(2)下列可以说明该反应达到平衡的是_______。
A.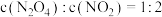 | B.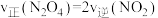 |
| C.容器内气体的颜色不再变化 | D.混合气体的压强不再变化 |
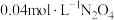 ,
,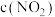 随时间的变化曲线如图所示:
随时间的变化曲线如图所示:
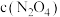 随时间的变化曲线
随时间的变化曲线ii.1~4四个点中,
 的点有
的点有iii.反应进行到16min时,N2O4的转化率是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向。CO2可转化成有机物实现碳循环。在 2 L 的恒温恒容密闭容器中,充入 2molCO2和 6molH2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得 CO2和 CH3OH(g)的浓度随时间变化如图:

(1)从 3 min 到 15min,υ(H2)=____ mol•L-1•min-1;
(2)能说明上述反应达到平衡状态的是_____ 填编号)。
A. 反应中 CO2与 CH3OH 的物质的量浓度之比为 1∶1(即图中交叉点)
B. 混合气体的压强不随时间的变化而变化
C. 单位时间内生成 1mol H2,同时生成 1mol CH3OH
D. 混合气体的平均密度不随时间的变化而变化
(3)平衡时 CO2的转化率为_____ 。
(4)平衡混合气体中 CO2(g)和 H2(g)的物质的量之比是______ 。
(5)第 3 分钟时υ正(CH3OH)______ 第 15 分钟时υ逆(CH3OH)(填“>”、“<” “=”)。

(1)从 3 min 到 15min,υ(H2)=
(2)能说明上述反应达到平衡状态的是
A. 反应中 CO2与 CH3OH 的物质的量浓度之比为 1∶1(即图中交叉点)
B. 混合气体的压强不随时间的变化而变化
C. 单位时间内生成 1mol H2,同时生成 1mol CH3OH
D. 混合气体的平均密度不随时间的变化而变化
(3)平衡时 CO2的转化率为
(4)平衡混合气体中 CO2(g)和 H2(g)的物质的量之比是
(5)第 3 分钟时υ正(CH3OH)
您最近一年使用:0次



