铁及其化合物用途非常广泛。
(1)已知赤铁矿还原冶炼时是逐级进行的,已知:
(a) 3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g)
2Fe3O4(s)+CO2(g)  H = a kJ·mol-1
H = a kJ·mol-1
(b) Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)  H =b kJ·mol-1
H =b kJ·mol-1
(c) Fe3O4(s)+CO(g) 3FeO(s)+CO2 (g)
3FeO(s)+CO2 (g)  H = c kJ·mol-1
H = c kJ·mol-1
①上述反应(a)平衡常数表达式为K=___________________ 。
②反应FeO(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)  H =
H =__________ kJ·mol-1(用含a、b、c的代数式表示)。
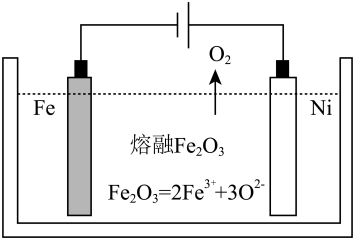
(2)用类似冶炼铝的方法, 在600~1000℃时电解熔融的Fe2O3冶炼铁(装置示意图如图),该法除消耗能量较少外,另一最突出的优点是__________________________________ ;电解时阳极发生的电极反应为____________ 。
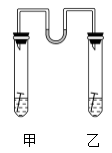
(3)生铁在自然界中可发生析氢腐蚀和吸氧腐蚀,析氢腐蚀的负极的电极反应式为_________ ;如图所示,纯铁处于a、b、c三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填字母)_____________ 。

(1)已知赤铁矿还原冶炼时是逐级进行的,已知:
(a) 3Fe2O3(s)+CO(g)
 2Fe3O4(s)+CO2(g)
2Fe3O4(s)+CO2(g)  H = a kJ·mol-1
H = a kJ·mol-1(b) Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)  H =b kJ·mol-1
H =b kJ·mol-1(c) Fe3O4(s)+CO(g)
 3FeO(s)+CO2 (g)
3FeO(s)+CO2 (g)  H = c kJ·mol-1
H = c kJ·mol-1①上述反应(a)平衡常数表达式为K=
②反应FeO(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)  H =
H =(2)用类似冶炼铝的方法, 在600~1000℃时电解熔融的Fe2O3冶炼铁(装置示意图如图),该法除消耗能量较少外,另一最突出的优点是

(3)生铁在自然界中可发生析氢腐蚀和吸氧腐蚀,析氢腐蚀的负极的电极反应式为

更新时间:2020-06-16 22:59:33
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】(1)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。
 直接氧化法可按下列催化过程进行:
直接氧化法可按下列催化过程进行:
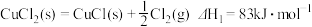
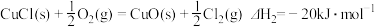
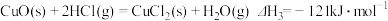
则 的
的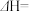
_________  。
。
(2)环戊二烯(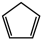 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。
已知: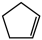 (g)=
(g)= (g)+H2(g) ∆H1=100.3kJ·mol-1①
(g)+H2(g) ∆H1=100.3kJ·mol-1①
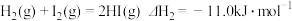 ②
②
对于反应: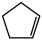 (g)+I2(g)=
(g)+I2(g)=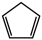 (g)+2HI(g)③,∆H3=
(g)+2HI(g)③,∆H3=_________ kJ·mol-1
(3)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点,甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为 和
和 ,其物质的量之比为
,其物质的量之比为 ,甲烷和水蒸气反应的方程式是
,甲烷和水蒸气反应的方程式是________ 。
②已知反应器中还存在如下反应:
i.
ii.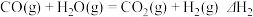
iii. ......
......
iii为积炭反应,利用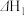 和
和 计算
计算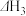 时,还需要利用
时,还需要利用_______ 反应的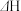 。
。
 直接氧化法可按下列催化过程进行:
直接氧化法可按下列催化过程进行: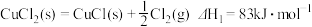
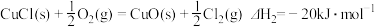
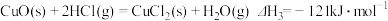
则
 的
的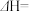
 。
。(2)环戊二烯(
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。已知:
 (g)=
(g)= (g)+H2(g) ∆H1=100.3kJ·mol-1①
(g)+H2(g) ∆H1=100.3kJ·mol-1①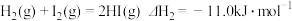 ②
②对于反应:
 (g)+I2(g)=
(g)+I2(g)= (g)+2HI(g)③,∆H3=
(g)+2HI(g)③,∆H3=(3)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点,甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为
 和
和 ,其物质的量之比为
,其物质的量之比为 ,甲烷和水蒸气反应的方程式是
,甲烷和水蒸气反应的方程式是②已知反应器中还存在如下反应:
i.

ii.
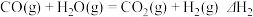
iii.
 ......
......iii为积炭反应,利用
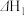 和
和 计算
计算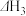 时,还需要利用
时,还需要利用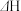 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)已知:①Fe(s)+1/2O2(g)=FeO(s) ΔH1=-272.0kJ·mol-1;
②2Al(s)+3/2O2(g)=Al2O3(s) ΔH2=-1675.7kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是__________ 。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____ (填“正”或“负”)极。F电极上的电极反应式为________ 。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因______ 。


(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为____ 。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为___ mol。
②2Al(s)+3/2O2(g)=Al2O3(s) ΔH2=-1675.7kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因


(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】氮及其化合物在工农业生产、生活中有着重要作用。
(1)在T℃时,将0.6molH2和0.4molN2置于容积为2 L的密闭容器中(压强为mPa)发生反应:3H2+N2 2NH3△H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为
2NH3△H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为___ mol·L-1·min-1。

(2)仍在T℃时,将0.6molH2和0.4molN2置于一容积可变的密闭容 器中。
①下列各项能说明该反应已达到平衡状态的是______ (填序号)。
a.容器内N2、H2、NH3的浓度之比为l:3:2
b.3v正(N2)=v逆(H2)
c.3v正(H2)=2v逆(NH3)
d.混合气体的密度保持不变
e.容器中气体的平均相对分子质量不随时间而变化
②该条件下达到平衡时NH3的体积分数与题(1)条件下NH3的体积分数相比________ (填“变大”“变小”或“不变”)。
③达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改 变的条件可能是_________ 。

a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
(3)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。 氨气能将氮氧化物还原为氮气和水,其反应机理为:
2NH3(g)+5NO2(g)=7NO(g)+3H2O(g) H=-akJ·mol-1
H=-akJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) H=-bkJ·mol-1
H=-bkJ·mol-1
则NH3直接将NO2还原为N2的热化学方程式为:______________ 。
若标准状况下NO与NO2混合气体40.32L被足量氨水完全吸收,产生标准状况下氮气42.56L。该混合气体中NO与NO2的体积之比为_______ 。
(1)在T℃时,将0.6molH2和0.4molN2置于容积为2 L的密闭容器中(压强为mPa)发生反应:3H2+N2
 2NH3△H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为
2NH3△H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为
(2)仍在T℃时,将0.6molH2和0.4molN2置于一容积可变的密闭容 器中。
①下列各项能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为l:3:2
b.3v正(N2)=v逆(H2)
c.3v正(H2)=2v逆(NH3)
d.混合气体的密度保持不变
e.容器中气体的平均相对分子质量不随时间而变化
②该条件下达到平衡时NH3的体积分数与题(1)条件下NH3的体积分数相比
③达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改 变的条件可能是

a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
(3)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。 氨气能将氮氧化物还原为氮气和水,其反应机理为:
2NH3(g)+5NO2(g)=7NO(g)+3H2O(g)
 H=-akJ·mol-1
H=-akJ·mol-14NH3(g)+6NO(g)=5N2(g)+6H2O(g)
 H=-bkJ·mol-1
H=-bkJ·mol-1则NH3直接将NO2还原为N2的热化学方程式为:
若标准状况下NO与NO2混合气体40.32L被足量氨水完全吸收,产生标准状况下氮气42.56L。该混合气体中NO与NO2的体积之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】甲烷燃料电池采用铂作为电极材料,两个电极上分别通入 和
和 ,电解质溶液为KOH溶液。某研究小组将上述两个甲烷燃料电池串联后作为电源,进行电解饱和NaCl溶液的实验,如下图所示。回答下列问题。
,电解质溶液为KOH溶液。某研究小组将上述两个甲烷燃料电池串联后作为电源,进行电解饱和NaCl溶液的实验,如下图所示。回答下列问题。

(1)甲烷燃料电池工作时,其电极反应分别为:正极___________ ;负极___________ 。
(2)闭合开关K后,a、b电极上均有气体产生,其中b电极上得到的是___________ ,电解NaCl溶液的总反应式为___________ 。
(3)若每个电池甲烷通入量为1L(标准状况),且反应完全,则理论上最多能产生氯气的体积为___________ L(标准状况)。
 和
和 ,电解质溶液为KOH溶液。某研究小组将上述两个甲烷燃料电池串联后作为电源,进行电解饱和NaCl溶液的实验,如下图所示。回答下列问题。
,电解质溶液为KOH溶液。某研究小组将上述两个甲烷燃料电池串联后作为电源,进行电解饱和NaCl溶液的实验,如下图所示。回答下列问题。
(1)甲烷燃料电池工作时,其电极反应分别为:正极
(2)闭合开关K后,a、b电极上均有气体产生,其中b电极上得到的是
(3)若每个电池甲烷通入量为1L(标准状况),且反应完全,则理论上最多能产生氯气的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】装置如图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。氢氧化铁胶体的胶粒带正电荷。请回答:

(1)B极是电源的_______ 极,甲中C的电极反应式为_______ ,溶液的pH_______ (填“变大”“变小”或“不变”)。
(2)乙溶液中总反应的离子方程式是_______ 。一段时间后丁中X极附近的颜色逐渐_______ (填“变深”或“变浅”)。
(3)现用丙装置给铜件镀银,则H应该是_______ (填“铜”或“银”)。
(4)当外电路中通过0.04 mol电子时,甲装置内共收集到0.448 L气体(标准状况),若甲装置内的液体体积为200 mL(电解前后溶液体积不变),则电解前 溶液的物质的量浓度是
溶液的物质的量浓度是_______ 。

(1)B极是电源的
(2)乙溶液中总反应的离子方程式是
(3)现用丙装置给铜件镀银,则H应该是
(4)当外电路中通过0.04 mol电子时,甲装置内共收集到0.448 L气体(标准状况),若甲装置内的液体体积为200 mL(电解前后溶液体积不变),则电解前
 溶液的物质的量浓度是
溶液的物质的量浓度是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】磷有多种化合物,次磷酸(H3PO2)和次磷酸钠(NaH2PO2)常用作化工生产中的还原剂。
(1)工业上可用白磷(P4)和过量的热NaOH溶液反应生成PH3气体和 NaH2PO2。若反应中转移电子数为3NA,则用去还原剂________ mol,若已知NaH2PO2溶液的pH >7,写出H3PO2电离平衡常数Ka的数学表达式:_________________________ 。
(2)向Ba(H2PO2)2溶液中加入盐酸可制备H3PO2,有人说应该用硫酸代替盐酸,请说明用硫酸代替盐酸的优点:____________ 。
(3)可利用H3PO2把溶液中的Ag+还原为银的反应进行化学镀银,已知该反应中还原剂与氧化剂的物质的量之比为1∶4,则反应的离子方程式为______________________________ 。
(4)利用电解原理制备H3PO2的示意图如图所示(阳离子交换膜、阴离子交换膜分别只允许阳离子、阴离子通过)。已知:阳极反应式为4OH--4e- O2↑+2H2O;阴极反应式为2H++2e-
O2↑+2H2O;阴极反应式为2H++2e- H2↑。试分析在阳极室得到H3PO2的原因:
H2↑。试分析在阳极室得到H3PO2的原因:___________________________ 。

(1)工业上可用白磷(P4)和过量的热NaOH溶液反应生成PH3气体和 NaH2PO2。若反应中转移电子数为3NA,则用去还原剂
(2)向Ba(H2PO2)2溶液中加入盐酸可制备H3PO2,有人说应该用硫酸代替盐酸,请说明用硫酸代替盐酸的优点:
(3)可利用H3PO2把溶液中的Ag+还原为银的反应进行化学镀银,已知该反应中还原剂与氧化剂的物质的量之比为1∶4,则反应的离子方程式为
(4)利用电解原理制备H3PO2的示意图如图所示(阳离子交换膜、阴离子交换膜分别只允许阳离子、阴离子通过)。已知:阳极反应式为4OH--4e-
 O2↑+2H2O;阴极反应式为2H++2e-
O2↑+2H2O;阴极反应式为2H++2e- H2↑。试分析在阳极室得到H3PO2的原因:
H2↑。试分析在阳极室得到H3PO2的原因:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】某小组学生研究常见的金属腐蚀现象,分析其原理。按要求回答下列问题。
(1)甲同学设计如图所示对比实验。当a中滴入 溶液后,观察到其中产生气泡的速率较b中的
溶液后,观察到其中产生气泡的速率较b中的__ (填“快”或“慢”)。其原因是_____________________________________________________ 。
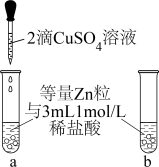
(2)乙同学将锥形瓶内壁用酸化的饱和食盐水润洗后,放入混合均匀的铁粉和碳粉,塞紧瓶塞,同时用压强传感器测得锥形瓶内压强的变化,如图所示。
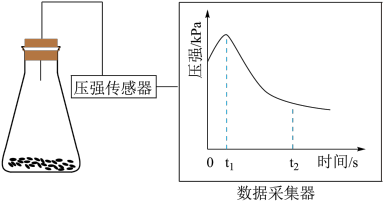
①0~ 时,碳粉表面生成的气体为
时,碳粉表面生成的气体为____________ 。
② ~
~ 时,碳粉表面发生的电极反应式为
时,碳粉表面发生的电极反应式为_____________________________________________________ 。
③0~ 电化学腐蚀过程中,铁极的电极反应式为
电化学腐蚀过程中,铁极的电极反应式为________________________________________________ 。
(3)丙同学研读如下一次性保暖贴说明书,并分析暖贴工作原理。
①暖贴工作时,铁粉发生的反应为________________________ (填“氧化反应”或“还原反应”)。
②当暖贴放热结束时,铁粉转化成的物质中可能含有________________________ 。
(1)甲同学设计如图所示对比实验。当a中滴入
 溶液后,观察到其中产生气泡的速率较b中的
溶液后,观察到其中产生气泡的速率较b中的
(2)乙同学将锥形瓶内壁用酸化的饱和食盐水润洗后,放入混合均匀的铁粉和碳粉,塞紧瓶塞,同时用压强传感器测得锥形瓶内压强的变化,如图所示。

①0~
 时,碳粉表面生成的气体为
时,碳粉表面生成的气体为②
 ~
~ 时,碳粉表面发生的电极反应式为
时,碳粉表面发生的电极反应式为③0~
 电化学腐蚀过程中,铁极的电极反应式为
电化学腐蚀过程中,铁极的电极反应式为(3)丙同学研读如下一次性保暖贴说明书,并分析暖贴工作原理。
| 品名:一次性保暖贴 主要成分:铁粉、水、食盐、活性炭、蛭石、吸水性树脂 产品性能:平均温度55,最高温度63,发热时间12小时以上 |
②当暖贴放热结束时,铁粉转化成的物质中可能含有
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】铜在潮湿的空气中也能发生电化学腐蚀。
(1)铜___ (填“能”或“不能”)发生析氢腐蚀,原因是________________________________ 。
(2)若铜在中性或碱性环境中发生电化学腐蚀,则负极反应为________ ,正极反应为________ ,总反应为________ 。得到的产物还可与空气中的CO2继续反应,得到铜绿[Cu2(OH)2CO3],化学方程式是____________ 。
(3)若铜在酸性环境中发生电化学腐蚀,则正极反应为________ ,总反应为___________ 。
(4)工业上制取硫酸铜就是利用(3)的原理。试计算1 t铜理论上可以制得多少吨无水硫酸铜_____ ?
(1)铜
(2)若铜在中性或碱性环境中发生电化学腐蚀,则负极反应为
(3)若铜在酸性环境中发生电化学腐蚀,则正极反应为
(4)工业上制取硫酸铜就是利用(3)的原理。试计算1 t铜理论上可以制得多少吨无水硫酸铜
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义。图为青铜器在潮湿环境中发生的电化学腐蚀的示意图。
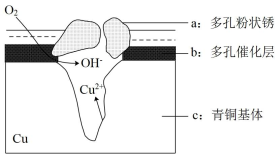
①腐蚀过程中,负极是_____ (填图中字母“a”或“b”或“c”)
②环境中的Clˉ̄扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为_____ ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为_____ L(标准状况)。

①腐蚀过程中,负极是
②环境中的Clˉ̄扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】金属腐蚀的电化学原理可用下图模拟。
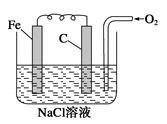
请写出有关电极反应式:
①铁棒上的电极反应式:_______________________
碳棒上的电极反应式:_________________________
(2)该图所表示的是_________________________ (填“析氢”或“吸氧”)腐蚀。
(3)若将O2撤走,并将NaCl溶液改为稀H2SO4溶液,则此图可表示__________ (填“析氢”或“吸氧”)腐蚀原理;若用牺牲阳极法来保护铁棒不被腐蚀溶解,即可将碳棒改为_________ 棒。

请写出有关电极反应式:
①铁棒上的电极反应式:
碳棒上的电极反应式:
(2)该图所表示的是
(3)若将O2撤走,并将NaCl溶液改为稀H2SO4溶液,则此图可表示
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题。
(1)炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会因腐蚀而出现红棕色锈斑。试回答:
铁锅的锈蚀应属于________________ (填“析氢腐蚀”或“吸氧腐蚀”),铁锅锈蚀的负极反应式为:__________________ ;正负极反应产物会继续发生反应,最终生成的红棕色锈斑的主要成分是________________ (填化学式)。
(2)下图是一个电化学过程的示意图。
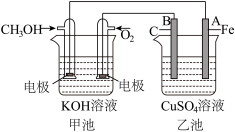
已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
①甲池是_______ 装置,通O2一极的电极反应式为____________________ 。
②乙池中反应的化学方程式为_____________________________ 。如果开始加入的CuSO4溶液足量,当乙池中A(Fe)极的质量增加3.2 g时,甲池中消耗O2_________ mL(标准状况下)。
(1)炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会因腐蚀而出现红棕色锈斑。试回答:
铁锅的锈蚀应属于
(2)下图是一个电化学过程的示意图。

已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
①甲池是
②乙池中反应的化学方程式为
您最近一年使用:0次