金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。
(1)在基态Ti原子中,核外存在_____ 对自旋相反的电子,核外电子占据最高能层的符号是___ ,占据该能层电子的电子云轮廓图形状为____ 。
(2)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2
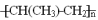 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有_______ ;反应中涉及的元素中电负性最大的是______ 。 三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__________ 。
(3)[TiO(H2O2)2]2+配离子呈黄色。提供中心原子孤电子对的成键原子是_____ (填元素符号);配体之一H2O2分子中氧原子的价层电子对互斥模型是___ 。
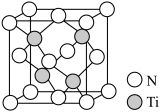
(4)科学家通过X射线探明一种氮化钛的晶体与NaCl的晶体结构相似。氮化钛熔点(2950℃)比氯化钠的高,主要原因是________________ 。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体中Ti原子周围与Ti原子距离最近且相等的N原子的个数为_____ 。已知晶体的密度为ρ g·cm-3,阿伏加 德罗常数为NA,则晶胞边长为____ cm(用含ρ、NA的式子表示)。
(1)在基态Ti原子中,核外存在
(2)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2

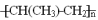 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有(3)[TiO(H2O2)2]2+配离子呈黄色。提供中心原子孤电子对的成键原子是
(4)科学家通过X射线探明一种氮化钛的晶体与NaCl的晶体结构相似。氮化钛熔点(2950℃)比氯化钠的高,主要原因是
(5)有一种氮化钛晶体的晶胞如图所示,该晶体中Ti原子周围与Ti原子距离最近且相等的N原子的个数为

更新时间:2020-07-17 17:27:03
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】钙钛矿是指通式为ABO3的一类化合物,最早发现钙钛矿石中的CaTiO3,因此而得名。钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等的功能材料。
1.基态 原子中未成对电子数为
原子中未成对电子数为___________ 。
2. 的四卤化物熔点如下表所示,
的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是___________ 。
 的立方晶胞如图1所示。
的立方晶胞如图1所示。___________ 。
4.金属离子与氧离子间的作用力为 。
5.晶胞中与 距离最近且相等的
距离最近且相等的 数目为 。
数目为 。
一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子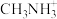 ,其晶胞如图2所示。
,其晶胞如图2所示。 具有相同的空间位置的微粒是 。
具有相同的空间位置的微粒是 。
7.有机碱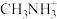 中,
中, 原子的杂化轨道类型是
原子的杂化轨道类型是___________ 。
8.若晶胞参数为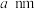 ,则晶体密度为
,则晶体密度为___________  (用
(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
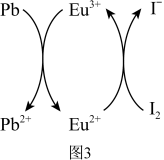
用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了的器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图3所示。___________ 、___________ 。
1.基态
 原子中未成对电子数为
原子中未成对电子数为2.
 的四卤化物熔点如下表所示,
的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是| 化合物 |  |  | 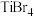 |  |
熔点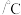 | 377 | -24.12 | 38.3 | 155 |
 的立方晶胞如图1所示。
的立方晶胞如图1所示。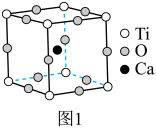
4.金属离子与氧离子间的作用力为 。
| A.离子键 | B.金属键 | C.共价键 | D.分子间作用力 |
 距离最近且相等的
距离最近且相等的 数目为 。
数目为 。| A.4 | B.8 | C.12 | D.16 |
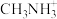 ,其晶胞如图2所示。
,其晶胞如图2所示。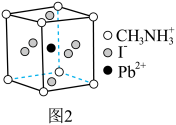
 具有相同的空间位置的微粒是 。
具有相同的空间位置的微粒是 。A. | B. | C. | D.无 |
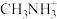 中,
中, 原子的杂化轨道类型是
原子的杂化轨道类型是8.若晶胞参数为
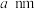 ,则晶体密度为
,则晶体密度为 (用
(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了的器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图3所示。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】铁及其配合物在科研、生产中有着重要的应用。回答以下问题:
(1)写出Fe在元素周期表中的位置___________ 。
(2) 能与
能与 形成
形成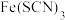 ,其中
,其中 电负性从大到小的顺序是
电负性从大到小的顺序是___________ , 离子的空间构型为
离子的空间构型为___________ 。
(3)邻二氮菲(phen, )能与
)能与 形成橙红色的配合物离子,可表示为
形成橙红色的配合物离子,可表示为 ,常用于
,常用于 定量检测。1mol该配合物离子中有
定量检测。1mol该配合物离子中有___________ mol配位键。某研究小组向反应后的溶液中滴加少量稀硫酸,溶液颜色变浅,简要说明原因:___________ 。
(4)配合物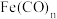 的中心原子价电子数与配体提供的电子数之和为18,一定条件下发生分解反应:
的中心原子价电子数与配体提供的电子数之和为18,一定条件下发生分解反应: 。
。
①分解反应过程中断裂的化学键只有配位键,形成的化学键是___________ 。
②写出配体CO的结构式___________ ,1mol该配合物中含有的 键数目为
键数目为___________ 。
(1)写出Fe在元素周期表中的位置
(2)
 能与
能与 形成
形成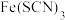 ,其中
,其中 电负性从大到小的顺序是
电负性从大到小的顺序是 离子的空间构型为
离子的空间构型为(3)邻二氮菲(phen,
 )能与
)能与 形成橙红色的配合物离子,可表示为
形成橙红色的配合物离子,可表示为 ,常用于
,常用于 定量检测。1mol该配合物离子中有
定量检测。1mol该配合物离子中有(4)配合物
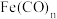 的中心原子价电子数与配体提供的电子数之和为18,一定条件下发生分解反应:
的中心原子价电子数与配体提供的电子数之和为18,一定条件下发生分解反应: 。
。①分解反应过程中断裂的化学键只有配位键,形成的化学键是
②写出配体CO的结构式
 键数目为
键数目为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铜元素可形成多种重要化合物。回答下列问题:
(1)铜元素位于元素周期表中的_____ 区,其基态原子的价电子排布图为_________ 。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是__________ 。
②在[Cu(NH3)4]SO4中,Cu2+与NH3 之间形成的化学键称为______ ,提供孤电子对的成键原子是_________ 。
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为________ 。
④NF3与NH3 的空间构型相同,中心原子的轨道杂化类型均为_________ 。但NF3不易与Cu2+形成化学键,其原因是_______________ 。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。
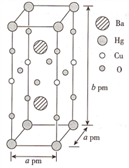
①该物质的化学式为__________ 。
②已知该晶胞中两个Ba2+的间距为c pm.则距离Ba2+最近的Hg+数目为_____ 个,二者的最短距离为_______ pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏伽德罗常数的值为NA,则该晶体的密度为______ g·cm-3。
(1)铜元素位于元素周期表中的
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是
②在[Cu(NH3)4]SO4中,Cu2+与NH3 之间形成的化学键称为
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为
④NF3与NH3 的空间构型相同,中心原子的轨道杂化类型均为
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为
②已知该晶胞中两个Ba2+的间距为c pm.则距离Ba2+最近的Hg+数目为
③设该物质的摩尔质量为M,阿伏伽德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】 、
、 、
、 均为氮族元素,与人们的生活息息相关。回答下列问题:
均为氮族元素,与人们的生活息息相关。回答下列问题:
(1) 核外电子排布式是
核外电子排布式是___________ ,未成对是___________ 个。
(2) 与
与 、
、 的电负性由大到小的顺序是
的电负性由大到小的顺序是___________ ,第一电离能由大到小的顺序是___________ 。
(3)吡啶类化合物 与
与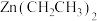 (即
(即 )反应生成有机化合物
)反应生成有机化合物 ,
, 具有优异的催化性能。
具有优异的催化性能。
吡啶类化合物 中
中 原子的杂化类型是
原子的杂化类型是___________ ,化合物 易溶于水,原因是
易溶于水,原因是___________ 。含 有机物
有机物 的分子结构中含
的分子结构中含___________ (填字母代号)。
a.离子键 b.配位键 c. 键 d.
键 d.  键 e.氢键
键 e.氢键
(4) 的晶体结构如图1所示,某种氮化铁的结构如图2所示。
的晶体结构如图1所示,某种氮化铁的结构如图2所示。

①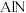 晶体结构单元中,含有的
晶体结构单元中,含有的 、
、 原子个数均是
原子个数均是___________ ;
②若该氮化铁的晶胞边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该氮化铁的晶体密度可表示为
,则该氮化铁的晶体密度可表示为___________  。
。
 、
、 、
、 均为氮族元素,与人们的生活息息相关。回答下列问题:
均为氮族元素,与人们的生活息息相关。回答下列问题:(1)
 核外电子排布式是
核外电子排布式是(2)
 与
与 、
、 的电负性由大到小的顺序是
的电负性由大到小的顺序是(3)吡啶类化合物
 与
与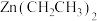 (即
(即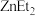 )反应生成有机化合物
)反应生成有机化合物 ,
, 具有优异的催化性能。
具有优异的催化性能。
吡啶类化合物
 中
中 原子的杂化类型是
原子的杂化类型是 易溶于水,原因是
易溶于水,原因是 有机物
有机物 的分子结构中含
的分子结构中含a.离子键 b.配位键 c.
 键 d.
键 d.  键 e.氢键
键 e.氢键(4)
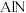 的晶体结构如图1所示,某种氮化铁的结构如图2所示。
的晶体结构如图1所示,某种氮化铁的结构如图2所示。
①
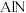 晶体结构单元中,含有的
晶体结构单元中,含有的 、
、 原子个数均是
原子个数均是②若该氮化铁的晶胞边长为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该氮化铁的晶体密度可表示为
,则该氮化铁的晶体密度可表示为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】原子序数由小到大排列的四种短周期元素 X、Y、Z、W,四种元素的原子序数之和为 32,在周期表中 X 是原子半径最小的元素,Y、Z 左右相邻,Z、W 位于同主族。
(1)W 原子的核外电子排布式为__________________ 。
(2)均由 X、Y、Z 三种元素组成的三种常见物质 A.、B、C 分别属于酸、碱、盐,其化学式依次 为________________ 、__________________ 、____________________ ,推测盐中阴离子的空间构型为___________ ,其中心原子杂化方式为_________________________ 。
(3)Z、W 两种元素电负性的大小关系为___________ (填“大于”“等于”或“小于”);Y、Z 两种元素第 一电离能的大小关系为________________ (填“大于”“等于”或“小于”)。
(4)CO 的结构可表示为C≡O,元素Y 的单质Y2 的结构也可表示为Y≡Y。下表是两者的键能数据(单位:kJ⋅mol−1):
①结合数据说明 CO 比 Y2 活泼的原因:_________________________ 。
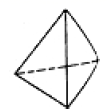
②意大利罗马大学 FulvioCacace 等人获得了极具研究意义的 Y4 分子,其结构如图所示,请结合上表数 据分析,下列说法中,正确的是_____ 。
a. Y4 为一种新型化合物
b. Y4 与 Y2 互为同素异形体
c. Y4 的沸点比 P4(白磷)高
d. 1mol Y4 气体转变为 Y2 将放出 954.6kJ 热量
(1)W 原子的核外电子排布式为
(2)均由 X、Y、Z 三种元素组成的三种常见物质 A.、B、C 分别属于酸、碱、盐,其化学式依次 为
(3)Z、W 两种元素电负性的大小关系为
(4)CO 的结构可表示为C≡O,元素Y 的单质Y2 的结构也可表示为Y≡Y。下表是两者的键能数据(单位:kJ⋅mol−1):
| A−B | A═B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| Y2 | 154.8 | 418.4 | 941.7 |
②意大利罗马大学 FulvioCacace 等人获得了极具研究意义的 Y4 分子,其结构如图所示,请结合上表数 据分析,下列说法中,正确的是

a. Y4 为一种新型化合物
b. Y4 与 Y2 互为同素异形体
c. Y4 的沸点比 P4(白磷)高
d. 1mol Y4 气体转变为 Y2 将放出 954.6kJ 热量
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】由ⅢA、VA族元素组成的新型材料有着广泛用途。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。与BCl3互为等电子体,且由第二周期元素组成的一种阴离子为__________ (填离子符号)。
(2)氨硼烷(H3N—BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料。
①H3N—BH3中N原子的轨道杂化类型为________________ 。
②Ti(BH4)3由TiCl3和LiBH4反应制得。基态Ti3+的未成对电子数为____________ ;BH 的立体构型是
的立体构型是_______ ;该制备反应的化学方程式为______________ 。
(3)氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:
3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。
下列有关叙述错误的是_____________
(4)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为_____________ 。Ga的配位原子(As)数目为________ ;Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGacm和rAscm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为__________ 。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。与BCl3互为等电子体,且由第二周期元素组成的一种阴离子为
(2)氨硼烷(H3N—BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料。
①H3N—BH3中N原子的轨道杂化类型为
②Ti(BH4)3由TiCl3和LiBH4反应制得。基态Ti3+的未成对电子数为
 的立体构型是
的立体构型是(3)氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:
3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。
下列有关叙述错误的是_____________
| A.氨硼烷中存在配位键 |
| B.第一电离能大小关系:N>O>C>B>H |
| C.反应前后碳原子的杂化类型不变 |
| D.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】科技强国,我国科学家在诸多领域取得新突破。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂 、
、 及清洗剂
及清洗剂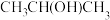 。
。
①基态F原子核外电子有_____ 种空间运动状态,下列为氟原子激发态的电子排布式的是_____ (填标号)。
A.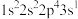 B.
B.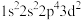 C.
C.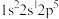 D.
D.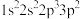
②C、N、O、F四种元素的第一电离能由大到小的顺序为__________ 。
③氟硼酸铵( )中B的杂化方式为
)中B的杂化方式为__________ ,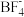 的空间构型为
的空间构型为__________ 。
(2)复兴号高铁车体材质用到了Mn、Co等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是__________ (填元素符号),Mn原子的配位数为__________ ,CH3CN中 键与
键与 键数目之比为
键数目之比为__________ 。
(3)超导材料 具有
具有 型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为
型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为__________ (列出计算式即可) 。
。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂
 、
、 及清洗剂
及清洗剂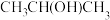 。
。①基态F原子核外电子有
A.
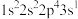 B.
B.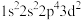 C.
C.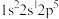 D.
D.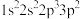
②C、N、O、F四种元素的第一电离能由大到小的顺序为
③氟硼酸铵(
 )中B的杂化方式为
)中B的杂化方式为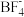 的空间构型为
的空间构型为(2)复兴号高铁车体材质用到了Mn、Co等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是
 键与
键与 键数目之比为
键数目之比为(3)超导材料
 具有
具有 型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为
型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】氮、磷、氟是组成化合物的重要元素。请回答下列问题:
(1)基态磷原子的核外价电子排布图为_______ 。
(2)N、P、F三种元素的电负性由大到小的顺序为______ 。
(3)PF3分子的空间构型为______ 。
(4)N与F可形成化合物N2F2,下列有关N2F2的说法正确的是______ (填字母)。
a. 分子中氮原子的杂化轨道类型为sp2杂化
b. 其结构式为F-N=N-F
c. 其分子有两种不同的空间构型
d. 1 mol N2F2含有的σ键的数目为4NA(NA表示阿伏加 德罗常数的值)
(5)含氮元素的重要配离子[Cu(NH3)4]2+的结构示意图可表示为_______ 。
(6)农药中通常含有磷元素,AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃,其晶胞结构如图所示。
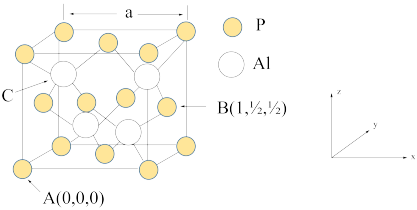
①磷化铝的晶体类型为_______ 。
②A、B点的原子坐标如图所示,则C点的原子坐标为______ 。
③磷化铝的晶胞参数a=546.35 pm(1 pm=10-12m),其密度为_____ g/cm3。(列出计算式即可,用NA表示阿伏加 德罗常数的值)
(1)基态磷原子的核外价电子排布图为
(2)N、P、F三种元素的电负性由大到小的顺序为
(3)PF3分子的空间构型为
(4)N与F可形成化合物N2F2,下列有关N2F2的说法正确的是
a. 分子中氮原子的杂化轨道类型为sp2杂化
b. 其结构式为F-N=N-F
c. 其分子有两种不同的空间构型
d. 1 mol N2F2含有的σ键的数目为4NA(NA表示阿伏加 德罗常数的值)
(5)含氮元素的重要配离子[Cu(NH3)4]2+的结构示意图可表示为
(6)农药中通常含有磷元素,AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃,其晶胞结构如图所示。

①磷化铝的晶体类型为
②A、B点的原子坐标如图所示,则C点的原子坐标为
③磷化铝的晶胞参数a=546.35 pm(1 pm=10-12m),其密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】镍及其化合物用途广泛,可用作催化剂、合金、电器元件等。回答下列问题:
(1)基态Ni原子价电子的轨道表示式为___________ 。
(2)某镍配合物由1个 与2个
与2个 离子组成。
离子组成。
①组成该镍配合物的元素中,第二周期元素的第一电离能由高到低的顺序为___________ (用元素符号表示,下同),配合物中采用 杂化的原子为
杂化的原子为___________ 。
②已知该配合物中只有一种元素的原子与 配位,则与镍配位的原子为
配位,则与镍配位的原子为___________ (填“C”“N”或“O”),原因为___________ 。
(3) 是常温下呈液态的镍的重要配合物,其空间构型为正四面体,其易溶于
是常温下呈液态的镍的重要配合物,其空间构型为正四面体,其易溶于 、苯等有机溶剂的原因为
、苯等有机溶剂的原因为___________ ,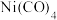 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为___________ 。
(4)由Mg、C和Ni组成的新型超导材料晶体的立方晶胞结构如图所示:___________ 。
②若晶胞参数为a nm,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为___________  。
。
(1)基态Ni原子价电子的轨道表示式为
(2)某镍配合物由1个
 与2个
与2个 离子组成。
离子组成。①组成该镍配合物的元素中,第二周期元素的第一电离能由高到低的顺序为
 杂化的原子为
杂化的原子为②已知该配合物中只有一种元素的原子与
 配位,则与镍配位的原子为
配位,则与镍配位的原子为(3)
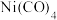 是常温下呈液态的镍的重要配合物,其空间构型为正四面体,其易溶于
是常温下呈液态的镍的重要配合物,其空间构型为正四面体,其易溶于 、苯等有机溶剂的原因为
、苯等有机溶剂的原因为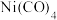 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为(4)由Mg、C和Ni组成的新型超导材料晶体的立方晶胞结构如图所示:
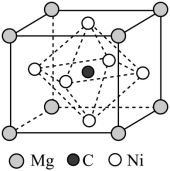
②若晶胞参数为a nm,阿伏加德罗常数的值为
 ,则该晶体的密度为
,则该晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】2019年10月9日,瑞典皇家科学院将2019年度诺贝尔化学奖授予美国JohnBGoodenough教授、M.stanleyWhittlingham教授和日本化学家AkiraYoshino,以表彰其在锂离子电池的发展方面作出的贡献。
(1)基态锂原子核外能量最高的电子所处能级的电子云轮廓图的形状为___ ;基态磷原子第一电离能比硫的___ (填“大”或“小”),原因是___ 。
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+,FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是___ ;
(3)磷酸(H3PO4)和亚磷酸(H3PO3)是磷元素的两种含氧酸。PO43-的空间构型为___ ;亚磷酸与NaOH反应只生成NaHPO3和NaH2PO3两种盐,则H3PO3的结构式为___ 。
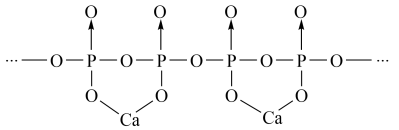
(4)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如图所示:__ (用n表示重复单元数)
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加 德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为__ ;Fe2+与O2-最短核间距为___ pm。
(1)基态锂原子核外能量最高的电子所处能级的电子云轮廓图的形状为
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+,FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是
(3)磷酸(H3PO4)和亚磷酸(H3PO3)是磷元素的两种含氧酸。PO43-的空间构型为
(4)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如图所示:
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加 德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】湿法冶炼是以赤铜矿(Cu2O)精矿为主要原料,通过浸出、置换、电解等流程制备高纯度铜的工艺。
已知:Cu2O晶胞为立方体形,边长为4.26×10−8 cm。
(1)根据图示,每个Cu2O晶胞中含O原子的数目为_______ 个。

(2)计算Cu2O晶体的密度ρ=_______ g/cm3.(结果保留两位小数)
(3)测定晶体结构最常用的仪器为
(4)赤铜矿在稀硫酸中浸出,得到硫酸铜溶液,该反应的离子方程式为_______ 。
已知:Cu2O晶胞为立方体形,边长为4.26×10−8 cm。
(1)根据图示,每个Cu2O晶胞中含O原子的数目为

(2)计算Cu2O晶体的密度ρ=
(3)测定晶体结构最常用的仪器为
| A.质谱仪 | B.核磁共振仪 | C.红外光谱仪 | D.X射线衍射仪 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】我国科研人员设计并制备了在惰性二氧化硅基底上结合Cu和C60的复合催化剂:C60-Cu/SiO2,实现了在温和的压力条件下将有机物乙二酸二甲酯(DMO)氢化成乙二醇。请回答下列问题:
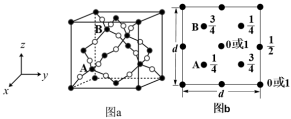
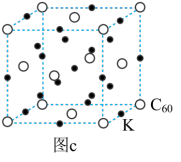
(1)复合催化剂上存在着两种不同价态的铜元素。Cu0促进H2的解离,Cu+促进H和DMO反应,基态Cu+的价电子排布式为___________ ;基底材料SiO2的晶胞结构如图a所示,图b为SiO2晶胞中Si原子的俯视图,其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度。SiA与SiB的距离是___________ 。___________ 个,此化合物的化学式为___________ 。已知晶胞参数为apm,则该超导材料的理论密度ρ=___________ g·cm-3(列出计算式,阿伏伽德罗常数的值为NA)___________ 。
(4)乙二醇是重要的工业产品,可以用作飞机的除冰液及作为合成聚酯纤维的基础材料,也是合成冠醚的原料。合成1mol的18-冠-6理论上需要乙二醇的数目为___________ ;18-冠-6可以基于空穴尺度对碱金属离子进行识别,18-冠-6适配的碱金属离子是___________ 。
(1)复合催化剂上存在着两种不同价态的铜元素。Cu0促进H2的解离,Cu+促进H和DMO反应,基态Cu+的价电子排布式为
(4)乙二醇是重要的工业产品,可以用作飞机的除冰液及作为合成聚酯纤维的基础材料,也是合成冠醚的原料。合成1mol的18-冠-6理论上需要乙二醇的数目为
| 冠醚 | 冠醚空腔直径/pm | 粒子直径/pm |
| 18-冠-6
| 260~320 | Li+(152) |
| K+(276) | ||
| Cs+(334) |
您最近一年使用:0次




