氮及其化合物的转化过程如图所示。下列分析合理的是( )
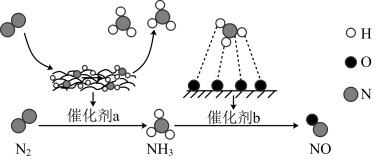

| A.N2 与 H2 反应生成NH3的原子利用率为 100% |
| B.催化剂a 表面发生了极性共价键的断裂和形成 |
| C.在催化剂 b 表面形成氮氧键时,不涉及电子转移 |
| D.催化剂 a、b 不仅能改变反应速率,还能提高反应的平衡转化率 |
更新时间:2020-07-29 09:00:42
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列实验方案设计不能达到目的的是
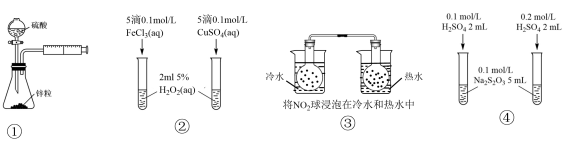

| A.①可用于测定硫酸与锌反应的化学反应速率 |
| B.②可通过实验产生气泡的快慢比较Cu2+、Fe3+对H2O2分解反应的催化效果 |
| C.③可通过球内气体颜色的深浅判断温度对平衡的影响 |
| D.④可用于探究H2SO4浓度对化学反应速率的影响 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】ILs可使甲醇和CO2直接合成有机碳酸酯CH3OCOOCH3(g)(DMC),包括催化和脱水循环两个过程,使CO2的转化率提高到了40.2%,其反应机理如图所示,下列说法错误的是
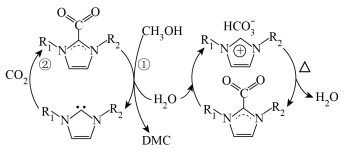

A.其反应方程式为2CH3OH+CO2 CH3OCOOCH3+H2O CH3OCOOCH3+H2O |
| B.ILs降低了活化能,提高了反应速率,不影响平衡移动 |
| C.在催化和脱水循环中甲醇和H2O中存在O-H键的断裂 |
D.通过循环图可以确定,ILs催化剂的结构为: |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】2SO2(g)+O2(g) ⇌2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是( )
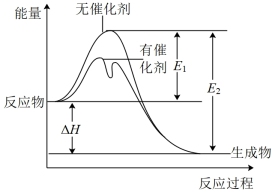

| A.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数 |
| B.0℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g) ⇌2SO3(g) ΔH=-2akJ·mol-l |
| C.该反应中,反应物的总键能小于生成物的总键能 |
| D.ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热 |
您最近一年使用:0次
单选题
|
适中
(0.65)
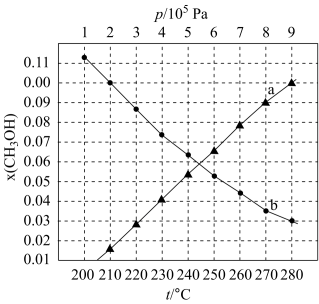
【推荐1】二氧化碳催化加氢制甲醇,合成反应可表示为:
 ,合成反应在起始物
,合成反应在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的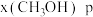 、在
、在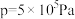 下的
下的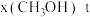 如图所示。下列说法
如图所示。下列说法不 正确的是

 ,合成反应在起始物
,合成反应在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的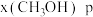 、在
、在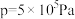 下的
下的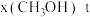 如图所示。下列说法
如图所示。下列说法
A. |
| B.图中对应等压过程的曲线是b |
C.当 时,反应条件可能为 时,反应条件可能为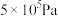 ,210℃或 ,210℃或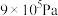 ,250℃ ,250℃ |
D. 、 、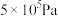 时,测得 时,测得 的平衡转化率为33.3%,则 的平衡转化率为33.3%,则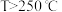 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
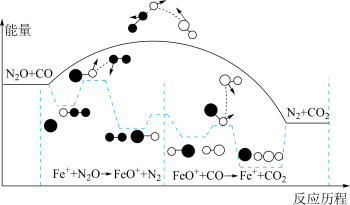
【推荐2】 与
与 是汽车尾气中污染大气的成分,研究表明
是汽车尾气中污染大气的成分,研究表明 与
与 在一定条件下可以转化为无害气体,发生反应的能量变化及反应历程如图所示,两步反应分别为:
在一定条件下可以转化为无害气体,发生反应的能量变化及反应历程如图所示,两步反应分别为:
① (慢);②
(慢);② (快)。下列说法正确的是
(快)。下列说法正确的是
 与
与 是汽车尾气中污染大气的成分,研究表明
是汽车尾气中污染大气的成分,研究表明 与
与 在一定条件下可以转化为无害气体,发生反应的能量变化及反应历程如图所示,两步反应分别为:
在一定条件下可以转化为无害气体,发生反应的能量变化及反应历程如图所示,两步反应分别为:①
 (慢);②
(慢);② (快)。下列说法正确的是
(快)。下列说法正确的是
A.该反应的 |
B.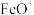 在该反应过程中作催化剂 在该反应过程中作催化剂 |
| C.两步反应均为放热反应,总反应的化学反应速率由反应①决定 |
D.上述过程在 作用下,提高了 作用下,提高了 与 与 的平衡转化率 的平衡转化率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”下列既有旧化学键的断裂,又有新化学键的形成的变化
| A.酒精溶于水 | B.水冻成冰 |
| C.氯化钠受热熔化 | D.氧化钙作为干燥剂吸水 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】我国科学家研制的高效固体催化剂LDH实现了在常温常压、可见光条件下合成NH3,其原理如图所示。下列说法错误的是
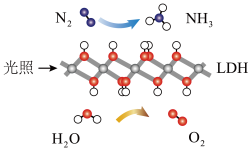
| A.反应过程中存在共价键的断裂与形成 |
| B.反应过程中存在太阳能转化为化学能 |
| C.使用LDH可改变反应的焓变 |
| D.基于LDH合成NH3的过程属于氮的固定 |
您最近一年使用:0次

 和
和 两个温度下发生反应生成
两个温度下发生反应生成 :
: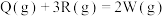
 。
。 的转化率随时间的变化关系如图所示,下列说法正确的是
的转化率随时间的变化关系如图所示,下列说法正确的是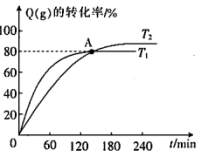
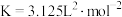
 是重要的化工原料。我国科学家实现了使用铜催化剂将
是重要的化工原料。我国科学家实现了使用铜催化剂将 ,
, 二甲基甲酰胺[
二甲基甲酰胺[ ,简称
,简称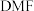 ]转化为三甲胺的合成路线。结合实验与计算机模拟结果,研究单个
]转化为三甲胺的合成路线。结合实验与计算机模拟结果,研究单个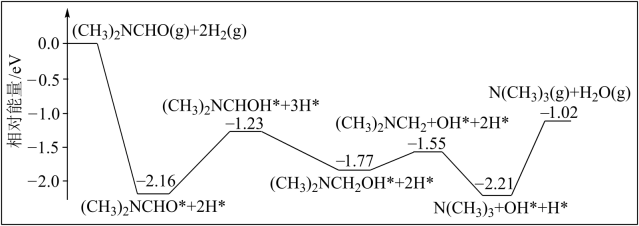
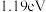
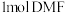 完全转化为三甲胺,则会释放出
完全转化为三甲胺,则会释放出 的能量
的能量

