过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面,如图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2) 的流程。
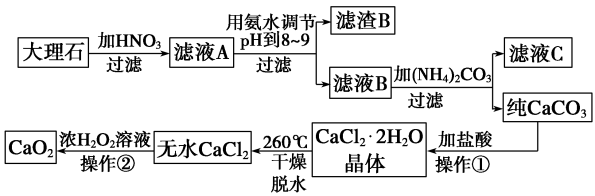
请回答下列问题:
(1)写出加硝酸后反应的离子方程式___________ 。
(2)操作①应包括的步骤是___________ 。
(3)用氨水调节pH至8~9的目的是___________ 。
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中 c( )
)___________ c( )(填“≥”、“≤”、“<”、“>”或“=”)。
)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出加氢氧化钠前该反应的化学方程式__________ ;用简要的文字解释用氢氧化钠调节pH至9~11的原因__________ 。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率________ 。

请回答下列问题:
(1)写出加硝酸后反应的离子方程式
(2)操作①应包括的步骤是
(3)用氨水调节pH至8~9的目的是
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中 c(
 )
) )(填“≥”、“≤”、“<”、“>”或“=”)。
)(填“≥”、“≤”、“<”、“>”或“=”)。(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出加氢氧化钠前该反应的化学方程式
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率
更新时间:2020-09-09 21:27:15
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】甲醇是重要的化工原料,又是可再生能源,工业合成甲醇有如下几种方法:
(1)水煤气合成法。制备甲醇的主要反应为CO(g)+2H2(g)⇌CH3OH(g)。原料气的加工过程中常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇的产率是不同的。实验数据如下表所示。
由表中数据分析可知:一定条件下,CO2对甲醇合成的影响是_______ 。
(2)CO2催化转化法:以CO2、H2为原料在催化剂作用下合成CH3OH涉及的主要反应:
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=-49.5kJ·mol-1
II.CO(g)+2H2(g) ⇌CH3OH(g) △H2=-90.4kJ·mol-1
III.CO2(g)+H2(g) ⇌CO(g)+H2O(g) △H3
①△H3=_______ 。
②一定条件下,向2L恒容密闭容器中通入1mol CO2和3mol H2发生上述反应,经5min达到平衡时,容器中CH3OH(g)为a mol,CO(g)为b mol,则这段时间内以H2O(g)表示的化学反应速率为_______ mol·L-1·min-1。(用含a、b的代数式表示)。
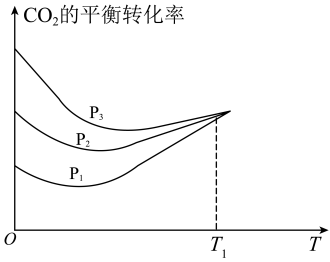
③不同压强下,按照n(CO2):n(H2)=1:3投料,实验测得CO2的平衡转化率随温度(T)变化关系如图所示。则压强P1、P2、P3由大到小的顺序为_______ ,温度高于T1时,CO2的平衡转化率几乎相等的原因是_______ 。
(3)甲烷催化氧化法:
主反应:2CH4(g)+O2(g) ⇌2CH3OH(g)
副反应:CH4(g)+2O2(g) ⇌CO2(g)+2H2O(g)
①科学家将CH4、O2和H2O(g) (H2O是活性催化剂)按照一定体积比在催化剂表面合成甲醇部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。
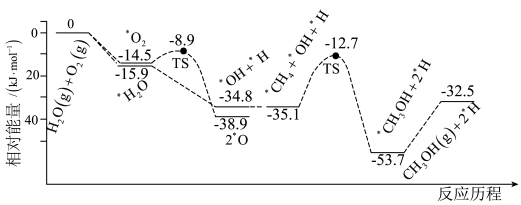
该历程中正反应的最大活化能为_______ kJ·mol-1,写出该步骤的化学方程式_______ 。
②向恒温刚性容器中按照体积比为2:1:7充入CH4、O2和H2O(g),在500K下反应达到平衡时,CH3OH的选择性(甲醇的选择性= ×100%)为90%,CH4的转化率为50%,则副反应的压强平衡常数KP=
×100%)为90%,CH4的转化率为50%,则副反应的压强平衡常数KP=_______ (保留小数点后一位)。
(1)水煤气合成法。制备甲醇的主要反应为CO(g)+2H2(g)⇌CH3OH(g)。原料气的加工过程中常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇的产率是不同的。实验数据如下表所示。
| φ(CO2)-φ(CO)-φ(H2)/% | 0-30-70 | 4-26-70 | 8-22-70 | 20-10-70 | ||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
| 碳转化率/% | 4.9 | 8.8 | 11.0 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 | 8.0 | 12.0 | 22.6 |
(2)CO2催化转化法:以CO2、H2为原料在催化剂作用下合成CH3OH涉及的主要反应:
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=-49.5kJ·mol-1
II.CO(g)+2H2(g) ⇌CH3OH(g) △H2=-90.4kJ·mol-1
III.CO2(g)+H2(g) ⇌CO(g)+H2O(g) △H3
①△H3=
②一定条件下,向2L恒容密闭容器中通入1mol CO2和3mol H2发生上述反应,经5min达到平衡时,容器中CH3OH(g)为a mol,CO(g)为b mol,则这段时间内以H2O(g)表示的化学反应速率为
③不同压强下,按照n(CO2):n(H2)=1:3投料,实验测得CO2的平衡转化率随温度(T)变化关系如图所示。则压强P1、P2、P3由大到小的顺序为

(3)甲烷催化氧化法:
主反应:2CH4(g)+O2(g) ⇌2CH3OH(g)
副反应:CH4(g)+2O2(g) ⇌CO2(g)+2H2O(g)
①科学家将CH4、O2和H2O(g) (H2O是活性催化剂)按照一定体积比在催化剂表面合成甲醇部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。

该历程中正反应的最大活化能为
②向恒温刚性容器中按照体积比为2:1:7充入CH4、O2和H2O(g),在500K下反应达到平衡时,CH3OH的选择性(甲醇的选择性=
 ×100%)为90%,CH4的转化率为50%,则副反应的压强平衡常数KP=
×100%)为90%,CH4的转化率为50%,则副反应的压强平衡常数KP=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】硫酸工厂尾气中常常含有较多的SO2,常采用如下方法进行处理。
Ⅰ.氨水吸收法。匀速向氨水中通入SO2,下列措施能提高尾气中SO2去除率的是___________ (填字母)。
a.增大氨水浓度
b.升高反应温度
c.使尾气与氨水充分接触
d.通入空气使HSO3-转化为SO
Ⅱ.O3氧化法。已知:3O2(g)⇌2O3(g) ΔH1=+287.2 kJ·mol-1
SO2(g)+0.5O2(g)⇌SO3(g) ΔH2=-98 kJ·mol-1
则SO2(g)+O3(g)⇌SO3(g)+O2(g) ΔH3=___________ KJ·mol-1。
Ⅲ.CO还原法。
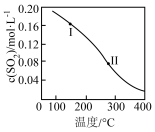
(1)SO2与CO反应的热化学方程式为2CO(g)+SO2(g)⇌S(l)+2CO2(g),ΔH=akJ·mol-1.在体积为1.0L的恒容密闭容器中加入0.4molCO和0.2molSO2.平衡时SO2的物质的量浓度随温度的变化如图所示(图中Ⅰ、Ⅱ点均处于曲线上)。则平衡常数K(状态Ⅰ)_________ K(状态Ⅱ)(填“大于”、“小于”或“等于”,下同)。逆反应速率v逆:v逆(状态Ⅰ)_________ v逆(状态Ⅱ)
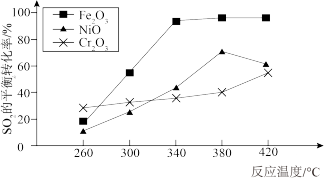
(2)其他条件相同,催化剂不同时,反应相同时间SO2的转化率随反应温度的变化如图所示,260℃条件下选择_____ (填“Fe2O3”、“NiO”或“Cr2O3”)作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择Fe2O3作催化剂的优势是______ 。
Ⅰ.氨水吸收法。匀速向氨水中通入SO2,下列措施能提高尾气中SO2去除率的是
a.增大氨水浓度
b.升高反应温度
c.使尾气与氨水充分接触
d.通入空气使HSO3-转化为SO

Ⅱ.O3氧化法。已知:3O2(g)⇌2O3(g) ΔH1=+287.2 kJ·mol-1
SO2(g)+0.5O2(g)⇌SO3(g) ΔH2=-98 kJ·mol-1
则SO2(g)+O3(g)⇌SO3(g)+O2(g) ΔH3=
Ⅲ.CO还原法。
(1)SO2与CO反应的热化学方程式为2CO(g)+SO2(g)⇌S(l)+2CO2(g),ΔH=akJ·mol-1.在体积为1.0L的恒容密闭容器中加入0.4molCO和0.2molSO2.平衡时SO2的物质的量浓度随温度的变化如图所示(图中Ⅰ、Ⅱ点均处于曲线上)。则平衡常数K(状态Ⅰ)

(2)其他条件相同,催化剂不同时,反应相同时间SO2的转化率随反应温度的变化如图所示,260℃条件下选择

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】关于水煤气变换反应CO(g)+H2O CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
①H2O+* H2O* ②H2O*+*
H2O* ②H2O*+* OH*+H*③OH*+*
OH*+H*③OH*+* O*+H* ④2H*+*
O*+H* ④2H*+* H2+2*
H2+2*
⑤CO+* CO*⑥CO*+O*
CO*⑥CO*+O* CO2*+* ⑦CO2*
CO2*+* ⑦CO2* CO2+*
CO2+*
其中*表示催化剂表面活性位,X*表示金属表面吸附物种。
表1 WGS反应中可能基元反应步骤的活化能数值(单位:kJ·mol-1)

注:表中X(111)表示不同金属的同一晶面,110与111表示不同晶面。
(1)分析表中数据,该机理中WGS反应的速率控制步骤是___________ (填序号)。
(2)由表中数据可计算Cu(111)催化WGS反应的焓变△H=____ kJ·mol-1。
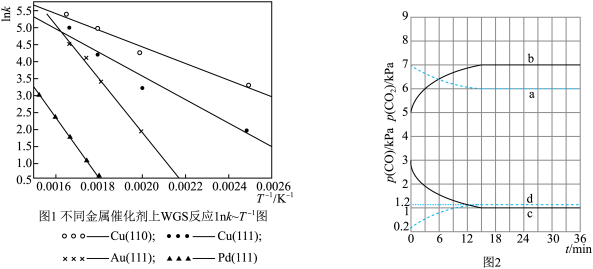
(3)WGS反应的速率表达式:V正=k正·c(CO)·c(H2O),v逆=k逆·c(CO2)·c(H2)(k正、k逆为化学反应速率常数,只与温度有关)。图1是反应速率常数的自然对数与温度倒数的关系图象。由图1可判断550K~600K温度范围内,四种催化剂中活性最好的是_______________ 。
(4)已知T1时WGS反应的KP=18。温度分别为T2、T3(已知T1>T2>T3)时WGS反应中CO和CO2分压随时间变化关系如图2所示,催化剂为Au(111),实验初始时体系中的p(H2O)和p(CO)相等,p(CO2)和p(H2)相等。则T2时,表示p(CO)、p(CO2)的曲线分别是_________ 、_________ ;T2、T3时WGS反应的KP分别为______ 、_______ 。
 CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:①H2O+*
 H2O* ②H2O*+*
H2O* ②H2O*+* OH*+H*③OH*+*
OH*+H*③OH*+* O*+H* ④2H*+*
O*+H* ④2H*+* H2+2*
H2+2*⑤CO+*
 CO*⑥CO*+O*
CO*⑥CO*+O* CO2*+* ⑦CO2*
CO2*+* ⑦CO2* CO2+*
CO2+*其中*表示催化剂表面活性位,X*表示金属表面吸附物种。
表1 WGS反应中可能基元反应步骤的活化能数值(单位:kJ·mol-1)

注:表中X(111)表示不同金属的同一晶面,110与111表示不同晶面。
(1)分析表中数据,该机理中WGS反应的速率控制步骤是
(2)由表中数据可计算Cu(111)催化WGS反应的焓变△H=

(3)WGS反应的速率表达式:V正=k正·c(CO)·c(H2O),v逆=k逆·c(CO2)·c(H2)(k正、k逆为化学反应速率常数,只与温度有关)。图1是反应速率常数的自然对数与温度倒数的关系图象。由图1可判断550K~600K温度范围内,四种催化剂中活性最好的是
(4)已知T1时WGS反应的KP=18。温度分别为T2、T3(已知T1>T2>T3)时WGS反应中CO和CO2分压随时间变化关系如图2所示,催化剂为Au(111),实验初始时体系中的p(H2O)和p(CO)相等,p(CO2)和p(H2)相等。则T2时,表示p(CO)、p(CO2)的曲线分别是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】实验室以含锌废液(主要成分为 ,还含有少量的
,还含有少量的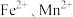 )为原料制备
)为原料制备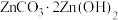 的实验流程如下:
的实验流程如下:
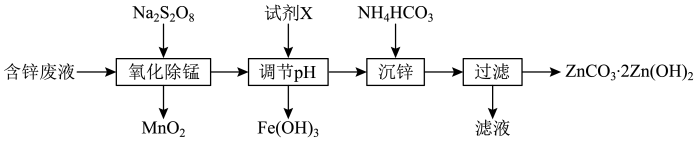
(1)写出基态 原子的电子排布式:
原子的电子排布式:___________ , 中
中 元素的化合价为
元素的化合价为___________ 。
(2)写出“氧化除锰”时反应的离子方程式:___________ 。
(3)常温下“调节 ”时,试剂
”时,试剂 可选用
可选用___________ ;已知溶液中 物质的量浓度为
物质的量浓度为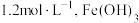 的
的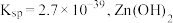 的
的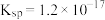 ,则
,则 的调节范围为
的调节范围为___________ 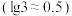 。已知:当溶液中离子浓度小于或等于
。已知:当溶液中离子浓度小于或等于 ,认为该离子已除尽。
,认为该离子已除尽。
(4)写出“沉锌”时反应的离子方程式:___________ 。
(5)“滤液”中的主要成分的用途:___________ 。
(6)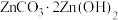 经焙解得到的活性
经焙解得到的活性 晶胞结构如图所示。该晶胞中
晶胞结构如图所示。该晶胞中 原子的配位数为
原子的配位数为___________ ;已知晶胞参数为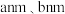 ,则该晶胞的密度为
,则该晶胞的密度为___________  。(写出计算表达式即可)
。(写出计算表达式即可)
 ,还含有少量的
,还含有少量的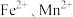 )为原料制备
)为原料制备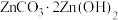 的实验流程如下:
的实验流程如下:
(1)写出基态
 原子的电子排布式:
原子的电子排布式: 中
中 元素的化合价为
元素的化合价为(2)写出“氧化除锰”时反应的离子方程式:
(3)常温下“调节
 ”时,试剂
”时,试剂 可选用
可选用 物质的量浓度为
物质的量浓度为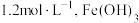 的
的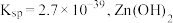 的
的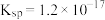 ,则
,则 的调节范围为
的调节范围为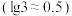 。已知:当溶液中离子浓度小于或等于
。已知:当溶液中离子浓度小于或等于 ,认为该离子已除尽。
,认为该离子已除尽。(4)写出“沉锌”时反应的离子方程式:
(5)“滤液”中的主要成分的用途:
(6)
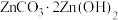 经焙解得到的活性
经焙解得到的活性 晶胞结构如图所示。该晶胞中
晶胞结构如图所示。该晶胞中 原子的配位数为
原子的配位数为 ,则该晶胞的密度为
,则该晶胞的密度为 。(写出计算表达式即可)
。(写出计算表达式即可)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】锗与硅同主族,是重要的战略资源,在航空航天测控、光纤通讯、生物医学等领域都有广泛而重要的应用。煤灰中含有GeO2、SiO2及少量的As2O3、Al2O3等成分,一种从煤灰中提取四氯化锗的流程如图:
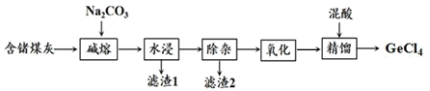
已知:①GeO2、As2O3既能溶于强酸,也能溶于强碱
②GeCl4的熔点为-49.5℃,沸点为83℃,GeCl4容易与AsCl3形成共沸物。
(1)Ge在周期表中位于第四周期___________ 族。
(2)“碱熔”在1000℃下熔炼,GeO2反应的主要化学方程式为___________ 。反应后得到的共熔物中含有的阴离子除CO 、AsO
、AsO 、GeO
、GeO 外,还有
外,还有___________ (填离子符号)
(3)“水浸”中,为提高Ge的浸出率,可以采取的措施有___________ (答2条)。
(4)“除杂”中,加入___________ (填“盐酸”、“氨水”、“Al2O3”、“NaOH溶液”),调节溶液pH=10.5,除去Al和Si。
(5)已知H3AsO3和H3AsO4水溶液中含砷的各种微粒的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图:
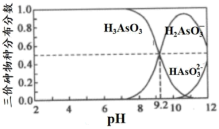
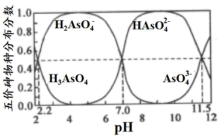
“除杂”后所得的滤液中含砷粒子浓度最大的是___________ 。在“氧化”中,加入适量的NaClO3,结合图写出主要反应的离子方程式___________ 。充分反应后继续调节溶液pH约为5,分离得到GeO2•nH2O。
(6)已知GeO2•nH2O+4HCl GeCl4+(n+2)H2O。在“精馏”中,加入硫酸和7mol/L的盐酸的混酸,硫酸的作用是
GeCl4+(n+2)H2O。在“精馏”中,加入硫酸和7mol/L的盐酸的混酸,硫酸的作用是___________ 。
(7)提取四氯化锗的另一种工艺步骤是:将含锗煤灰用上述混酸的酸浸,过滤后直接蒸馏,这种工艺的缺点是___________ 。

已知:①GeO2、As2O3既能溶于强酸,也能溶于强碱
②GeCl4的熔点为-49.5℃,沸点为83℃,GeCl4容易与AsCl3形成共沸物。
(1)Ge在周期表中位于第四周期
(2)“碱熔”在1000℃下熔炼,GeO2反应的主要化学方程式为
 、AsO
、AsO 、GeO
、GeO 外,还有
外,还有(3)“水浸”中,为提高Ge的浸出率,可以采取的措施有
(4)“除杂”中,加入
(5)已知H3AsO3和H3AsO4水溶液中含砷的各种微粒的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图:

“除杂”后所得的滤液中含砷粒子浓度最大的是

(6)已知GeO2•nH2O+4HCl
 GeCl4+(n+2)H2O。在“精馏”中,加入硫酸和7mol/L的盐酸的混酸,硫酸的作用是
GeCl4+(n+2)H2O。在“精馏”中,加入硫酸和7mol/L的盐酸的混酸,硫酸的作用是(7)提取四氯化锗的另一种工艺步骤是:将含锗煤灰用上述混酸的酸浸,过滤后直接蒸馏,这种工艺的缺点是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】环己酮是无色油状液体, 时在水中的溶解度为
时在水中的溶解度为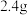 。实验室由环己醇制备环己酮。
。实验室由环己醇制备环己酮。
【实验原理】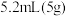 环已醇和
环已醇和 冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
Ⅱ.在室温下继续搅拌 ,然后加入饱和亚硫酸氢钠溶液。
,然后加入饱和亚硫酸氢钠溶液。
Ⅲ.在反应混合物中加入 水、
水、 氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
Ⅳ.在搅拌情况下向馏出液中加入无水碳酸钠至中性,然后再加入精制食盐使之饱和,将此液体倒入分液漏斗,分出有机层。
Ⅴ.向有机层中加入无水 ,静置,过滤,对滤液进行蒸馏,得到产品
,静置,过滤,对滤液进行蒸馏,得到产品 。
。
回答下列问题。
(1)仪器X的名称为_______ 。
(2)步骤Ⅰ中,加入冰醋酸除作为溶剂外,还有的作用是_______ 。用淀粉碘化钾试纸可检验反应后的液体,如果试纸变_______ 色,说明次氯酸钠过量。
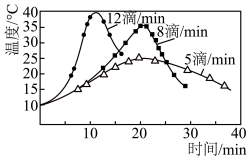
(3)步骤Ⅰ中,次氯酸钠溶液要在冰水浴冷却下逐滴加入,勿使氧化反应进行得过于猛烈而升温过高,否则产物环己酮将进一步被氧化而发生碳链断裂。在次氯酸钠的不同滴加速度下,在冰水浴存在的情况下,溶液温度随滴加时间变化曲线如图,为了控制好反应温度,应选择的滴速为_______ 滴/ 。
。_______ 。
(5)在步骤Ⅳ中,加入精制食盐的目的是_______ 。
(6)在步骤Ⅴ中,加入无水 的作用为
的作用为_______ 。
(7)产品的产率为_______ (精确至0.1%)。
 时在水中的溶解度为
时在水中的溶解度为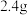 。实验室由环己醇制备环己酮。
。实验室由环己醇制备环己酮。【实验原理】
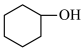 +NaClO
+NaClO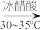
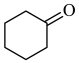 +NaCl+H2O
+NaCl+H2O 
【装置示意图】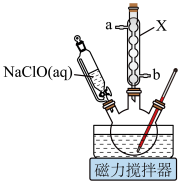
 环已醇和
环已醇和 冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。Ⅱ.在室温下继续搅拌
 ,然后加入饱和亚硫酸氢钠溶液。
,然后加入饱和亚硫酸氢钠溶液。Ⅲ.在反应混合物中加入
 水、
水、 氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。Ⅳ.在搅拌情况下向馏出液中加入无水碳酸钠至中性,然后再加入精制食盐使之饱和,将此液体倒入分液漏斗,分出有机层。
Ⅴ.向有机层中加入无水
 ,静置,过滤,对滤液进行蒸馏,得到产品
,静置,过滤,对滤液进行蒸馏,得到产品 。
。回答下列问题。
(1)仪器X的名称为
(2)步骤Ⅰ中,加入冰醋酸除作为溶剂外,还有的作用是
(3)步骤Ⅰ中,次氯酸钠溶液要在冰水浴冷却下逐滴加入,勿使氧化反应进行得过于猛烈而升温过高,否则产物环己酮将进一步被氧化而发生碳链断裂。在次氯酸钠的不同滴加速度下,在冰水浴存在的情况下,溶液温度随滴加时间变化曲线如图,为了控制好反应温度,应选择的滴速为
 。
。
(5)在步骤Ⅳ中,加入精制食盐的目的是
(6)在步骤Ⅴ中,加入无水
 的作用为
的作用为(7)产品的产率为
您最近一年使用:0次



