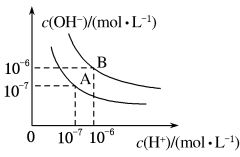
(1)某温度时,测得0.01mol·L-1 NaOH溶液的pH为11,则该温度下水的离子积常数Kw=_________ ,该温度________ (填“高于”或“低于”)25℃。
(2)在(1)所述温度下,将pH=a的NaOH溶液V1L与pH=b的H2SO4溶液V2L混合(忽略体积变化)。
①若所得混合溶液呈中性,且a=12, b=2,则V1:V2=_________ 。
②若所得混合溶液的pH=10,且a=12, b=2,则V1:V2=_________ 。
(2)在(1)所述温度下,将pH=a的NaOH溶液V1L与pH=b的H2SO4溶液V2L混合(忽略体积变化)。
①若所得混合溶液呈中性,且a=12, b=2,则V1:V2=
②若所得混合溶液的pH=10,且a=12, b=2,则V1:V2=
19-20高二·全国·课时练习 查看更多[3]
(已下线)3.1.2 pH的计算与测量-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)河北省石家庄第四十一中学2020-2021学年高二上学期期中考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第1节 水与水溶液
更新时间:2020-09-17 11:48:42
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】常温下,有0.1mol/L的四种溶液:①HCl②CH3COOH③NaOH④Na2CO3。
回答下列问题:
(1)用化学方程式解释溶液②呈酸性的原因:_____ 。
(2)将0.1L溶液③加水稀释至1L后溶液的pH=_____ 。
(3)等体积的溶液①、②分别与一定量的溶液③反应,所得溶液的pH均等于7,消耗溶液③的体积:①_____ ②(填“>”、“<”或“=”)。
(4)溶液④根据碳元素质量守恒,则有如下关系: _____+_____+_____=0.1mol/L。_____
(5)常温下,下列关于溶液②的判断正确的是_____。
回答下列问题:
(1)用化学方程式解释溶液②呈酸性的原因:
(2)将0.1L溶液③加水稀释至1L后溶液的pH=
(3)等体积的溶液①、②分别与一定量的溶液③反应,所得溶液的pH均等于7,消耗溶液③的体积:①
(4)溶液④根据碳元素质量守恒,则有如下关系: _____+_____+_____=0.1mol/L。
(5)常温下,下列关于溶液②的判断正确的是_____。
| A.c(CH3COO-)=0.1mol/L |
| B.溶液中c(H+)>c(CH3COO-)>c(OH-) |
| C.加入CH3COONa(s),c(H+)不变 |
| D.滴入NaOH浓溶液,溶液导电性增强 |
您最近半年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】(1)25℃时,浓度为0.1mol·L-1的5种溶液:①HCl;②CH3COOH;③Ba(OH)2;④Na2CO3;⑤KCl,溶液pH由小到大的顺序为___ (填编号)。
(2)MgCl2·6H2O制无水MgCl2要在___ 气流中加热。
(3)普通泡沫灭火器内的玻璃筒里﹣盛硫酸铝溶液,铁筒里﹣盛碳酸氢钠溶液,其化学反应的原理是___ (用离子方程式表示)。
(4)常温下,若1体积的硫酸与2体积pH=11的氢氧化钠溶液混合后的溶液的pH=3(混合后体积变化不计),则二者物质的量浓度之比为___ 。
(5)常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(A-)=___ mol/L(填精确计算结果的具体数字)。
(6)为证明盐的水解是吸热的,三位同学分别设计了如下方案,其中正确的是___ (填序号)。
a.甲同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的
b.乙同学:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的
c.丙同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的
(2)MgCl2·6H2O制无水MgCl2要在
(3)普通泡沫灭火器内的玻璃筒里﹣盛硫酸铝溶液,铁筒里﹣盛碳酸氢钠溶液,其化学反应的原理是
(4)常温下,若1体积的硫酸与2体积pH=11的氢氧化钠溶液混合后的溶液的pH=3(混合后体积变化不计),则二者物质的量浓度之比为
(5)常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(A-)=
(6)为证明盐的水解是吸热的,三位同学分别设计了如下方案,其中正确的是
a.甲同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的
b.乙同学:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的
c.丙同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的
您最近半年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】下表是不同温度下水的离子积的数据。试回答以下问题:
(1)若 ,则a
,则a_______  (填“>”、“<”或“=”),做此判断的理由是
(填“>”、“<”或“=”),做此判断的理由是_______ 。
(2) 时,某
时,某 溶液中
溶液中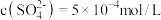 ,取该溶液
,取该溶液 加水稀释至
加水稀释至 ,则稀释后溶液中
,则稀释后溶液中
_______ 。
(3)在 温度下,测得某溶液
温度下,测得某溶液 ,①则该溶液显
,①则该溶液显_______ (填“酸”、“碱”或“中)性;
同样在 温度下
温度下 的
的 溶液
溶液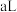 与
与 的
的 溶液
溶液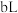 混合:
混合:
②若所得混合液为中性,则
_______ ;
③若所得混合液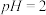 ,则
,则
_______ 。
(4)加热蒸干 溶液并灼烧所得固体,最终得到的产物是
溶液并灼烧所得固体,最终得到的产物是_______ 。
(5)常温下,已知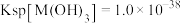 ,要使溶液中的
,要使溶液中的 降至
降至 ,则应调节溶液
,则应调节溶液
_______ 。
(6)已知:a.常温下,醋酸和 的电离平衡常数均为
的电离平衡常数均为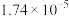 ;
;
b.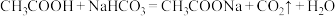 。
。
则 溶液呈
溶液呈_______ 性(填“酸”“碱”或“中”,下同), 溶液呈
溶液呈_______ 性, 溶液中物质的量浓度最大的离子是
溶液中物质的量浓度最大的离子是_______ (填化学式)。
温度/ | 25 |  |  |
| 水的离子积 |  | a | 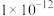 |
 ,则a
,则a (填“>”、“<”或“=”),做此判断的理由是
(填“>”、“<”或“=”),做此判断的理由是(2)
 时,某
时,某 溶液中
溶液中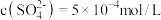 ,取该溶液
,取该溶液 加水稀释至
加水稀释至 ,则稀释后溶液中
,则稀释后溶液中
(3)在
 温度下,测得某溶液
温度下,测得某溶液 ,①则该溶液显
,①则该溶液显同样在
 温度下
温度下 的
的 溶液
溶液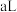 与
与 的
的 溶液
溶液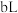 混合:
混合:②若所得混合液为中性,则

③若所得混合液
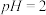 ,则
,则
(4)加热蒸干
 溶液并灼烧所得固体,最终得到的产物是
溶液并灼烧所得固体,最终得到的产物是(5)常温下,已知
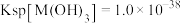 ,要使溶液中的
,要使溶液中的 降至
降至 ,则应调节溶液
,则应调节溶液
(6)已知:a.常温下,醋酸和
 的电离平衡常数均为
的电离平衡常数均为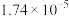 ;
;b.
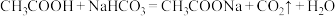 。
。则
 溶液呈
溶液呈 溶液呈
溶液呈 溶液中物质的量浓度最大的离子是
溶液中物质的量浓度最大的离子是
您最近半年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】已知水在25 ℃和95 ℃时的电离平衡曲线如图所示:

(1)25 ℃时水的电离平衡曲线应为__________ (填“A”或“B”)。
(2)95 ℃时水的离子积Kw=__________ ,cH+==__________
(3)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____ 。
(4)95 ℃时,若100 mL pH1=a的某强酸溶液与1 mL pH2=b的某强碱溶液混合后,所得溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____ 。
(5)在曲线B对应的温度下,将pH=2的某HA溶液和pH=10的NaOH溶液等体积混合,所得溶液的pH=5。请分析其原因:_________________ 。

(1)25 ℃时水的电离平衡曲线应为
(2)95 ℃时水的离子积Kw=
(3)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(4)95 ℃时,若100 mL pH1=a的某强酸溶液与1 mL pH2=b的某强碱溶液混合后,所得溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
(5)在曲线B对应的温度下,将pH=2的某HA溶液和pH=10的NaOH溶液等体积混合,所得溶液的pH=5。请分析其原因:
您最近半年使用:0次
填空题
|
较易
(0.85)
【推荐2】在不同温度下的水溶液中c(H+)=x mol/L,c(OH-)=y mol/L,x与y的关系如图所示。
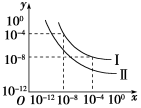
曲线Ⅰ代表的温度下,水的离子积为_______ ,曲线Ⅰ所代表的温度_______ (填“高于”、“低于”或“等于”)曲线Ⅱ所代表的温度。你判断的依据是_______ 。

曲线Ⅰ代表的温度下,水的离子积为
您最近半年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】回答下列问题
(1)某温度时,测得0.01 的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=
的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=_______ 该温度(填“>”“<”或“=”)_______ 25℃。
(2)在此温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=_______ 。
②若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=_______ 。
(3)该温度下, 的溶液呈
的溶液呈_______ (填“酸性”、“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的
_______  。
。
(1)某温度时,测得0.01
 的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=
的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=(2)在此温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=
②若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=
(3)该温度下,
 的溶液呈
的溶液呈
 。
。
您最近半年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】(1)写出NH4HSO4溶液的电离方程式___ ,写出NaHCO3水解的离子方程式___ 。
(2)一定量的稀H2SO4溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是___ (填字母)。
A.加CH3COONa固体 B.加NH4Cl固体 C.加Ba(NO3)2溶液 D.加氨水 E.加Na2SO4溶液
(3)25℃时,pH=2的NaHSO4溶液中,溶液的c(OH-)=___ mol/L。
(4)在一定温度下,有a.盐酸b.硫酸c.醋酸三种酸:(请用相应字母填)
①当三种酸物质的量浓度相同时,c(H+)由小到大的顺序是___ 。
②若三者pH相同且体积相等,中和NaOH的能力由大到小的顺序是___ 。
③同体积、同物质的量浓度的三种酸,中和NaOH的能力由小到大的顺序是___ 。
④当三种酸物质的量浓度相同时,与铁反应的速率由小到大的顺序是___ 。
(5)25℃时,将体积Va、pH=a的某一元强碱与体积为Vb、pH=b的某二元强酸混合。
①若所得溶液的pH=12,且a=13,b=2,则Va∶Vb=___ 。
②为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg 。25℃时,溶液的pH与AG的换算公式为AG=
。25℃时,溶液的pH与AG的换算公式为AG=___ ,若溶液呈中性,则AG=___ 。
③若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4___ (填“可”或“否”)。
(2)一定量的稀H2SO4溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是
A.加CH3COONa固体 B.加NH4Cl固体 C.加Ba(NO3)2溶液 D.加氨水 E.加Na2SO4溶液
(3)25℃时,pH=2的NaHSO4溶液中,溶液的c(OH-)=
(4)在一定温度下,有a.盐酸b.硫酸c.醋酸三种酸:(请用相应字母填)
①当三种酸物质的量浓度相同时,c(H+)由小到大的顺序是
②若三者pH相同且体积相等,中和NaOH的能力由大到小的顺序是
③同体积、同物质的量浓度的三种酸,中和NaOH的能力由小到大的顺序是
④当三种酸物质的量浓度相同时,与铁反应的速率由小到大的顺序是
(5)25℃时,将体积Va、pH=a的某一元强碱与体积为Vb、pH=b的某二元强酸混合。
①若所得溶液的pH=12,且a=13,b=2,则Va∶Vb=
②为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg
 。25℃时,溶液的pH与AG的换算公式为AG=
。25℃时,溶液的pH与AG的换算公式为AG=③若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4
您最近半年使用:0次