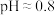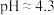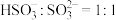常温下,有0.1mol/L的四种溶液:①HCl②CH3COOH③NaOH④Na2CO3。
回答下列问题:
(1)用化学方程式解释溶液②呈酸性的原因:_____ 。
(2)将0.1L溶液③加水稀释至1L后溶液的pH=_____ 。
(3)等体积的溶液①、②分别与一定量的溶液③反应,所得溶液的pH均等于7,消耗溶液③的体积:①_____ ②(填“>”、“<”或“=”)。
(4)溶液④根据碳元素质量守恒,则有如下关系: _____+_____+_____=0.1mol/L。_____
(5)常温下,下列关于溶液②的判断正确的是_____。
回答下列问题:
(1)用化学方程式解释溶液②呈酸性的原因:
(2)将0.1L溶液③加水稀释至1L后溶液的pH=
(3)等体积的溶液①、②分别与一定量的溶液③反应,所得溶液的pH均等于7,消耗溶液③的体积:①
(4)溶液④根据碳元素质量守恒,则有如下关系: _____+_____+_____=0.1mol/L。
(5)常温下,下列关于溶液②的判断正确的是_____。
| A.c(CH3COO-)=0.1mol/L |
| B.溶液中c(H+)>c(CH3COO-)>c(OH-) |
| C.加入CH3COONa(s),c(H+)不变 |
| D.滴入NaOH浓溶液,溶液导电性增强 |
21-22高二上·天津河北·期末 查看更多[2]
更新时间:2022-03-08 11:01:36
|
相似题推荐
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】常温下,将某一元酸HX和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若a___ 7(填“>”“<”或“=”),则HX为强酸;若a ____ 7(填“>”“<”或“=”),则HX为弱酸。
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是____ 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是___ 酸(填“强”或“弱”)。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=__ mol/L。
实验 编号 | HX物质的量 浓度(mol/L) | NaOH物质的 量浓度(mol/L) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c1 | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | c2 | c2 | pH=10 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若a
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】物质A—E都是由下表中的离子组成或生成的,常温下各物质从lmL稀释到1000mL,pH的变化如图l所示,其中A与D反应得到E。请回答:
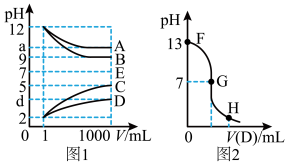
(1)根据图1中各物质的pH变化关系,写出下列物质的化学式:B:___ 。
(2)图l中a>9的理由是___ 。
(3)另取浓度为C1的B溶液25ml,向其中逐滴滴加0.2mol/L的D溶液,滴定过程中溶液pH的变化曲线如图2所示。
①C1为___ 。
②G点溶液呈中性,则加入D溶液的体积V___ (填“>”、“<’’或“=”)12.5mL。
③常温下B、C溶液的pH分别是a、b且a+b=13,则将B、C混合恰好完全反应时所消耗B、C溶液的体积比VB:VC=___ 。
| 阳离子 | NH 、H+、Na+ 、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |

(1)根据图1中各物质的pH变化关系,写出下列物质的化学式:B:
(2)图l中a>9的理由是
(3)另取浓度为C1的B溶液25ml,向其中逐滴滴加0.2mol/L的D溶液,滴定过程中溶液pH的变化曲线如图2所示。
①C1为
②G点溶液呈中性,则加入D溶液的体积V
③常温下B、C溶液的pH分别是a、b且a+b=13,则将B、C混合恰好完全反应时所消耗B、C溶液的体积比VB:VC=
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】Ⅰ.已知95 ℃时水的离子积KW=1×10-12,25 ℃时KW=1×10-14,回答下列问题:
(1)95 ℃时水的电离常数_______ (填“>”“=”或“<”) 25 ℃时水的电离常数。
(2)95 ℃纯水中c(H+)_______ (填“>”“=”或“<”)c(OH-)。
(3)95 ℃时向纯水中加入NaOH,c(OH-)=1×10-1 mol·L-1,此时pH=_______ 。
Ⅱ.(25 ℃),将20mL0.01 mol·L-1 KOH溶液与30mL0.005mol·L-1H2SO4溶液混合并加水至100ml,求混合液的pH值_______________ (写计算过程)。
(1)95 ℃时水的电离常数
(2)95 ℃纯水中c(H+)
(3)95 ℃时向纯水中加入NaOH,c(OH-)=1×10-1 mol·L-1,此时pH=
Ⅱ.(25 ℃),将20mL0.01 mol·L-1 KOH溶液与30mL0.005mol·L-1H2SO4溶液混合并加水至100ml,求混合液的pH值
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】25 ℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①____________________________________ ;
②____________________________________ ;
③____________________________________ 。
①
②
③
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】已知Ka(CH3COOH)=1.75×10-5,试计算0.1 mol·L-1 CH3COOH溶液中H+的浓度(写出计算过程) ______ 。
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】常温下,向100mL0.01mol/LHCl溶液中逐滴加入0.02mol/LMOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

(1)常温下一定浓度的MCl稀溶液的pH___________ (填“>”、“<”或“=”)7,用离子方程式表示其原因___________ 。
(2)请写出N点所对应的溶液中离子浓度的大小关系:___________ 。
(3)K点对应的溶液中,c(M+)+c(MOH)___________ (填“>”“<”或“=”)2c(Cl-);若此时溶液的pH=10,则c(MOH)+c(OH-)=___________ mol/L。

(1)常温下一定浓度的MCl稀溶液的pH
(2)请写出N点所对应的溶液中离子浓度的大小关系:
(3)K点对应的溶液中,c(M+)+c(MOH)
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)物质的量浓度均为 的下列四种溶液:
的下列四种溶液: 由小到大排列的顺序是
由小到大排列的顺序是_________________ 。
a. b.
b. c.
c. d.
d.
(2)常温下, 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是________ (填序号)。
A B
B  C
C 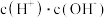 D
D  E
E 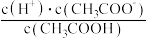
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:_______ 。
(4)25℃时,将 的醋酸溶液与
的醋酸溶液与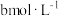 氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
_____________ (用含a、b的代数式表示)。
(5)标准状况下将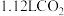 通入
通入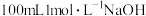 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式:
_________________ 。
| 化学式 |  |  |  |
| 电离平衡常数 |  |  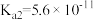 | 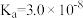 |
 的下列四种溶液:
的下列四种溶液: 由小到大排列的顺序是
由小到大排列的顺序是a.
 b.
b. c.
c. d.
d.
(2)常温下,
 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是A
 B
B  C
C 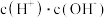 D
D  E
E 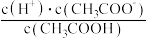
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(4)25℃时,将
 的醋酸溶液与
的醋酸溶液与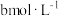 氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
(5)标准状况下将
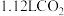 通入
通入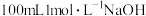 溶液中,用溶液中微粒的浓度符号完成下列等式:
溶液中,用溶液中微粒的浓度符号完成下列等式:
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】采用硫磺熏蒸处理药材会产生一定量的硫残留(其中S元素为+4价),以下是一种简便且准确的分析测定硫含量的方法。
Ⅰ.样品预处理(均在室温下进行):
对xg药材进行处理后,将逸出的 全部收集溶于水形成溶液X。加NaOH溶液将溶液X调为
全部收集溶于水形成溶液X。加NaOH溶液将溶液X调为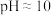 ,此时溶液总体积为V mL(记为溶液Y)。
,此时溶液总体积为V mL(记为溶液Y)。
资料:不同pH下,含硫微粒在溶液中的主要存在形式:
(1) 溶于水后溶液显酸性,用化学用语表示其原因:
溶于水后溶液显酸性,用化学用语表示其原因:___________ 。
(2)用少量NaOH溶液将X溶液pH调至4.3的过程中发生反应的离子方程式是___________ 。
(3)将X溶液pH调至10时, 与消耗的NaOH物质的量之比
与消耗的NaOH物质的量之比
___________ 。
(4)关于室温下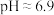 的溶液说法正确的是
的溶液说法正确的是___________ 。
a.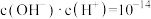
b.
c.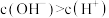
Ⅱ.电化学测定:利用如图电解装置进行测定。
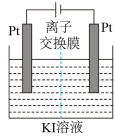
通电片刻后停止通电,加入淀粉溶液。根据电流大小和电解效率理论计算共产生 。用溶液Y对停止通电后的阳极区电解质溶液进行滴定,到达终点时,共用去
。用溶液Y对停止通电后的阳极区电解质溶液进行滴定,到达终点时,共用去 。
。
(5)阳极的电极反应式是___________ 。
(6)确定滴定终点的现象是___________ 。
(7)药材中硫残留量(其中含硫微粒均按 计,
计,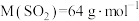 )为
)为___________ mg/g。
Ⅰ.样品预处理(均在室温下进行):
对xg药材进行处理后,将逸出的
 全部收集溶于水形成溶液X。加NaOH溶液将溶液X调为
全部收集溶于水形成溶液X。加NaOH溶液将溶液X调为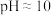 ,此时溶液总体积为V mL(记为溶液Y)。
,此时溶液总体积为V mL(记为溶液Y)。资料:不同pH下,含硫微粒在溶液中的主要存在形式:
| pH |
|
|
|
|
| 含硫微粒在溶液中的主要存在形式 |
|
|
|
|
 溶于水后溶液显酸性,用化学用语表示其原因:
溶于水后溶液显酸性,用化学用语表示其原因:(2)用少量NaOH溶液将X溶液pH调至4.3的过程中发生反应的离子方程式是
(3)将X溶液pH调至10时,
 与消耗的NaOH物质的量之比
与消耗的NaOH物质的量之比
(4)关于室温下
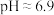 的溶液说法正确的是
的溶液说法正确的是a.
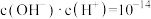
b.

c.
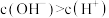
Ⅱ.电化学测定:利用如图电解装置进行测定。

通电片刻后停止通电,加入淀粉溶液。根据电流大小和电解效率理论计算共产生
 。用溶液Y对停止通电后的阳极区电解质溶液进行滴定,到达终点时,共用去
。用溶液Y对停止通电后的阳极区电解质溶液进行滴定,到达终点时,共用去 。
。(5)阳极的电极反应式是
(6)确定滴定终点的现象是
(7)药材中硫残留量(其中含硫微粒均按
 计,
计,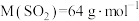 )为
)为
您最近一年使用:0次