反应为CO(g)+2H2(g)⇌CH3OH(g) ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
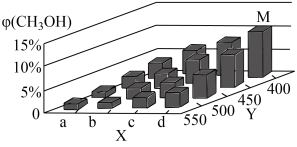
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________ 。
②X轴上a点的数值比b点________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是____________________________________________ 。

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为
②X轴上a点的数值比b点
2020高三·全国·专题练习 查看更多[3]
(已下线)易错12 化学平衡图像-备战2021年高考化学一轮复习易错题(已下线)专题讲座(五)反应速率、平衡图像题解题策略(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第七章 化学反应速率与化学平衡 第44练 化学反应速率、平衡的常规图像
更新时间:2020-09-20 21:51:41
|
相似题推荐
【推荐1】雾霾天气严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染。
请回答下列问题:
(1)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g)—Q。恒温、恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是
2NO(g)—Q。恒温、恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是____ 。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的转化率不再变化
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为___ ,在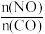 =1的条件下,为更好的除去NOx,应控制的最佳温度在
=1的条件下,为更好的除去NOx,应控制的最佳温度在___ K左右。

(3)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
①写出NO与活性炭反应的化学方程式:___ 。
②若T1<T2,则该反应的Q__ 0(填“>”“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为___ 。
请回答下列问题:
(1)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g)—Q。恒温、恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是
2NO(g)—Q。恒温、恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的转化率不再变化
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为
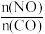 =1的条件下,为更好的除去NOx,应控制的最佳温度在
=1的条件下,为更好的除去NOx,应控制的最佳温度在
(3)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度(℃) | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
②若T1<T2,则该反应的Q
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为
您最近一年使用:0次
【推荐2】在一固定体积的密闭容器中,在900℃时发生反应:CH4(g)+H2O(g) CH3OH(g)+H2(g) △H=-QKJ/mol(Q>0)。容器内各物质的浓度(mol/L)变化如下:(在900℃其化学平衡常数K=1.0)
CH3OH(g)+H2(g) △H=-QKJ/mol(Q>0)。容器内各物质的浓度(mol/L)变化如下:(在900℃其化学平衡常数K=1.0)
(1)下列可以作为判断该反应已经达到化学平衡状态依据的是_______ ;若在绝热 的恒容密闭容器中发生反应,下列可以作为判断该反应已经达到化学平衡状态依据的是_______ 。
A.容器内压强不变 B.v正(H2)=v逆(CH4)
C.混合气体中CH3OH的浓度不变 D.c(CH3OH)=c(CH4)
(2)若在900℃时向反应容器中充入H2O,K值_______ (填“增大”“减小”或“不变”,下同),CH4的转化率为_______ ,H2O的转化率为_______ ;若升高反应体系的温度,K值_______ 。
(3)上表中:c1=_______ mol/L,H2O的c2=_______ mol/L,H2O的转化率为_______ 。
 CH3OH(g)+H2(g) △H=-QKJ/mol(Q>0)。容器内各物质的浓度(mol/L)变化如下:(在900℃其化学平衡常数K=1.0)
CH3OH(g)+H2(g) △H=-QKJ/mol(Q>0)。容器内各物质的浓度(mol/L)变化如下:(在900℃其化学平衡常数K=1.0)| 时间/min | CH4 | H2O | CH3OH | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
A.容器内压强不变 B.v正(H2)=v逆(CH4)
C.混合气体中CH3OH的浓度不变 D.c(CH3OH)=c(CH4)
(2)若在900℃时向反应容器中充入H2O,K值
(3)上表中:c1=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+ H2O(g)  CO2(g)+ 3H2(g) △H>0。
CO2(g)+ 3H2(g) △H>0。
(1)在一定条件下,向体积为2L的恒容密闭容器中充入1mol CH3OH(g)和3mol H2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示的该反应的速率为_______ ,此时甲醇的转化率为_______ 。
(2)上述可逆反应达到平衡状态的依据是(填序号)_______ 。
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
根据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______ (用K1、K2表示)。若500℃时测得反应③在某时刻H2(g)、CO2(g) 、CH3OH(g)、H2O (g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正 _______ v逆(填“<”“=”或“>”)
 CO2(g)+ 3H2(g) △H>0。
CO2(g)+ 3H2(g) △H>0。(1)在一定条件下,向体积为2L的恒容密闭容器中充入1mol CH3OH(g)和3mol H2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示的该反应的速率为
(2)上述可逆反应达到平衡状态的依据是(填序号)
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度 / ℃ | ||
| 500 | 800 | |||
①2H2(g)+CO(g)  CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 | |
②H2(g)+CO2(g)  H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 | |
③3H2(g)+CO2(g)  CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | |||
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】在2L密闭容器内,800℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)写出该反应的平衡常数表达式:K=__________ 。
(2)0~2 s内该反应的平均速率v(NO)=__________ , v(O2)=__________ 。
(3)能说明该反应已达到平衡状态的是__________ 。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________ 。
a.及时分离出NO2气体 b.增大O2的浓度
c.扩大容器体积 d.选择高效催化剂
 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=
(2)0~2 s内该反应的平均速率v(NO)=
(3)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出NO2气体 b.增大O2的浓度
c.扩大容器体积 d.选择高效催化剂
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
请回答下列问题:
(1)该反应的化学平衡常数K =_________ 。
(2)该反应为________ (填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。
(4)830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为_______ 。
 CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数K =
(2)该反应为
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
(4)830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】在2 L密闭容器中,800 ℃时,反应2NO+O2 2NO2体系中,n(NO)随时间的变化如下表:
2NO2体系中,n(NO)随时间的变化如下表:
(1)如图表示各物质浓度的变化曲线,

A点处,v(正)___________ v(逆), A点正反应速率_________ B点正反应速率。 (用“大于”、“小于”或“等于”填空)
(2)图中表示O2变化的曲线是___________ 。用NO2表示从0~2 s内该反应的平均速率v=____________________________ 。
(3) 能使该反应的反应速率增大的是____________ 。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4) 能说明该反应已经达到平衡状态的是___________ 。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)
 2NO2体系中,n(NO)随时间的变化如下表:
2NO2体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线,

A点处,v(正)
(2)图中表示O2变化的曲线是
(3) 能使该反应的反应速率增大的是
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4) 能说明该反应已经达到平衡状态的是
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】化学反应速率和限度与生产、生活密切相关。
(1)用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
①实验过程如图1所示。分析判断_______ 段化学反应速率最快。
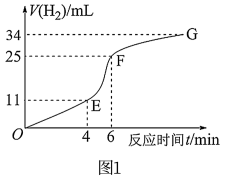
②将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其原因是_______ 。
(2)某温度时,在 恒容容器中X、Y、Z三种气体物质随时间的变化关系曲线如图2所示。
恒容容器中X、Y、Z三种气体物质随时间的变化关系曲线如图2所示。
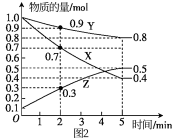
①由图中的数据分析,该反应的化学方程式为:_______ 。
②反应开始至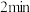 时,Z的平均反应速率为
时,Z的平均反应速率为_______ 。
③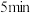 时X的转化率为
时X的转化率为_______ 。
(1)用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
①实验过程如图1所示。分析判断

②将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其原因是
(2)某温度时,在
 恒容容器中X、Y、Z三种气体物质随时间的变化关系曲线如图2所示。
恒容容器中X、Y、Z三种气体物质随时间的变化关系曲线如图2所示。
①由图中的数据分析,该反应的化学方程式为:
②反应开始至
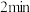 时,Z的平均反应速率为
时,Z的平均反应速率为③
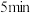 时X的转化率为
时X的转化率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】1,2-二氯丙烷(CH2ClCHClCH3)是重要的化工原料,工业上可用丙烯加成法生产,主要副产物为3-氯丙烯(CH2=CHCH2C1) ,反应原理为
i. CH2=CHCH3(g)+Cl2(g) CH2ClCHClCH3(g) ΔH1= -134 kJ• mol-1
CH2ClCHClCH3(g) ΔH1= -134 kJ• mol-1
ii. CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ • mol-1
CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ • mol-1
已知:相关化学键的键能数据如下表所示:
请回答下列问题:
(1)由反应i计算出表中x=_____________ 。
(2)一定温度下,密闭容器中发生反应i和反应ii,达到平衡后增大压强,CH2C1CHClCH3的产率____________ (填“增大”“减小”或“不变”)。
(3)T1℃时,向10L恒容的密闭容器中充入1 mol CH2=CHCH2C1和2 mol HCl,只发生以下反应:CH2=CH CH2Cl (g)+HCl(g) CH2ClCHClCH3(g) ΔH3。5min反应达到平衡,测得 0〜5 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1• min-1。
CH2ClCHClCH3(g) ΔH3。5min反应达到平衡,测得 0〜5 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1• min-1。
①平衡时,HCl的体积分数为__________________ (保留三位有效数字)。
②保持其它条件不变,6 min时再向该容器中充入0. 6 mol CH2=CHCH2Cl、0.2molHCl和0.1mol CH2ClCHClCH3,则起始反应速率 v正(HCl)______________ (填“>”“<”或“=”)V逆(HCl).
(4)一定压强下,向密闭容器中充入一定量的CH2=CHCH3和C12发生反应ii。设起始的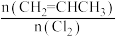 =w,平衡时Cl2的体积分数(φ)与温度(T)、w的关系如图甲所示。W=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
=w,平衡时Cl2的体积分数(φ)与温度(T)、w的关系如图甲所示。W=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
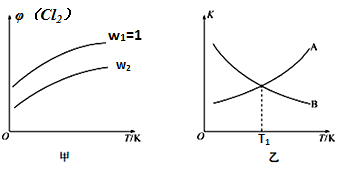
①图甲中,w2__________ (填“>”“<”或“=”)1
②图乙中,表示正反应平衡常数的曲线为________ (填“A”或“B”),理由为________________ 。
③T1K下,平衡时Cl2的转化率为_______________ 。
(5)起始时向某恒容绝热容器中充入1 mol CH2=CHCH3和1 mol Cl2发生反应ii,达到平衡时,容器内气体压强_________________ (填“增大”“减小”或“不变”)。
i. CH2=CHCH3(g)+Cl2(g)
 CH2ClCHClCH3(g) ΔH1= -134 kJ• mol-1
CH2ClCHClCH3(g) ΔH1= -134 kJ• mol-1ii. CH2=CHCH3(g)+Cl2(g)
 CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ • mol-1
CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ • mol-1已知:相关化学键的键能数据如下表所示:
| 化学键 | C=C | C—C | C—Cl | Cl—Cl |
| E/( kJ • mol-1) | 611 | X | 328 | 243 |
(1)由反应i计算出表中x=
(2)一定温度下,密闭容器中发生反应i和反应ii,达到平衡后增大压强,CH2C1CHClCH3的产率
(3)T1℃时,向10L恒容的密闭容器中充入1 mol CH2=CHCH2C1和2 mol HCl,只发生以下反应:CH2=CH CH2Cl (g)+HCl(g)
 CH2ClCHClCH3(g) ΔH3。5min反应达到平衡,测得 0〜5 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1• min-1。
CH2ClCHClCH3(g) ΔH3。5min反应达到平衡,测得 0〜5 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1• min-1。①平衡时,HCl的体积分数为
②保持其它条件不变,6 min时再向该容器中充入0. 6 mol CH2=CHCH2Cl、0.2molHCl和0.1mol CH2ClCHClCH3,则起始反应速率 v正(HCl)
(4)一定压强下,向密闭容器中充入一定量的CH2=CHCH3和C12发生反应ii。设起始的
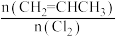 =w,平衡时Cl2的体积分数(φ)与温度(T)、w的关系如图甲所示。W=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
=w,平衡时Cl2的体积分数(φ)与温度(T)、w的关系如图甲所示。W=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
①图甲中,w2
②图乙中,表示正反应平衡常数的曲线为
③T1K下,平衡时Cl2的转化率为
(5)起始时向某恒容绝热容器中充入1 mol CH2=CHCH3和1 mol Cl2发生反应ii,达到平衡时,容器内气体压强
您最近一年使用:0次
【推荐3】回答下列问题
(1)二氟卡宾(:CF2)作为一种活性中间体,一直受到有机氟化学研究工作者的高度关注。硫单质与二氟卡宾可以形成S=CF2,反应历程如图所示:
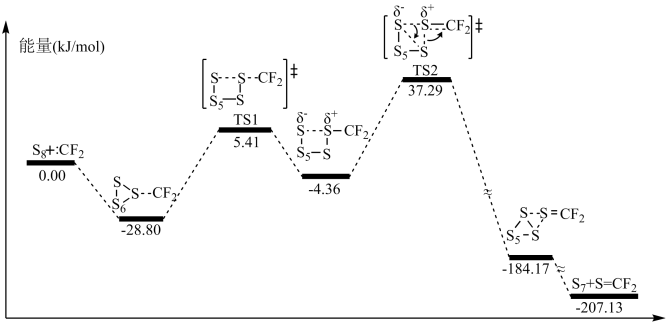
①由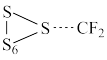 生成
生成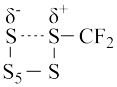 的活化能为
的活化能为__________________ ;
②决定反应速率的基元反应的活化能为______________________ 。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)反应的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
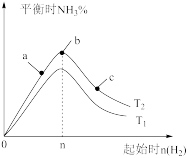
①图象中T2和T1的关系是:T2___________ T1(填“高于”、“低于”、 “等于”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N 2的转化率最高的是_______________ (填字母)。
③在起始体系中n(N2):n(H2)= 1:3时,反应后氨的百分含量最大;若容器容积为1 L, n=3 mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=__________________ 。
(1)二氟卡宾(:CF2)作为一种活性中间体,一直受到有机氟化学研究工作者的高度关注。硫单质与二氟卡宾可以形成S=CF2,反应历程如图所示:

①由
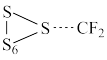 生成
生成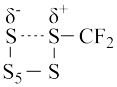 的活化能为
的活化能为②决定反应速率的基元反应的活化能为
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)
 2NH3(g)反应的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)反应的影响。实验结果如图所示:(图中T表示温度,n表示物质的量) 
①图象中T2和T1的关系是:T2
②比较在a、b、c三点所处的平衡状态中,反应物N 2的转化率最高的是
③在起始体系中n(N2):n(H2)= 1:3时,反应后氨的百分含量最大;若容器容积为1 L, n=3 mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g)⇌CH3OH(g) △H。在体积可变的密闭容器中投入0.5molCO和0.75molH2,不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
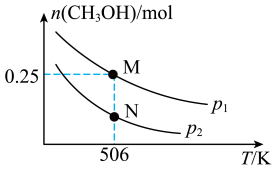
(1)根据图象判断△H_______ 0(填“<”或“>”);M点H2的转化率为_______ 。
(2)M点对应的平衡混合气体的体积为1L,则506K时该反应平衡常数K=_______ 。
(3)下列叙述能说明上述反应达到化学平衡状态的_______ (填字母序号)。
a.v(H2)=2v(CH3OH)
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
(4)平衡后再加入0.5molCO和0.75molH2后重新到达平衡,则CO的转化率_______ (填“增大”、“不变”或“减小”)。

(1)根据图象判断△H
(2)M点对应的平衡混合气体的体积为1L,则506K时该反应平衡常数K=
(3)下列叙述能说明上述反应达到化学平衡状态的
a.v(H2)=2v(CH3OH)
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
(4)平衡后再加入0.5molCO和0.75molH2后重新到达平衡,则CO的转化率
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)对于反应:2NO(g)+O2(g) 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。

①比较p1、p2的大小关系:__ 。
②随温度降低,该反应平衡常数变化的趋势是__ (填“增大”或“减小”)。
(2)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
①反应的ΔH__ (填“>”或“<”)0;100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(NO2)为__ ;反应的平衡常数K为_ 。
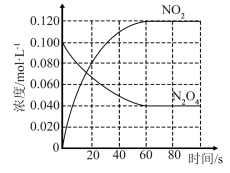
②100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,10s后又达到平衡,则T__ (填“大于”或“小于”)100℃。
 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
①比较p1、p2的大小关系:
②随温度降低,该反应平衡常数变化的趋势是
(2)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)
 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①反应的ΔH

②100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,10s后又达到平衡,则T
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇,CO(g)+2H2(g) CH3OH(g) 下列措施中能够增大上述合成甲醇反应的反应速率的是
CH3OH(g) 下列措施中能够增大上述合成甲醇反应的反应速率的是________ (填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(2)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
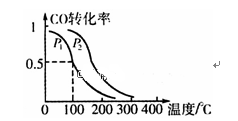
①p1________ p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=_______ ;
③100℃时,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、H2和CH3OH各0.5amol,则平衡______ (填“向右”、“向左”或“不”移动)
④在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率______ (填“增大”、“减小”或“不变”)。
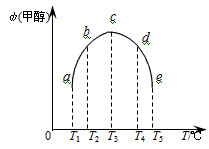
(3)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示。在T1-T2及T4-T5两个温度区间,容器内甲醇的体积分数的变化趋势如图所示,其原因是______ 。
(1)用CO可以合成甲醇,CO(g)+2H2(g)
 CH3OH(g) 下列措施中能够增大上述合成甲醇反应的反应速率的是
CH3OH(g) 下列措施中能够增大上述合成甲醇反应的反应速率的是a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(2)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。

①p1
②100 ℃时,该反应的化学平衡常数K=
③100℃时,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、H2和CH3OH各0.5amol,则平衡
④在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率
(3)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示。在T1-T2及T4-T5两个温度区间,容器内甲醇的体积分数的变化趋势如图所示,其原因是

您最近一年使用:0次



