甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g)⇌CH3OH(g) △H。在体积可变的密闭容器中投入0.5molCO和0.75molH2,不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
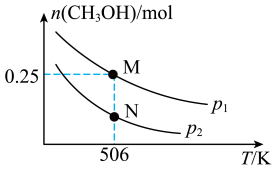
(1)根据图象判断△H_______ 0(填“<”或“>”);M点H2的转化率为_______ 。
(2)M点对应的平衡混合气体的体积为1L,则506K时该反应平衡常数K=_______ 。
(3)下列叙述能说明上述反应达到化学平衡状态的_______ (填字母序号)。
a.v(H2)=2v(CH3OH)
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
(4)平衡后再加入0.5molCO和0.75molH2后重新到达平衡,则CO的转化率_______ (填“增大”、“不变”或“减小”)。

(1)根据图象判断△H
(2)M点对应的平衡混合气体的体积为1L,则506K时该反应平衡常数K=
(3)下列叙述能说明上述反应达到化学平衡状态的
a.v(H2)=2v(CH3OH)
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
(4)平衡后再加入0.5molCO和0.75molH2后重新到达平衡,则CO的转化率
更新时间:2023-09-22 08:50:21
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题。
(1)在反应A(g)+3B(g)=2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L‒1·min‒1,则以物质B表示此反应的化学反应速率为___________ 。
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为___________ 。
(3)①将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g) 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L‒1·s‒1,则在2s时,容器中有
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L‒1·s‒1,则在2s时,容器中有___________ mol A,此时C的物质的量浓度为___________ 。
②能说明该反应已达到平衡状态的是_______ (填字母)。
a.v(A)=2v(B) b.容器内压强保持不变
c.3v逆(A)=v正(B) d.容器内混合气体的密度保持不变
③在密闭容器里,通入a mol A(g)、b mol B(g)、c mol C(g),发生上述反应,当改变下列条件时,反应速率会减小的是_______ (填序号)。
①降低温度 ②加入催化剂 ③增大容器体积
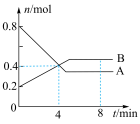
(4)在2 L的恒温恒容密闭容器内,某一反应中A、B气体的物质的量随时间变化的曲线如图所示,从反应开始至4 min时,B的平均反应速率为___________ ,该反应的化学方程式为___________ 。
(1)在反应A(g)+3B(g)=2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L‒1·min‒1,则以物质B表示此反应的化学反应速率为
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为
(3)①将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)
 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L‒1·s‒1,则在2s时,容器中有
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L‒1·s‒1,则在2s时,容器中有②能说明该反应已达到平衡状态的是
a.v(A)=2v(B) b.容器内压强保持不变
c.3v逆(A)=v正(B) d.容器内混合气体的密度保持不变
③在密闭容器里,通入a mol A(g)、b mol B(g)、c mol C(g),发生上述反应,当改变下列条件时,反应速率会减小的是
①降低温度 ②加入催化剂 ③增大容器体积
(4)在2 L的恒温恒容密闭容器内,某一反应中A、B气体的物质的量随时间变化的曲线如图所示,从反应开始至4 min时,B的平均反应速率为
您最近一年使用:0次
填空题
|
适中
(0.65)
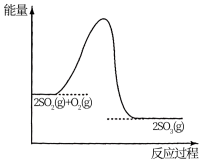
【推荐2】工业制硫酸中的一步重要反应是SO2在400-500℃下的催化氧化: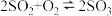 。一定温度下,将SO2和O2及固体催化剂V2O5充入某恒容密闭容器中,反应过程中的能量变化如图1所示,某反应物和生成物的浓度随时间的变化如图2所示。
。一定温度下,将SO2和O2及固体催化剂V2O5充入某恒容密闭容器中,反应过程中的能量变化如图1所示,某反应物和生成物的浓度随时间的变化如图2所示。

请回答下列问题:
(1)该反应是_______ 反应(填“放热”或“吸热”),判断依据是_______ 。
(2)图2中,曲线I表示的物质是_______ (填化学式),B点时该物质的转化率为_______ ,其中v(正)大于v(逆)的点是_______ (填字母)。
(3)关于以上反应,下述有关说法错误的是_______ (填标号)。
A.在上述条件下,SO2可能100%的转化为SO3
B.使用催化剂是为了加快反应速率,提高生产效率
C.达到平衡时,SO2的浓度与SO3的浓度相等
D.为了提高SO2的转化率,可以适当提高O2的浓度
E.升高温度,正、逆反应速率都增大
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为VO2;VO2再被O2氧化。写出该催化循环机理的化学方程式_______ 、_______ 。
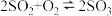 。一定温度下,将SO2和O2及固体催化剂V2O5充入某恒容密闭容器中,反应过程中的能量变化如图1所示,某反应物和生成物的浓度随时间的变化如图2所示。
。一定温度下,将SO2和O2及固体催化剂V2O5充入某恒容密闭容器中,反应过程中的能量变化如图1所示,某反应物和生成物的浓度随时间的变化如图2所示。

请回答下列问题:
(1)该反应是
(2)图2中,曲线I表示的物质是
(3)关于以上反应,下述有关说法错误的是
A.在上述条件下,SO2可能100%的转化为SO3
B.使用催化剂是为了加快反应速率,提高生产效率
C.达到平衡时,SO2的浓度与SO3的浓度相等
D.为了提高SO2的转化率,可以适当提高O2的浓度
E.升高温度,正、逆反应速率都增大
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为VO2;VO2再被O2氧化。写出该催化循环机理的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图。
①该反应的化学方程式为 (反应物或生成物用符号X、Y表示):_______ 。
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是_______ 。
③和起始相比,15min时容器内混合气体的总压强_______ (填“增大”、“减小”或“不变”)混合气体的密度_______ (填“增大”、“减小”或“不变”)
④下列措施能加快反应速率的是_______ 。
A.恒压时充入He B.恒容时充入He C.恒容时充入X D.升高温度 E.选择高效催化剂
(2)t℃时,将2molSO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g) △H=-196kJ•mol-1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ。请填写下列空白:
2SO3(g) △H=-196kJ•mol-1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ。请填写下列空白:
①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)_______ 。
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
②从反应开始至达到化学平衡,生成SO3平均反应速率为_______ ;
③若将物质的量之比为1∶1的SO2和O2混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为_______ 。
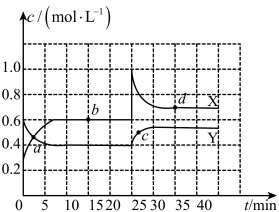
(3)经研究知Cu 2+对H2O2分解也具有催化作用,为比较Fe 3+和Cu 2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
①定性分析:如图甲可通过观察_______ 定性比较得出结论。有同学提出将FeCl 3改为Fe2(SO 4)3更为合理,其理由是_______ 。
②定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_______ 。
(1)在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图。

①该反应的化学方程式为 (反应物或生成物用符号X、Y表示):
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是
③和起始相比,15min时容器内混合气体的总压强
④下列措施能加快反应速率的是
A.恒压时充入He B.恒容时充入He C.恒容时充入X D.升高温度 E.选择高效催化剂
(2)t℃时,将2molSO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)
 2SO3(g) △H=-196kJ•mol-1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ。请填写下列空白:
2SO3(g) △H=-196kJ•mol-1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ。请填写下列空白:①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
②从反应开始至达到化学平衡,生成SO3平均反应速率为
③若将物质的量之比为1∶1的SO2和O2混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为
(3)经研究知Cu 2+对H2O2分解也具有催化作用,为比较Fe 3+和Cu 2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性分析:如图甲可通过观察
②定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】二氯化砜(SO2Cl2)是一种无色液体,主要用于有机物和无机物的氯化等。其熔点为-54.1℃.沸点为69.2℃;常温下比较稳定,受热易分解,遇水剧烈反应生成硫酸和盐酸。
(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g) SO2Cl2(g) △H<0
SO2Cl2(g) △H<0
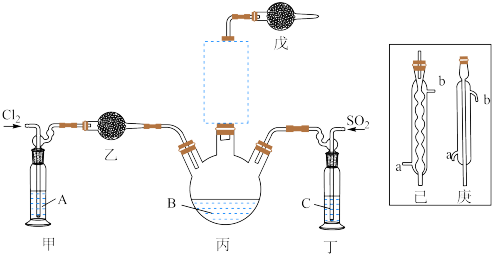
①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为_________ ;溶液A为____ 。
②上图实框中仪器己的名称为_____ ;反应装置图的虚框中未画出的仪器是____ (填“己”或“庚”)。
③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是___________ 。
④下列有关说法错误的是________ (填编号)。
a.乙、戊装置相同,在实验中的作用也完全相同
b.甲、丁装置为洗气装置,可用于气体的除杂和干燥
c.组装仪器后首先要进行的操作是检查装置的气密性
d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等
(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是____________________ 。
(3)测定。取1.00g蒸馏后液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60g,则所得蒸馏成分中二氯化砜的质量百分含量为_________ %。
(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是______ 。
(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g)
 SO2Cl2(g) △H<0
SO2Cl2(g) △H<0
①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为
②上图实框中仪器己的名称为
③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是
④下列有关说法错误的是
a.乙、戊装置相同,在实验中的作用也完全相同
b.甲、丁装置为洗气装置,可用于气体的除杂和干燥
c.组装仪器后首先要进行的操作是检查装置的气密性
d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等
(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是
(3)测定。取1.00g蒸馏后液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60g,则所得蒸馏成分中二氯化砜的质量百分含量为
(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为_________________________ ;该反应在________ 条件下能自发进行(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)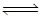 CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
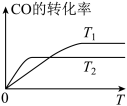
①T1________ T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1________ (填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是________ (填字母)。
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___________________ ;
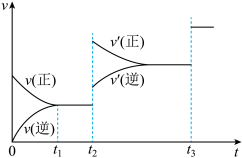
t3时采取的措施可能是_________________ 。
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=________ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极加入的物质是________ ;正极的电极反应为_______________________ 。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)
 CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
①T1
②若容器容积不变,下列措施不能增加CO转化率的是
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是

t3时采取的措施可能是
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极加入的物质是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH1
Fe2O3(s)+ CO(g)=
CO(g)= Fe3O4(s)+
Fe3O4(s)+ CO2(g) ΔH2
CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH4
上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
温度:250℃~600℃~1000℃~2000℃
主要成分:Fe2O3~Fe3O4~FeO~Fe
1600℃时固体物质的主要成分为___________ ,该温度下测得固体混合物中m(Fe)︰m(O)=35︰2,则FeO被CO还原为Fe的百分率为___________ (设其它固体杂质中不含Fe、O元素)。
(2)铁系金属常用作CO加氢反应的催化剂。
已知某种催化剂可用来催化反应CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH<0。在T℃,压强为p时将1 mol CO和3 mol H2加入容积为1 L的密闭容器中。实验测得CO的体积分数χ(CO)如下表:
①前10 min内,CO的平均反应速率υ(CO)=___________ (保留两位有效数字)。
②达到平衡时,体系的总压强p与初始压强之比p0,p∶p0=___________ ;
③下图是该反应CO的平衡转化率与温度、压强的关系。
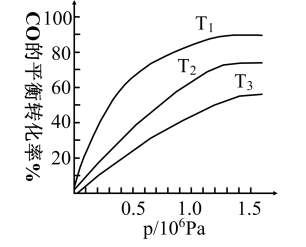
图中温度T1、T2、T3由高到低的顺序是___________ ,理由是___________ 。
④45 min时,保持容器的温度和体积不变,再加入1 mol CO和3 mol H2,再次达到平衡时,CO的平衡转化率___________ (填“>”、“<”或“=”)30 min时CO的平衡转化率。
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH1
Fe2O3(s)+
 CO(g)=
CO(g)= Fe3O4(s)+
Fe3O4(s)+ CO2(g) ΔH2
CO2(g) ΔH2Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH4
上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
温度:250℃~600℃~1000℃~2000℃
主要成分:Fe2O3~Fe3O4~FeO~Fe
1600℃时固体物质的主要成分为
(2)铁系金属常用作CO加氢反应的催化剂。
已知某种催化剂可用来催化反应CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH<0。在T℃,压强为p时将1 mol CO和3 mol H2加入容积为1 L的密闭容器中。实验测得CO的体积分数χ(CO)如下表:
| t/min | 0 | 10 | 20 | 30 | 35 |
| χ(CO) | 0.25 | 0.20 | 0.17 | 0.15 | 0.15 |
②达到平衡时,体系的总压强p与初始压强之比p0,p∶p0=
③下图是该反应CO的平衡转化率与温度、压强的关系。

图中温度T1、T2、T3由高到低的顺序是
④45 min时,保持容器的温度和体积不变,再加入1 mol CO和3 mol H2,再次达到平衡时,CO的平衡转化率
您最近一年使用:0次
【推荐1】在 1.0 L 密闭容器中放入 0.10molA(g),在一定温度进行如下反应:A(g) 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1。容器内气体总压强(P)与起始压强 P0 的比值随反应时间(t)数据见下表:
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1。容器内气体总压强(P)与起始压强 P0 的比值随反应时间(t)数据见下表:
回答下列问题:
(1)该平衡常数的表达式为_____________ 。
(2)下列能提高 A 的转化率的是________ 。
A.升高温度 B.体系中通入 A 气体 C.将 D 的浓度减小
D.通入稀有气体 He,使体系压强增大到原来的 5 倍
E.若体系中的 C 为 HCl,其它物质均难溶于水,滴入少许水
(3)前 2小时 C 的反应速率是___________ mol.L-1.h-1;
(4)平衡时 A 的转化率___________ C 的体积分数_________ (均保留两位有效数字)
 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1。容器内气体总压强(P)与起始压强 P0 的比值随反应时间(t)数据见下表:
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1。容器内气体总压强(P)与起始压强 P0 的比值随反应时间(t)数据见下表:| 时间 t/ h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| P /P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
(1)该平衡常数的表达式为
(2)下列能提高 A 的转化率的是
A.升高温度 B.体系中通入 A 气体 C.将 D 的浓度减小
D.通入稀有气体 He,使体系压强增大到原来的 5 倍
E.若体系中的 C 为 HCl,其它物质均难溶于水,滴入少许水
(3)前 2小时 C 的反应速率是
(4)平衡时 A 的转化率
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】治理汽车尾气中NO和CO污染的一种方法是将其转化为无害的CO2和N2,反应原理为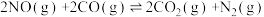 ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
(1)实验Ⅱ从开始至达到平衡时的平均反应速率v(NO)=___________ 。
(2)与实验Ⅱ相比,实验Ⅰ和实验Ⅲ分别仅改变一种反应条件,所改变的条件和判断的理由分别为:
实验Ⅰ:___________ 。
实验Ⅲ:___________ 。
(3)三组实验中CO的平衡转化率αⅠ(CO)、αⅡ(CO)和αⅢ(CO)的大小关系为___________ 。
(4)实验Ⅲ的平衡常数K=___________ 。
 ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
(1)实验Ⅱ从开始至达到平衡时的平均反应速率v(NO)=
(2)与实验Ⅱ相比,实验Ⅰ和实验Ⅲ分别仅改变一种反应条件,所改变的条件和判断的理由分别为:
实验Ⅰ:
实验Ⅲ:
(3)三组实验中CO的平衡转化率αⅠ(CO)、αⅡ(CO)和αⅢ(CO)的大小关系为
(4)实验Ⅲ的平衡常数K=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】运用化学反应原理知识研究SO2与O2的反应对工业生产硫酸有重要意义。
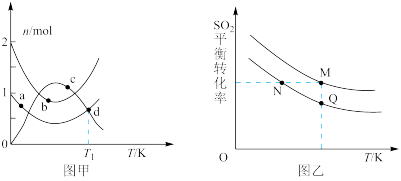
(1)向体积均为2L的恒容密闭容器中,分别加入2 mol SO2与1 mol O2,反应相同时间,不同温度下各容器中SO2、O2、SO3的物质的量如图甲所示。
①反应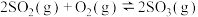 一定条件下能自发进行的原因是
一定条件下能自发进行的原因是___________ 。
②图中a、b、c三点中处于平衡状态的是___________ 点。
③T1温度时反应的平衡常数为___________ 。
(2)若在两个体积相等的容器内起始分别加入2 mol SO2和1 mol O2、1 mol SO2和0.5 mol O2,SO2的平衡转化率随温度的变化如图乙所示。
①M、Q两点容器内压强p(M)___________ 2p(Q)
②M、N两点的平衡常数K (M)___________ K(N)
③M、N、Q三点的正反应速率v(M)正、v(N)正、v(Q)正由大到小的顺序是___________ 。

(1)向体积均为2L的恒容密闭容器中,分别加入2 mol SO2与1 mol O2,反应相同时间,不同温度下各容器中SO2、O2、SO3的物质的量如图甲所示。
①反应
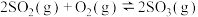 一定条件下能自发进行的原因是
一定条件下能自发进行的原因是②图中a、b、c三点中处于平衡状态的是
③T1温度时反应的平衡常数为
(2)若在两个体积相等的容器内起始分别加入2 mol SO2和1 mol O2、1 mol SO2和0.5 mol O2,SO2的平衡转化率随温度的变化如图乙所示。
①M、Q两点容器内压强p(M)
②M、N两点的平衡常数K (M)
③M、N、Q三点的正反应速率v(M)正、v(N)正、v(Q)正由大到小的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】一定条件下,在体积为1L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g),根据题意完成下列问题:
CH3OH(g),根据题意完成下列问题:
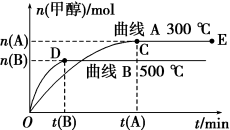
(1)反应达到平衡时,平衡常数表达式K=_______ ,升高温度,K值_______ (填“增大”“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=_______ 。
(3)在其他条件不变的情况下,对处于E点的体系增大压强,下列有关说法正确的是_______ 。
A.氢气的浓度不变 B.平衡向正向移动
C.一氧化碳的浓度增加 D.平衡向逆向移动
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是_______ (用化学方程式表示)。
 CH3OH(g),根据题意完成下列问题:
CH3OH(g),根据题意完成下列问题:
(1)反应达到平衡时,平衡常数表达式K=
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系增大压强,下列有关说法正确的是
A.氢气的浓度不变 B.平衡向正向移动
C.一氧化碳的浓度增加 D.平衡向逆向移动
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】对于反应A(g) 2B(g) H>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。
2B(g) H>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。
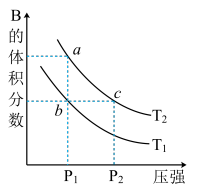
(1)根据曲线图,下列说法不正确的是___ 。
A.a、c两点的反应速率:c>a
B.b、c两点A气体的转化率相等
C.由状态b到状态a,可以通过加热的方法
D.由状态b到状态c,可以通过加压的方法
(2)若上述反应在定容密闭容器中进行,达到平衡状态的标志是___ 。
A.单位时间内生成nmolA的同时分解2nmolB B.两种气体的体积分数不再改变
C.混合气体的密度不再发生变化 D.混合气体的质量不再发生变化
(3)若上述反应达平衡时,B气体的平衡浓度为0.1mol·L-1,通过减小体积来增大体系的压强(温度保持不变),重新达平衡后,B气体的平衡浓度___ 0.1mol·L-1(填“大于”、“小于”或“等于”)。
(4)在100℃时,将0.40mol的B气体充入2L密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表的数据:
上表中n3___ n4(填“大于”、“小于”或“等于”),反应A(g) 2B(g)在100℃时的平衡常数K的值为
2B(g)在100℃时的平衡常数K的值为___ ,升高温度后,反应2B(g) A(g)的平衡常数K的值
A(g)的平衡常数K的值___ (填“增大”、“减小”或“不变”)。
 2B(g) H>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。
2B(g) H>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。
(1)根据曲线图,下列说法不正确的是
A.a、c两点的反应速率:c>a
B.b、c两点A气体的转化率相等
C.由状态b到状态a,可以通过加热的方法
D.由状态b到状态c,可以通过加压的方法
(2)若上述反应在定容密闭容器中进行,达到平衡状态的标志是
A.单位时间内生成nmolA的同时分解2nmolB B.两种气体的体积分数不再改变
C.混合气体的密度不再发生变化 D.混合气体的质量不再发生变化
(3)若上述反应达平衡时,B气体的平衡浓度为0.1mol·L-1,通过减小体积来增大体系的压强(温度保持不变),重新达平衡后,B气体的平衡浓度
(4)在100℃时,将0.40mol的B气体充入2L密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表的数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(B)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(A)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
 2B(g)在100℃时的平衡常数K的值为
2B(g)在100℃时的平衡常数K的值为 A(g)的平衡常数K的值
A(g)的平衡常数K的值
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气( 与
与 的混合气体)转化成甲醇,反应为
的混合气体)转化成甲醇,反应为 。
。
(1) 的平衡转化率与温度、压强的关系如图所示。
的平衡转化率与温度、压强的关系如图所示。
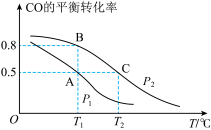
① 、
、 的大小关系是
的大小关系是
______  (填“>”“<"或“=”)。
(填“>”“<"或“=”)。
②A、B、C三点的平衡常数 、
、 、
、 的大小关系是
的大小关系是______ 。
③下列叙述不能说明上述反应能达到化学平衡状态的是______ (填字母)。
a.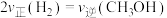
b. 的体积分数不再改变
的体积分数不再改变
c.混合气体的平均摩尔质量不再改变
d.同一时间内,消耗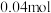
 ,生成
,生成

(2)在 、
、 压强时,往一容积为2L的密闭容器内,充入
压强时,往一容积为2L的密闭容器内,充入
 与
与
 发生反应。
发生反应。
①平衡时 的体积分数是
的体积分数是______ ;平衡后再加入
 后重新到达平衡,则
后重新到达平衡,则 的转化率
的转化率______ (填“增大”“不变”成“减小”), 与
与 的浓度比
的浓度比
______ (填"增大”“不变”或“减小”)。
②若以不同比例投料,测得某时刻各物质的物质的量如下, :
: 、
、 :
: 、
、 :
: ,此时
,此时
______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
 与
与 的混合气体)转化成甲醇,反应为
的混合气体)转化成甲醇,反应为 。
。(1)
 的平衡转化率与温度、压强的关系如图所示。
的平衡转化率与温度、压强的关系如图所示。
①
 、
、 的大小关系是
的大小关系是
 (填“>”“<"或“=”)。
(填“>”“<"或“=”)。②A、B、C三点的平衡常数
 、
、 、
、 的大小关系是
的大小关系是③下列叙述不能说明上述反应能达到化学平衡状态的是
a.
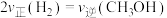
b.
 的体积分数不再改变
的体积分数不再改变c.混合气体的平均摩尔质量不再改变
d.同一时间内,消耗
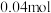
 ,生成
,生成

(2)在
 、
、 压强时,往一容积为2L的密闭容器内,充入
压强时,往一容积为2L的密闭容器内,充入
 与
与
 发生反应。
发生反应。①平衡时
 的体积分数是
的体积分数是
 后重新到达平衡,则
后重新到达平衡,则 的转化率
的转化率 与
与 的浓度比
的浓度比
②若以不同比例投料,测得某时刻各物质的物质的量如下,
 :
: 、
、 :
: 、
、 :
: ,此时
,此时
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次



