研究发现,在CO2低压合成甲醇反应中(CO2+3H2=CH3OH+H2O),Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:
(1)Mn原子价电子排布式为________ ,3d能级上的未成对电子数为________ .
(2)C、H、O 三种元素的电负性由小到大的顺序为______ .
(3)水的沸点________ (填“高于”或“低于”)H2S,原因是________ ;水是________ 分子(填“极性”或“非极性”)
(4)单质铜及镍都是由________ 键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1 958kJ•mol﹣1、INi=1 753kJ•mol﹣1,ICu>INi的原因是________ .
(5)某镍白铜合金的立方晶胞结构如图所示.
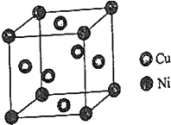
晶胞中铜原子与镍原子的数量比为________ .
②若合金的密度为d g•cm﹣3,晶胞参数a=________ cm.(用含NA和d的式子回答;铜和镍的相对原子质量分别为64、59)
(1)Mn原子价电子排布式为
(2)C、H、O 三种元素的电负性由小到大的顺序为
(3)水的沸点
(4)单质铜及镍都是由
(5)某镍白铜合金的立方晶胞结构如图所示.

晶胞中铜原子与镍原子的数量比为
②若合金的密度为d g•cm﹣3,晶胞参数a=
18-19高二下·山西忻州·阶段练习 查看更多[1]
(已下线)山西省原平市范亭中学2018-2019学年高二4月月考化学试题
更新时间:2019-06-25 16:57:18
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】在庆祝中华人民共和国成立 70 周年的阅兵仪式上,最后亮相的 DF—31 A 洲际战略
导弹是我国大国地位 、国防实力的显著标志。其制作材料中包含了 Fe 、Cr 、Ni 、C 等多种元素。回答下列问题:
(1)基态镍原子的价电子排布式为__________ 。
(2)与 Cr 同周期且基态原子最外层电子数相同的元素,可能位于周期表中的__________ 区。
(3) 铁元素能与CO形成 Fe (CO)5。羰基铁[ Fe (CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe(CO)5分子中含___________________ mol σ键,与CO互为等电子体的一种离子的化学式为______________________ 。
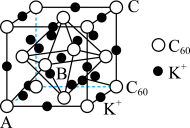
(4)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的______ 空隙和_________ 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B( ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为______________ 。
(5)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为a nm,高为c nm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为_ g/cm3( 列出计算式)。

导弹是我国大国地位 、国防实力的显著标志。其制作材料中包含了 Fe 、Cr 、Ni 、C 等多种元素。回答下列问题:
(1)基态镍原子的价电子排布式为
(2)与 Cr 同周期且基态原子最外层电子数相同的元素,可能位于周期表中的
(3) 铁元素能与CO形成 Fe (CO)5。羰基铁[ Fe (CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe(CO)5分子中含
(4)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的
 ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
(5)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为a nm,高为c nm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】钒及其化合物在科学研究中和工业生产中具有许多用途。
(1)基态钒原子的核外价电子排布式为________ 。
(2)钒有+2、+3、+4、+5等几种化合价。这几种价态中,最稳定的是______ 。
(3)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。例举与 空间构型相同的一种阳离子
空间构型相同的一种阳离子__________ (填化学式)。
(4)钒(Ⅱ)的配离子有[V(CN)6]4-、[V(H2O)6]2+等。
①CN-与N2互为等电子体,CN-中σ键和Π键数目比为________ 。
②对H2O与V2+形成[V(H2O)6]2+过程的描述不合理的是______________ 。
a.氧原子的杂化类型发生了变化
b.微粒的化学性质发生了改变
c.微粒中氢氧键(H-O)的夹角发生了改变。
d.H2O与V2+之间通过范德华力相结合。
③在[V(H2O)6]2+中存在的化学键有___________ 。
a.金属键 b.配位键 c. σ键 d.Π键 f. 氢键
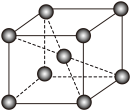
(5)已知单质钒的晶胞如图,则V原子的配位数是_______ ,假设晶胞的边长为d nm,密度ρ g·cm-3,则钒的相对原子质量为_______________ 。(设阿伏伽德罗常数为NA)
(1)基态钒原子的核外价电子排布式为
(2)钒有+2、+3、+4、+5等几种化合价。这几种价态中,最稳定的是
(3)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。例举与
 空间构型相同的一种阳离子
空间构型相同的一种阳离子(4)钒(Ⅱ)的配离子有[V(CN)6]4-、[V(H2O)6]2+等。
①CN-与N2互为等电子体,CN-中σ键和Π键数目比为
②对H2O与V2+形成[V(H2O)6]2+过程的描述不合理的是
a.氧原子的杂化类型发生了变化
b.微粒的化学性质发生了改变
c.微粒中氢氧键(H-O)的夹角发生了改变。
d.H2O与V2+之间通过范德华力相结合。
③在[V(H2O)6]2+中存在的化学键有
a.金属键 b.配位键 c. σ键 d.Π键 f. 氢键
(5)已知单质钒的晶胞如图,则V原子的配位数是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】[化学—选修3物质结构与性质】(巧分)已知A, B、C、D, E, F为元素周期表前四周期原子序数依次增大的六种元素,其中A的一种同位素原子中无中子,B的一种核素在考古时常用来鉴定一些文物的年代,D与E同主族,且E的原子序数是D的2倍,F元素在地壳中的含量位于金属元素的第二位。试回答下列问题:
(l)F元素的价层电子排布式为______ 。
(2)关于B2A2的下列说法中正确的是______ (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②B2A2是由极性键和非极性键构形成的非极性分子
③每个B2A2分子中 键和
键和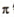 键数目比为1:1
键数目比为1:1
④B2A2分子中的A-B键属于 键
键
(3)B,C,D三种元素第一电离能按由大到小的顺序排列为___ (用元素符号表示) B、C、D三种元素中与BD2互为等电子体的分子式为____ (用元素符号表示)
(4)A2E分子中心原子的杂化类型为_____ 。比较A2D与A2E分子的沸点,其中沸点较高的原因为______ 。元素D可形成两种同素异形体,其中在水中溶解度更大的是______ (填分子式)。
(5) F单质的晶体在不同温度下有两种堆积方式,信息如下:
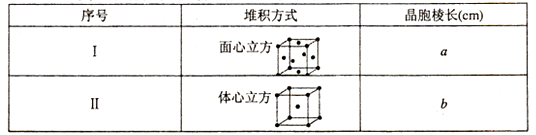
则方式I与方式II中F原子配位数之比为______ ,晶体密度之比为______ 。
(l)F元素的价层电子排布式为
(2)关于B2A2的下列说法中正确的是
①B2A2中的所有原子都满足8电子稳定结构
②B2A2是由极性键和非极性键构形成的非极性分子
③每个B2A2分子中
 键和
键和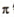 键数目比为1:1
键数目比为1:1④B2A2分子中的A-B键属于
 键
键(3)B,C,D三种元素第一电离能按由大到小的顺序排列为
(4)A2E分子中心原子的杂化类型为
(5) F单质的晶体在不同温度下有两种堆积方式,信息如下:

则方式I与方式II中F原子配位数之比为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由高到低的顺序为___ ,I和Cl相比,电负性较大的是___ 。
(2)碘原子价电子的电子排布图为___ 。
(3)I3+属于多卤素阳离子,推测I3+的空间构型为___ ,中心I原子的杂化轨道类型为___ 。
(4)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为___ (填序号)。
(5)离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,晶胞边长为685.5pm(1pm=10-12m),RbICl2晶胞中含有___ 个氯原子,RbICl2晶体的密度是___ g•cm-3(只要求列算式,不必计算出数值,阿伏加 德罗常数为NA)。
(6)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为____ 。
(7)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为___ 。

(1)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由高到低的顺序为
(2)碘原子价电子的电子排布图为
(3)I3+属于多卤素阳离子,推测I3+的空间构型为
(4)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为
(5)离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,晶胞边长为685.5pm(1pm=10-12m),RbICl2晶胞中含有
(6)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为
(7)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】由前二周期的非金属元素组成了成千上万种物质,它们的结构和性质各异。请回答:
(1)下列图中状态的硼原子中,能量最低的是_______ (填选项字母);基态硼原子共有_______ 种空间运动状态不同的电子。
A. B.
B. C.
C. D.
D.
(2)NO是人体中的信号分子,有关说法正确的_______。
(3)乙酸熔沸点很高,是由于存在以分子间氢键缔合的二聚体,请画出这二聚体的结构:_______ 。
(4)氮化硼和碳化硼均属于共价晶体,氮化硼的熔点高于碳化硼的原因为_______ 。
(1)下列图中状态的硼原子中,能量最低的是
A.
 B.
B. C.
C. D.
D.
(2)NO是人体中的信号分子,有关说法正确的_______。
| A.第一电离能N小于O | B.电负性O小于N |
| C.NO+的结构为:N≡O+ | D.N、O元素在周期表中都处于p区 |
(4)氮化硼和碳化硼均属于共价晶体,氮化硼的熔点高于碳化硼的原因为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表的第______ 族,其基态原子中未成对电子个数为________ 。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________________________________ ,所含非金属元素的电负性由大到小的顺序是_____________________________ 。
(3)尿素[CO(NH2)2]分子中,碳原子为_______ 杂化,分子中σ键与π键的数目之比为_________ 。
(4)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为__________ 。
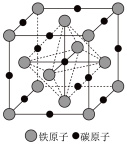
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为____________ 。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子的距离为__________ pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。
(1)钴位于元素周期表的第
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为
(3)尿素[CO(NH2)2]分子中,碳原子为
(4)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为

(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】丙二烯磷酸加氢生成顺丙烯磷酸是磷霉素合成的关键步骤,反应原理是:

回答下列问题:
(1)Pd的原子序数是46,基态Pd原子轨道中不存在单电子,基态Pd原子的价电子排布式是_________ .
(2)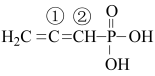 中电负性最大的元素是
中电负性最大的元素是_________ (填元素符号):①号碳原子的杂化方式是_____________ ,②号碳原子的价层电子对数为____________ .
(3) 有2种八面体结构:
有2种八面体结构:
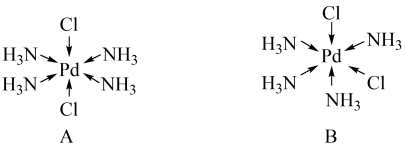
①有极性的结构是________ (填标号).
② 中
中 中
中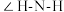 的键角
的键角_________ (填“<”、“>”或“=") 中
中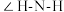 的键角.
的键角.
(4) 能与水混溶,却不溶于
能与水混溶,却不溶于 ,原因是
,原因是______________________ .
(5)Pd的晶胞俯视图如下所示:

已知1个晶胞中含4个Pd原子,其中3个Pd原子的坐标是 ,
, ,
, 则晶胞中每个Pd原子周围距离相等且最近的Pd原子有
则晶胞中每个Pd原子周围距离相等且最近的Pd原子有__________ 个;某铜钯合金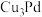 可看作上述Pd晶胞中
可看作上述Pd晶胞中_______ 位置的Pd原子被Cu原子替代.

回答下列问题:
(1)Pd的原子序数是46,基态Pd原子轨道中不存在单电子,基态Pd原子的价电子排布式是
(2)
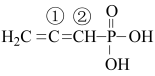 中电负性最大的元素是
中电负性最大的元素是(3)
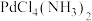 有2种八面体结构:
有2种八面体结构: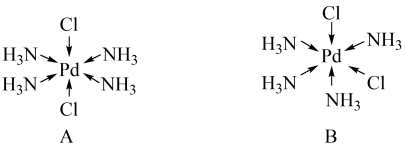
①有极性的结构是
②
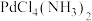 中
中 中
中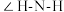 的键角
的键角 中
中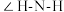 的键角.
的键角.(4)
 能与水混溶,却不溶于
能与水混溶,却不溶于 ,原因是
,原因是(5)Pd的晶胞俯视图如下所示:

已知1个晶胞中含4个Pd原子,其中3个Pd原子的坐标是
 ,
, ,
, 则晶胞中每个Pd原子周围距离相等且最近的Pd原子有
则晶胞中每个Pd原子周围距离相等且最近的Pd原子有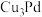 可看作上述Pd晶胞中
可看作上述Pd晶胞中
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为原料,经过一系列反应可以得到BF3和BN,流程如图所示。请回答下列问题:

(1)BF3分子为_______ (填“极性”或“非极性”)分子,硼原子的杂化方式为______ ,该分子中F-B-F键角是______ 。1molNH3分子的电子式为______ 。
(2)BF3和过量NaF作用可生成NaBF4,BF 的空间结构为
的空间结构为______ ,写出该反应化学反应方程式______ 。
(3)写出B2O3与氨气在高温下化学反应方程式_______ 。

(1)BF3分子为
(2)BF3和过量NaF作用可生成NaBF4,BF
 的空间结构为
的空间结构为(3)写出B2O3与氨气在高温下化学反应方程式
您最近一年使用:0次
【推荐3】氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH3OH和H2O在某Cu/Zn-Al催化剂存在下生产H2,H2与Mg在一定条件下制得储氢物质X。
回答问题:。
(1)Al在周期表中的位置___________ 。基态Zn的价层电子排布式___________ 。
(2)水分了中氧原子的杂化轨道类型___________ 。
(3)键能是衡量共价键稳定性的参数之一、CH3OH键参数中有___________ 种键能数据。CH3OH可以与水以任意比例互溶的原因是__________ 。
(4)X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4 g·cm-3,X的储氢质量分数是___________ ,c= ___________ pm (列出计算式即可)。
(提示:晶胞结构,H-位于6个面上;Mg2+在立方体的中心和8个顶点)

回答问题:。
(1)Al在周期表中的位置
(2)水分了中氧原子的杂化轨道类型
(3)键能是衡量共价键稳定性的参数之一、CH3OH键参数中有
(4)X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4 g·cm-3,X的储氢质量分数是
(提示:晶胞结构,H-位于6个面上;Mg2+在立方体的中心和8个顶点)

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】氮的化合物应用广泛。
(1)Reineckesalt的结构如图所示:
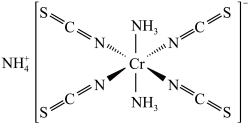
其中配位原子为___________ (填元素符号), 中碳原子杂化方式为
中碳原子杂化方式为___________ 。
(2)重铬酸铵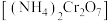 为桔黄色单斜结晶,常用作有机合成催化剂,
为桔黄色单斜结晶,常用作有机合成催化剂, 的结构如图。
的结构如图。
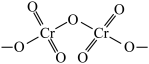
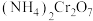 中N、O、Cr三种元素第一电离能由大到小的顺序是
中N、O、Cr三种元素第一电离能由大到小的顺序是___________ (填元素符号)
(3) 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为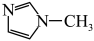 。IMI的某种衍生物与甘氨酸形成的离子化合物
。IMI的某种衍生物与甘氨酸形成的离子化合物 常温下为液态而非固态,原因是
常温下为液态而非固态,原因是___________ 。
(4)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为 。
。
①下列微粒中存在“离域 键”的是
键”的是___________ 。
A. B.
B. C.
C. D.
D.
② 中阴离子
中阴离子 与
与 互为等电子体,均为直线型结构,
互为等电子体,均为直线型结构, 中的2个大π键可表示为
中的2个大π键可表示为___________ 。
(5)符号“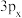 ”没有给出的信息是___________。
”没有给出的信息是___________。
(6)下列实验事实不能用氢键来解释的是___________。
(7)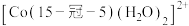 (“15-冠-5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图1所示(
(“15-冠-5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图1所示( 也是配体之一),该配位离子中含有的
也是配体之一),该配位离子中含有的 键数目为
键数目为___________ 。全惠斯勒合金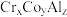 的晶胞结构如图2所示,其化学式为
的晶胞结构如图2所示,其化学式为___________ ,已知该晶胞的边长为apm,则全惠斯勒合金的密度为___________  。
。

(1)Reineckesalt的结构如图所示:

其中配位原子为
 中碳原子杂化方式为
中碳原子杂化方式为(2)重铬酸铵
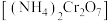 为桔黄色单斜结晶,常用作有机合成催化剂,
为桔黄色单斜结晶,常用作有机合成催化剂, 的结构如图。
的结构如图。
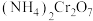 中N、O、Cr三种元素第一电离能由大到小的顺序是
中N、O、Cr三种元素第一电离能由大到小的顺序是(3)
 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为 。IMI的某种衍生物与甘氨酸形成的离子化合物
。IMI的某种衍生物与甘氨酸形成的离子化合物 常温下为液态而非固态,原因是
常温下为液态而非固态,原因是(4)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用
 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为 。
。①下列微粒中存在“离域
 键”的是
键”的是A.
 B.
B. C.
C. D.
D.
②
 中阴离子
中阴离子 与
与 互为等电子体,均为直线型结构,
互为等电子体,均为直线型结构, 中的2个大π键可表示为
中的2个大π键可表示为(5)符号“
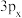 ”没有给出的信息是___________。
”没有给出的信息是___________。| A.能层 | B.能级 | C.电子云在空间的伸展方向 | D.电子的自旋方向 |
(6)下列实验事实不能用氢键来解释的是___________。
A. 比 比 稳定 稳定 |
| B.乙醇能与水以任意比互溶 |
| C.邻羟基苯甲醛的沸点低于对羟基苯甲醛 |
| D.接近沸点的水蒸气的相对分子质量测量值大于18 |
(7)
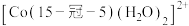 (“15-冠-5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图1所示(
(“15-冠-5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图1所示( 也是配体之一),该配位离子中含有的
也是配体之一),该配位离子中含有的 键数目为
键数目为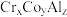 的晶胞结构如图2所示,其化学式为
的晶胞结构如图2所示,其化学式为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】钛及其合金因有比重轻、强度高、耐腐蚀、耐高温等优异性能,广泛用于航天、航空、航海设施、医药等领域。请回答:
(1)基态钛原子的价层电子排布式是___________ 。
(2)Ti-Fe合金、硼氮甲基环戊烷(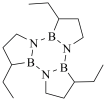 ,间三氮三硼环在结构上与苯极为相似)都可作储氢材料。下列说法正确的是___________。
,间三氮三硼环在结构上与苯极为相似)都可作储氢材料。下列说法正确的是___________。
(3) 分子结构与
分子结构与 相同。
相同。
① 能形成
能形成 ,则H-N-H的键角:
,则H-N-H的键角:
___________ (填“大于”“小于”或“等于”) 。
。
② 遇水难水解,而
遇水难水解,而 极易水解,原因是
极易水解,原因是___________ 。
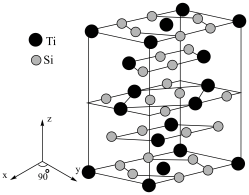
(4)某硅钛化合物具有非常理想的导电性,可作电极材料。其晶胞如图,则化学式为___________ 。
(1)基态钛原子的价层电子排布式是
(2)Ti-Fe合金、硼氮甲基环戊烷(
 ,间三氮三硼环在结构上与苯极为相似)都可作储氢材料。下列说法正确的是___________。
,间三氮三硼环在结构上与苯极为相似)都可作储氢材料。下列说法正确的是___________。| A.吸、放氢过程都发生了化学变化 |
| B.铁元素位于第四周期、第ⅧB族 |
| C.硼氮甲基环戊烷组成元素中的第一电离能:N>B |
D.硼氮甲基环戊烷组成元素中的C、N原子的杂化方式都是 |
 分子结构与
分子结构与 相同。
相同。①
 能形成
能形成 ,则H-N-H的键角:
,则H-N-H的键角:
 。
。②
 遇水难水解,而
遇水难水解,而 极易水解,原因是
极易水解,原因是(4)某硅钛化合物具有非常理想的导电性,可作电极材料。其晶胞如图,则化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】结构化学从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质。
(1)下列说法正确的是______ (填字母)。
A、元素电离能由大到小的顺序:O>N>C
B、一个尿素【CO(NH2)2】分子中含1个π键和7个σ键
C、氯化钠和氯化铯晶体具有相同的晶胞
(2)根据等电子体原理,羰基硫(OCS)分子的电子式应为______ 。光气(COCl2)分子内各原子最外层都满足8电子稳定结构,则光气分子的空间构型为____ (用文字描述)。
(3)Cu2+基态的电子排布式为______ 。将硫酸铜溶液蒸发浓缩后降温结晶,析出蓝色晶体,取25.0g晶体置于坩埚中在一定温度下灼烧,测得剩余固体质量始终保持为23.2g,进一步升高灼烧温度,固体变为白色且质量为16.0g,已知该晶体属于配合物【配合物的内界结构比较稳定】,推测其合理的化学式可以表示为______ 。
(4)通常情况下,溶液中的Fe3+比Fe2+稳定,理由是______ 。
(1)下列说法正确的是
A、元素电离能由大到小的顺序:O>N>C
B、一个尿素【CO(NH2)2】分子中含1个π键和7个σ键
C、氯化钠和氯化铯晶体具有相同的晶胞
(2)根据等电子体原理,羰基硫(OCS)分子的电子式应为
(3)Cu2+基态的电子排布式为
(4)通常情况下,溶液中的Fe3+比Fe2+稳定,理由是
您最近一年使用:0次



