氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
| A.0.1mol/L该酸溶液的pH约为3 |
| B.HCN水溶液中,c(H+)>c(OH-) |
| C.10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应 |
| D.HCN易溶于水 |
更新时间:2020-10-15 15:25:33
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,pH=10的X、Y两种碱溶液各1mL,分别加水稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是

| A.稀释前,两种碱溶液中溶质的物质的量浓度一定相等 |
| B.稀释后,X溶液的碱性比Y溶液的碱性强 |
| C.完全中和X、Y溶液时,消耗同浓度盐酸的体积:VX>VY |
| D.X、Y的碱性强弱:X>Y |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法正确的是
A.为确定某酸 是强酸还是弱酸,可测 是强酸还是弱酸,可测 溶液的 溶液的 。若 。若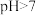 ,则 ,则 是弱酸;若 是弱酸;若 ,则 ,则 是强酸 是强酸 |
B.常温下, 的醋酸溶液中加入少量醋酸钠固体,溶液 的醋酸溶液中加入少量醋酸钠固体,溶液 增大,醋酸的电离度增大 增大,醋酸的电离度增大 |
C. 时,将 时,将 的 的 溶液加水稀释至 溶液加水稀释至 ,所得溶液中的 ,所得溶液中的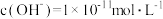 |
D.用同浓度的 溶液分别与等体积等 溶液分别与等体积等 的盐酸和醋酸溶液恰好反应完全,盐酸消耗的 的盐酸和醋酸溶液恰好反应完全,盐酸消耗的 溶液体积多 溶液体积多 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】对于常温下 的乙酸溶液,下列说法正确的是
的乙酸溶液,下列说法正确的是
 的乙酸溶液,下列说法正确的是
的乙酸溶液,下列说法正确的是A.用等浓度 溶液中和等体积该乙酸溶液与 溶液中和等体积该乙酸溶液与 的盐酸,乙酸消耗 的盐酸,乙酸消耗 溶液的体积多 溶液的体积多 |
| B.加水稀释到原体积的10倍后溶液pH变为4 |
| C.加入少量乙酸钠固体,溶液pH降低 |
D.乙酸的电离方程式为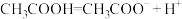 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列由实验操作所对应的现象或所得的结论有错误的是
A.向盛有稀硝酸的小试管中加入铜片,试管口出现红棕色气体,证明铜与稀硝酸反应生成 |
B.向 的饱和溶液中滴加 的饱和溶液中滴加 溶液,出现黄色沉淀,证明 溶液,出现黄色沉淀,证明 的饱和溶液中有 的饱和溶液中有 存在 存在 |
C.向 和 和 混合溶液中滴加氯水,溶液变成红色,证明氯水具有氧化性 混合溶液中滴加氯水,溶液变成红色,证明氯水具有氧化性 |
| D.用等物质的量浓度的醋酸溶液和盐酸做导电性实验,醋酸溶液对应的灯泡较暗,证明醋酸是弱电解质 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】室温下,对于0.1mol/L醋酸溶液。下列判断正确的是
| A.加入少量CH3COONa固体后,溶液的pH降低 |
| B.该溶液中c(CH3COO-)+c(OH-)=c(H+) |
| C.滴加NaOH溶液过程中,n(CH3COO-)与n(CH3COOH)之和始终为0.1mol |
D.与Na2CO3溶液反应的离子方程式为 +2H+=H2O+CO2↑ +2H+=H2O+CO2↑ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,向某浓度的二元弱酸H2A溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2A、HA-、A2-三种微粒的物质的量分数与溶液pH的关系如图所示。下列说法正确的是


| A.常温下,H2A的电离平衡常数Ka1=10-4.2 |
| B.在NaHA溶液中,存在c(Na+)=c(A2-)+c(HA-) |
| C.向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中水的电离程度先增大后减小 |
| D.pH=4.2的溶液中:c(Na+)+c(H+)=c(OH-)+3c(HA-) |
您最近一年使用:0次

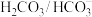 ”缓冲体系对稳定体系酸碱度有重要作用。该缓冲体系可用如下平衡表示:
”缓冲体系对稳定体系酸碱度有重要作用。该缓冲体系可用如下平衡表示: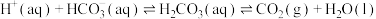 ,下列说法不正确的是
,下列说法不正确的是 属于强电解质,
属于强电解质, 属于弱电解质
属于弱电解质

 易溶于水,可看成是
易溶于水,可看成是 中的
中的 被
被 取代的产物,其水溶液是比肼还弱的碱性溶液。下列有关说法正确的是
取代的产物,其水溶液是比肼还弱的碱性溶液。下列有关说法正确的是 分子稳定性较强是因为分子间含有氢键
分子稳定性较强是因为分子间含有氢键 的水溶液显碱性是因为
的水溶液显碱性是因为 中
中 的键角相同
的键角相同 原子的价层电子对数相同
原子的价层电子对数相同

