某小组利用 H2C2O4溶液与酸性 KMnO4溶液反应来探究“条件对化学反应 速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开 始计时。该小组设计了如下的方案。
(1)已知 H2C2O4被酸性 KMnO4氧化为 CO2逸出,该反应的化学方程式为_____ , 为了观察到实验现象从而判断反应的快慢,H2C2O4与 KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)≥_____
(2)探究温度对化学反应速率影响的实验编号是_____ (填编号,下同),可探究H2C2O4浓度对化学反应速率影响的实验编号是_____
(3)实验①测得反应所用的时间为 40s,忽略混合前后溶液体积的微小变化,这段时间 内平均反应速率 v(KMnO4)=______ 。
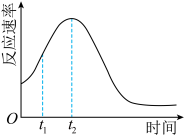
(4)该小组发现室温下反应速率走势如图,有同学认为其中 t1~t2时间内速率变快的主 要原因是反应放热导致反应体系温度升高,你认为还有可能是:_____ , 若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试 剂外,还需要选择的试剂最合理的是_____ (填序号)
A 硫酸钾 B 硫酸锰
C 稀硫酸 D 氯化锰
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 蒸馏水体积/mL | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | |||
① | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 25 |
② | 0.50 | 4.0 | 0.010 | 4.0 | 2.0 | 25 |
③ | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 50 |
(2)探究温度对化学反应速率影响的实验编号是
(3)实验①测得反应所用的时间为 40s,忽略混合前后溶液体积的微小变化,这段时间 内平均反应速率 v(KMnO4)=
(4)该小组发现室温下反应速率走势如图,有同学认为其中 t1~t2时间内速率变快的主 要原因是反应放热导致反应体系温度升高,你认为还有可能是:
A 硫酸钾 B 硫酸锰
C 稀硫酸 D 氯化锰

更新时间:2020-10-29 16:37:23
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】为探究影响化学反应速率的因素,某研究小组设计了如下五个实验。按要求回答下列问题 (已知:Cu2+、Fe3+对H2O2的分解起催化作用) 。
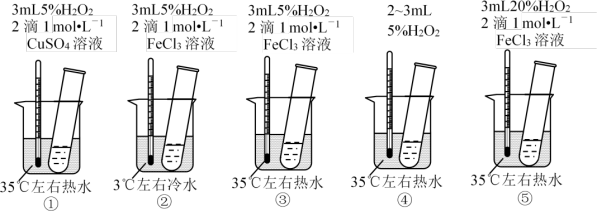
(1)为探究温度对化学反应速率的影响,应选择实验___________ (填序号,下同) ,选择的依据是_______________________ 。
(2)为探究催化剂对化学反应速率的影响,同时探究催化剂不同催化效果不同,应选择实验___________ 。
(3)通过观察发现实验⑤比实验③现象明显,其原因是____________________ 。
(4)根据上述实验,用H2O2快速制取少量O2,可采取的三条措施为___________ 。

(1)为探究温度对化学反应速率的影响,应选择实验
(2)为探究催化剂对化学反应速率的影响,同时探究催化剂不同催化效果不同,应选择实验
(3)通过观察发现实验⑤比实验③现象明显,其原因是
(4)根据上述实验,用H2O2快速制取少量O2,可采取的三条措施为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某小组利用H2C2O4溶液与用硫酸酸化的KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
(1)该实验是通过_____ 来判断反应的快慢。
(2)写出H2C2O4被KMnO4(H+)氧化的离子反应方程式:__________ ,
(3)探究温度对化学反应速率影响的实验编号是______ 和______ (填编号,下同),可探究H2C2O4浓度对化学反应速率影响的实验编号是______ 和_______ 。
(4)实验①测得反应所用的时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_____ 。
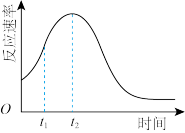
(5)该小组发现室温下反应速率走势如图,其中t1~t2时间内速率变快的主要原因可能是:_______ ,若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是______ (填序号)
A.硫酸钾 B.硫酸锰 C.稀硫酸 D.氯化锰
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 蒸馏水 体积/ml | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | |||
① | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 25 |
② | 0.50 | a | 0.010 | 4.0 | c | 25 |
③ | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 50 |
(2)写出H2C2O4被KMnO4(H+)氧化的离子反应方程式:
(3)探究温度对化学反应速率影响的实验编号是
(4)实验①测得反应所用的时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
(5)该小组发现室温下反应速率走势如图,其中t1~t2时间内速率变快的主要原因可能是:
A.硫酸钾 B.硫酸锰 C.稀硫酸 D.氯化锰

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某化学小组研究盐酸被MnO2氧化的条件,进行如下实验。
(1)已知MnO2呈弱碱性。I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是__ 。
(2)II中发生了分解反应,反应的化学方程式是__ 。
(3)III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV进行探究:

将实验III、IV作对比,得出的结论是__ ;将i、ii作对比,得出的结论是__ 。
(4)由上述实验得出:盐酸能否被氧化与___ 、___ 有关。
实验 | 操作 | 现象 |
I | 常温下将MnO2和12mol·L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
II | 将I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
III | 加热MnO2和4mol·L-1稀盐酸混合物 | 无明显现象 |
(2)II中发生了分解反应,反应的化学方程式是
(3)III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV进行探究:

将实验III、IV作对比,得出的结论是
(4)由上述实验得出:盐酸能否被氧化与
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】利用催化技术可将汽车尾气中的 和
和 转化为
转化为 和
和 ,化学方程式是:
,化学方程式是: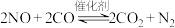
(1)某温度下,在容积不变的密闭容器中通入 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:
用 的浓度变化表示
的浓度变化表示 的平均反应速率为
的平均反应速率为_______  。
。
(2)反应物初始浓度相同时,实验温度为 和
和 ,进行以下实验:
,进行以下实验:
【实验分析与结论】
①补全表格a._______ ,b._______ ,c._______ ,d._______ 。
②测得 ,对比实验Ⅰ、Ⅱ,可得结论:
,对比实验Ⅰ、Ⅱ,可得结论:_______ 。
③通过实验可得到“催化剂的比表面积相同时,温度升高,可增大尾气的转化速率”的结论,证据是_______ 。
 和
和 转化为
转化为 和
和 ,化学方程式是:
,化学方程式是: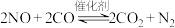
(1)某温度下,在容积不变的密闭容器中通入
 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:时间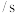 | 0 | 1 | 2 | 3 | …… |
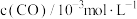 | 3.60 | 3.05 | 2.85 | 2.76 | …… |
 的浓度变化表示
的浓度变化表示 的平均反应速率为
的平均反应速率为 。
。(2)反应物初始浓度相同时,实验温度为
 和
和 ,进行以下实验:
,进行以下实验:| 实验编号 | 实验目的 |  | 同种催化剂的比表面积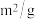 | 一段时间内的平均速率/ |
| Ⅰ | 对照实验 | 280 | 80 | 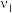 |
| Ⅱ | 研究催化剂比表面积对尾气转化速率的影响 | a | 120 | 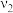 |
| Ⅲ | b | c | d | 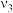 |
①补全表格a.
②测得
 ,对比实验Ⅰ、Ⅱ,可得结论:
,对比实验Ⅰ、Ⅱ,可得结论:③通过实验可得到“催化剂的比表面积相同时,温度升高,可增大尾气的转化速率”的结论,证据是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某同学用硫代硫酸钠(Na2S2O3)与盐酸进行探究实验,实验方法如图所示:
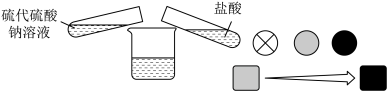
(1)该探究实验的实验目的为___________ 。
(2)表中,a为___________ ,b为___________ 。
(3)实验表明,实验III的反应速率最快,支持这一结论的实验现象为___________ 。
(4)为了更好的完成这个探究实验,你认为还可以进行探究的因素有___________ 。

| 实验序号 | Na2S2O3溶液 | 盐酸溶液 | 蒸馏水 | 温度/℃ | ||
| 浓度(mol/L) | 体积/mL | 浓度(mol/L) | 体积/mL | 体积/mL | ||
| I | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
| II | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
| III | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
(2)表中,a为
(3)实验表明,实验III的反应速率最快,支持这一结论的实验现象为
(4)为了更好的完成这个探究实验,你认为还可以进行探究的因素有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如图:
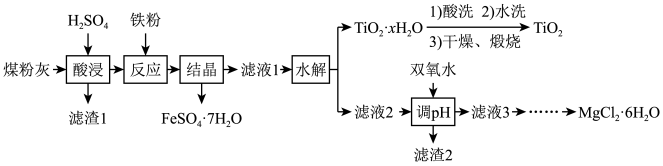
已知:酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离出SO 和一种阳离子。
和一种阳离子。
请回答下列问题:
(1)为了提高酸浸效率,可以采取的措施有_______ 。
(2)“反应”时加入铁粉的作用是_______ (用离子方程式表示)。
(3)资料显示,硫酸亚铁在不同温度下结晶可分别得到不同产物。其溶解度曲线如图所示,则结晶得 的操作是
的操作是_______ 、_______ ,过滤,冷水洗涤,干燥。

(4)“水解”反应的离子方程式是_______ 。所得TiO2·xH2O沉淀进行水洗的具体操作_______ 。
(5)滤渣2的主要成分为_______ (写化学式)。

已知:酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离出SO
 和一种阳离子。
和一种阳离子。请回答下列问题:
(1)为了提高酸浸效率,可以采取的措施有
(2)“反应”时加入铁粉的作用是
(3)资料显示,硫酸亚铁在不同温度下结晶可分别得到不同产物。其溶解度曲线如图所示,则结晶得
 的操作是
的操作是
(4)“水解”反应的离子方程式是
(5)滤渣2的主要成分为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】乙醇是重要的化工原料,乙醇的生产体现化学科学与技术的不断进步。
Ⅰ.以煤为原料生产乙醇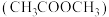 生成乙醇的反应如下:
生成乙醇的反应如下: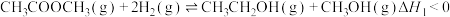 。
。
①能提高乙酸甲酯平衡转化率的条件有___________ (答出两点)。
②当温度为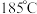 时,存在副反应:
时,存在副反应: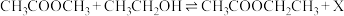 。
。 的电子式是
的电子式是___________ 。
Ⅱ.以 为原料生产乙醇
为原料生产乙醇
(2)制备铜基催化剂:在单质 纳米颗粒中加入单质
纳米颗粒中加入单质 ,反应后形成铜基催化剂。单质
,反应后形成铜基催化剂。单质 与单质
与单质 反应的化学方程式是
反应的化学方程式是___________ 。
(3)电催化还原 。将(2)中制备的催化剂装载在阴极上,以
。将(2)中制备的催化剂装载在阴极上,以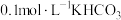 为电解质溶液,阴极得到
为电解质溶液,阴极得到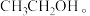
①补充完整阴极反应式:___________ 。
2CO2+___________=CH3CH2OH+___________
②在上述条件下, 的副反应能被明显抑制,分析原因:
的副反应能被明显抑制,分析原因:
ⅰ.相比于 的还原反应,该催化剂对
的还原反应,该催化剂对 的还原反应具有较高的选择性;
的还原反应具有较高的选择性;
ⅱ.___________ (补充完整)。
(4)研究 在阴极被还原为不同产物的途径,结果如图(部分微粒略)。
在阴极被还原为不同产物的途径,结果如图(部分微粒略)。___________ (填序号)。
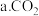 性质稳定,活化
性质稳定,活化 是催化剂的重要性能
是催化剂的重要性能
 途径Ⅰ的含碳产物还可能有
途径Ⅰ的含碳产物还可能有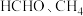 等
等
 按途径Ⅱ(不考虑途径Ⅰ),
按途径Ⅱ(不考虑途径Ⅰ), 转化为
转化为 ,同时生成
,同时生成
②铜基催化剂吸附 密度大且能明显降低
密度大且能明显降低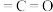 断键的活化能,则铜基催化剂对
断键的活化能,则铜基催化剂对___________ (填甲醇或乙醇)有较高的选择性。
Ⅰ.以煤为原料生产乙醇

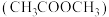 生成乙醇的反应如下:
生成乙醇的反应如下: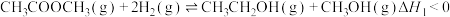 。
。①能提高乙酸甲酯平衡转化率的条件有
②当温度为
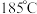 时,存在副反应:
时,存在副反应: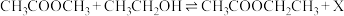 。
。 的电子式是
的电子式是Ⅱ.以
 为原料生产乙醇
为原料生产乙醇(2)制备铜基催化剂:在单质
 纳米颗粒中加入单质
纳米颗粒中加入单质 ,反应后形成铜基催化剂。单质
,反应后形成铜基催化剂。单质 与单质
与单质 反应的化学方程式是
反应的化学方程式是(3)电催化还原
 。将(2)中制备的催化剂装载在阴极上,以
。将(2)中制备的催化剂装载在阴极上,以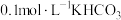 为电解质溶液,阴极得到
为电解质溶液,阴极得到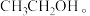
①补充完整阴极反应式:
2CO2+___________=CH3CH2OH+___________
②在上述条件下,
 的副反应能被明显抑制,分析原因:
的副反应能被明显抑制,分析原因:ⅰ.相比于
 的还原反应,该催化剂对
的还原反应,该催化剂对 的还原反应具有较高的选择性;
的还原反应具有较高的选择性;ⅱ.
(4)研究
 在阴极被还原为不同产物的途径,结果如图(部分微粒略)。
在阴极被还原为不同产物的途径,结果如图(部分微粒略)。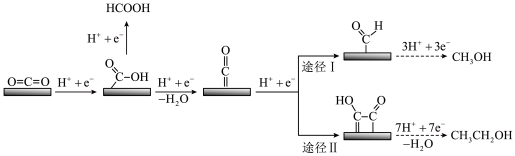
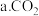 性质稳定,活化
性质稳定,活化 是催化剂的重要性能
是催化剂的重要性能 途径Ⅰ的含碳产物还可能有
途径Ⅰ的含碳产物还可能有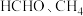 等
等 按途径Ⅱ(不考虑途径Ⅰ),
按途径Ⅱ(不考虑途径Ⅰ), 转化为
转化为 ,同时生成
,同时生成
②铜基催化剂吸附
 密度大且能明显降低
密度大且能明显降低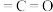 断键的活化能,则铜基催化剂对
断键的活化能,则铜基催化剂对
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某化学反应3A 2B+D在四种不同条件下进行,B、D的起始浓度为0。反应物A的浓度c随时间t的变化情况如下表:
2B+D在四种不同条件下进行,B、D的起始浓度为0。反应物A的浓度c随时间t的变化情况如下表:

根据上述数据,完成下列填空:
(1)在实验1,反应在10min~20min内平均速率为_______ mol/(L·min)
(2)在实验2,A的初始浓度C2_______ mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是_______
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______ v1(填<、>或=),且C3_______ 2.0mol/L(填<、>或=)
(4)比较实验4和实验1,可推测正反应是_______ 反应(填吸热或放热)。理由是_______
(5)该反应化学平衡常数表达式为_______ 。
 2B+D在四种不同条件下进行,B、D的起始浓度为0。反应物A的浓度c随时间t的变化情况如下表:
2B+D在四种不同条件下进行,B、D的起始浓度为0。反应物A的浓度c随时间t的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10min~20min内平均速率为
(2)在实验2,A的初始浓度C2
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3
(4)比较实验4和实验1,可推测正反应是
(5)该反应化学平衡常数表达式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为: 。已知
。已知 ,
,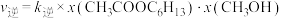 ,其中
,其中 、
、 为正、逆反应速率,
为正、逆反应速率, 、
、 为速率常数,x为各组分的物质的量分数。
为速率常数,x为各组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1∶1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率( )随时间(t)的变化关系如图所示。
)随时间(t)的变化关系如图所示。
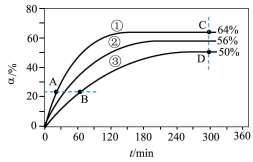
该醇解反应的
___________ 0(填>或<)。348K时,以物质的量分数表示的化学平衡常数
___________ (保留2位有效数字)。在曲线①、②、③中, 与
与 的比值最大的曲线是
的比值最大的曲线是___________ ;A、B、C、D四点中, 最大的是
最大的是___________ , 最大的是
最大的是___________ 。
(2)343K时,己醇和乙酸甲酯按物质的量之比1∶1、1∶2和2∶1进行初始投料。则达到平衡后,初始投料比为___________ 时,乙酸甲酯转化率最大;与按1∶2投料相比,按2∶1投料时化学平衡常数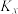
___________ (填增大、减小或不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是___________ 。
a.参与了醇解反应,但并不改变反应历程
b.使 和
和 增大相同倍数
增大相同倍数
c.降低了醇解反应的活化能
d.提高乙酸甲酯的平衡转化率
 。已知
。已知 ,
,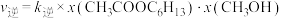 ,其中
,其中 、
、 为正、逆反应速率,
为正、逆反应速率, 、
、 为速率常数,x为各组分的物质的量分数。
为速率常数,x为各组分的物质的量分数。(1)反应开始时,己醇和乙酸甲酯按物质的量之比1∶1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(
 )随时间(t)的变化关系如图所示。
)随时间(t)的变化关系如图所示。
该醇解反应的


 与
与 的比值最大的曲线是
的比值最大的曲线是 最大的是
最大的是 最大的是
最大的是(2)343K时,己醇和乙酸甲酯按物质的量之比1∶1、1∶2和2∶1进行初始投料。则达到平衡后,初始投料比为
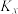
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是
a.参与了醇解反应,但并不改变反应历程
b.使
 和
和 增大相同倍数
增大相同倍数c.降低了醇解反应的活化能
d.提高乙酸甲酯的平衡转化率
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】I.NaNO2溶液和NH4Cl溶液可发生反应:NaNO2+NH4Cl N2↑+NaCl+2H2O。为探究反应速率与c(NaNO2)的关系,利用下列装置(夹持仪器略去)进行实验。
N2↑+NaCl+2H2O。为探究反应速率与c(NaNO2)的关系,利用下列装置(夹持仪器略去)进行实验。
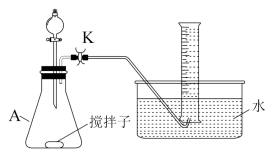
实验步骤:往A中加入一定体积(V)的2.0mol•L-1NaNO2溶液、2.0mol•L-1NH4Cl溶液和水,充分搅拌。控制体系温度,通过分液漏斗往A中加入1.0mol•L-1醋酸。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集1.0mLN2所需的间,重复多次取平均值(t)。回答下列问题:
(1)检验装置气密性的方法:_______ 。
(2)若需控制体系的温度为36℃,采取的合理加热方式为_______ 。
(3)每组实验过程中,反应物浓度变化很小,忽略其对反应速率测定的影响。实验数据如表所示。
①V1=_______ ,V3=_______ 。
②该反应的速率方程为v=k•cm(NaNO2)•c(NH4Cl)•c(H+),k为反应速率常数。利用实验数据计算得m=________ (填整数)。
③醋酸的作用是_______ 。
(4)如果用同浓度的盐酸代替醋酸进行实验1,NaNO2与盐酸反应生成HNO2,HNO2分解产生等物质的量的两种气体,反应结束后,A中红棕色气体逐渐变浅装置中还能观察到的现象有_______ ,HNO2分解产生的两种气体用过量的氢氧化钠溶液吸收进行尾气处理,其反应的离子方程式为_______ 。
II.KI溶液在酸性条件下能与氧气反应。现有以下实验记录:回答下列问题:
(5)该反应的离子方程式为________ 。
(6)该实验的目的是探究_______ 。
(7)实验试剂除了1mol•L-1KI溶液、0.1mol•L-1H2SO4溶液外,还需要的试剂是_______ 。
(8)上述实验操作中除了需要(3)的条件外,还必须控制不变的是_______ (填字母)。
 N2↑+NaCl+2H2O。为探究反应速率与c(NaNO2)的关系,利用下列装置(夹持仪器略去)进行实验。
N2↑+NaCl+2H2O。为探究反应速率与c(NaNO2)的关系,利用下列装置(夹持仪器略去)进行实验。
实验步骤:往A中加入一定体积(V)的2.0mol•L-1NaNO2溶液、2.0mol•L-1NH4Cl溶液和水,充分搅拌。控制体系温度,通过分液漏斗往A中加入1.0mol•L-1醋酸。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集1.0mLN2所需的间,重复多次取平均值(t)。回答下列问题:
(1)检验装置气密性的方法:
(2)若需控制体系的温度为36℃,采取的合理加热方式为
(3)每组实验过程中,反应物浓度变化很小,忽略其对反应速率测定的影响。实验数据如表所示。
| 实验编号 | V/mL | t/s | |||
| NaNO2溶液 | NH4Cl溶液 | 醋酸 | 水 | ||
| 1 | 4.0 | V1 | 4.0 | 8.0 | 334 |
| 2 | V2 | 4.0 | 4.0 | V3 | 150 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 83 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
②该反应的速率方程为v=k•cm(NaNO2)•c(NH4Cl)•c(H+),k为反应速率常数。利用实验数据计算得m=
③醋酸的作用是
(4)如果用同浓度的盐酸代替醋酸进行实验1,NaNO2与盐酸反应生成HNO2,HNO2分解产生等物质的量的两种气体,反应结束后,A中红棕色气体逐渐变浅装置中还能观察到的现象有
II.KI溶液在酸性条件下能与氧气反应。现有以下实验记录:回答下列问题:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(6)该实验的目的是探究
(7)实验试剂除了1mol•L-1KI溶液、0.1mol•L-1H2SO4溶液外,还需要的试剂是
(8)上述实验操作中除了需要(3)的条件外,还必须控制不变的是
| A.温度 | B.试剂的浓度 | C.试剂的用量(体积) | D.试剂添加的顺序 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】丙醛是一种重要的有机原料,在许多领域都有广泛的应用。在铑催化剂作用下,乙烯羰基合成丙醛涉及的反应如下:
主反应Ⅰ.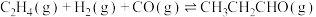

副反应Ⅱ.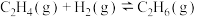

(1)
_____ 0 (填:“>”或“<)。
(2)保持温度不变,在恒容反应器中,按照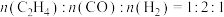 投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时
投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时 的转化率为80%,
的转化率为80%, 的选择性为25%,则
的选择性为25%,则 的转化率为
的转化率为______ %,
_____ kPa/min,反应Ⅰ的
_____  。(用含p的代数式表示,
。(用含p的代数式表示, 的选择性=
的选择性= )。
)。
(3)在装有相同催化剂的。相同恒压容器中,按照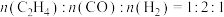 投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下
投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下 的转化率(
的转化率( )如图所示。则B、D两点的平均反应速率v(B)
)如图所示。则B、D两点的平均反应速率v(B)_____ v(D)(填“>”、“=”、“<”),产生这一结果的原因可能是______ 。
(4)T℃时,向恒温恒容的甲容器中,通入1mol 、1mol CO和2mol
、1mol CO和2mol  ;向绝热恒容的乙容器中通入1mol
;向绝热恒容的乙容器中通入1mol  、1mol CO、2mol
、1mol CO、2mol  ,若只发生上述反应Ⅰ。则甲乙容器中
,若只发生上述反应Ⅰ。则甲乙容器中 的平衡转化率
的平衡转化率
____  (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是_____ 。
主反应Ⅰ.
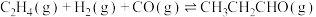

副反应Ⅱ.
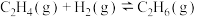


(1)

(2)保持温度不变,在恒容反应器中,按照
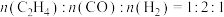 投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时
投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时 的转化率为80%,
的转化率为80%, 的选择性为25%,则
的选择性为25%,则 的转化率为
的转化率为

 。(用含p的代数式表示,
。(用含p的代数式表示, 的选择性=
的选择性= )。
)。(3)在装有相同催化剂的。相同恒压容器中,按照
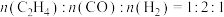 投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下
投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下 的转化率(
的转化率( )如图所示。则B、D两点的平均反应速率v(B)
)如图所示。则B、D两点的平均反应速率v(B)(4)T℃时,向恒温恒容的甲容器中,通入1mol
 、1mol CO和2mol
、1mol CO和2mol  ;向绝热恒容的乙容器中通入1mol
;向绝热恒容的乙容器中通入1mol  、1mol CO、2mol
、1mol CO、2mol  ,若只发生上述反应Ⅰ。则甲乙容器中
,若只发生上述反应Ⅰ。则甲乙容器中 的平衡转化率
的平衡转化率
 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某小组同学探究影响镁与盐酸反应速率的因素。
【查阅资料】
镁与盐酸反应时,Cl-的浓度对反应速率有影响。
【实验过程】
用下图所示装置(夹持装置已略去,气密性良好)进行三组实验。
【问题与讨论】
(1)向反应器中加入NaCl固体的目的是_______ 。
(2)对比三组实验相同时间段内数据可知:在该实验条件下,Cl-的浓度对镁与盐酸反应速率的影响是_______ 。
(3)镁与盐酸反应的化学方程式是_______ 。
(4)你还想探究影响镁与盐酸反应速率的因素是_______ (写出一条即可)。
【查阅资料】
镁与盐酸反应时,Cl-的浓度对反应速率有影响。
【实验过程】
用下图所示装置(夹持装置已略去,气密性良好)进行三组实验。
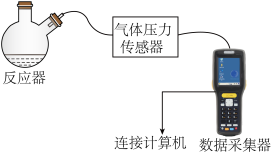
| 加入的n(NaCl)/mol | 6min~7min | 8min~9min | 10min~11min | |
| Δp1/kPa | Δp2/kPa | Δp3/kPa | ||
| 实验Ⅰ | 0.00 | 0.121 | 0.153 | 0.182 |
| 实验Ⅱ | 0.01 | 0.364 | 0.393 | 0.422 |
| 实验Ⅲ | 0.02 | 0.433 | 0.482 | 0.544 |
(1)向反应器中加入NaCl固体的目的是
(2)对比三组实验相同时间段内数据可知:在该实验条件下,Cl-的浓度对镁与盐酸反应速率的影响是
(3)镁与盐酸反应的化学方程式是
(4)你还想探究影响镁与盐酸反应速率的因素是
您最近一年使用:0次



