氯酸钾和浓盐酸之间有下列反应:2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2+2H2O。
(1)该反应中发生还原反应的物质是__________ ,氧化产物是___________ 。
(2)用双线桥标出方程式中的电子得失_______________________________ 。
(3)当有0.2mol电子发生转移时,生成的氯气的体积为____ L(标准状况)。被氧化的HCl的物质的量为____ mol。
(4)若分别用:
①2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
②MnO2+4HCl(浓)=MnCl2 +Cl2↑+2H2O
③Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O
用上述三种方法氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________ 。(填①或②或③)
(5)ClO2具有很强的氧化性。因此,常被用作消毒剂(还原产物为Cl-)其消毒的效率(以单位质量得到的电子数表示)是Cl2(消毒后还原产物也为Cl-)的__________ 倍(结果保留两位小数)。
(1)该反应中发生还原反应的物质是
(2)用双线桥标出方程式中的电子得失
(3)当有0.2mol电子发生转移时,生成的氯气的体积为
(4)若分别用:
①2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
②MnO2+4HCl(浓)=MnCl2 +Cl2↑+2H2O
③Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O
用上述三种方法氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是
(5)ClO2具有很强的氧化性。因此,常被用作消毒剂(还原产物为Cl-)其消毒的效率(以单位质量得到的电子数表示)是Cl2(消毒后还原产物也为Cl-)的
更新时间:2020-11-10 16:07:58
|
相似题推荐
【推荐1】I.有200 mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol·L-1,c(Cl-)为1.3mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4mol·L-1NaOH溶液的体积为___________________ mL
II.焊接铜件时常用的焊药为氯化铵,其作用是消除焊接处的氧化铜。其反应式为 NH4C1+ CuO→Cu+CuCl2+ N2↑+ H2O
(1)配平,并用双线桥法标出电子转移情况。:____________
(2)该反应中,氧化剂和还原剂的物质的量之比为:___________ 。
(3)若反应中电子转移了0.3mol,则产生的气体在标准状况下的体积为_______ L。
II.焊接铜件时常用的焊药为氯化铵,其作用是消除焊接处的氧化铜。其反应式为 NH4C1+ CuO→Cu+CuCl2+ N2↑+ H2O
(1)配平,并用双线桥法标出电子转移情况。:
(2)该反应中,氧化剂和还原剂的物质的量之比为:
(3)若反应中电子转移了0.3mol,则产生的气体在标准状况下的体积为
您最近一年使用:0次
【推荐2】(1)在同温同压下,同体积的气体甲烷(CH4)和二氧化碳密度之比为_________ 。
(2)在K2SO4和Fe2(SO4)3的混合溶液中,Fe3+的物质的量浓度为0.1mol•L-1,SO42-的物质的量浓度为0.3mol•L-1,则混合液中K+的物质的量浓度为______________ mol•L-1 。
(3)将铝粉加入氢氧化钠溶液中,写出该反应的离子方程式:__________ 。
(4)用KMnO4氧化盐酸溶液,反应方程式如下2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,则反应中被氧化的HCl的物质的量是___ mol;用单线桥标出电子转移的方向和数目。___
(2)在K2SO4和Fe2(SO4)3的混合溶液中,Fe3+的物质的量浓度为0.1mol•L-1,SO42-的物质的量浓度为0.3mol•L-1,则混合液中K+的物质的量浓度为
(3)将铝粉加入氢氧化钠溶液中,写出该反应的离子方程式:
(4)用KMnO4氧化盐酸溶液,反应方程式如下2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,则反应中被氧化的HCl的物质的量是
您最近一年使用:0次
【推荐1】合成氨工业生产中所用的α—Fe催化剂的主要成分为FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化剂活性最高,此时混合物中铁的质量分数为
(3)写出由C(炭粉)与Fe2O3在高温下反应制备α—Fe催化剂的化学方程式(另一种产物可溶于水):
(4)为制得这种活性最高的催化剂,理论上应向480gFe2O3粉末加入炭粉的质量是
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】Ⅰ.目前合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用氧化气化法提纯,其反应式为:
___C+ K2Cr2O7+___H2SO4===___CO2↑+___Cr2(SO4)3+___K2SO4+___H2O
(1)配平上述化学反应方程式(请将配平的计量数依次填入上式)_____________ 。
(2)该反应的氧化剂是______________ ,氧化产物的电子式为__________________ 。
(3)H2SO4在上述反应中表现出来的性质是________ (填选项编号)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应中若产生0.2 mol CO2 ,则转移电子的物质的量是_________ mol。
Ⅱ.三氟化氮(NF3)是一种无色无味的气体,可由氟与氨在一定条件下反应制得。
(1)写出该反应化学方程式并标明电子转移的方向和数目____________________________ 。
(2)27.0 mL NF3和水充分反应,生成 18.0 mL NO(同温、同压下),写出反应的化学方程式:______________________________________________________________________ 。
(3)NF3是一种无色无味的气体,但一旦NF3在空气中泄漏,还是易于发现的。该气体泄漏时的现象是_________________________________________________________________ 。
___C+ K2Cr2O7+___H2SO4===___CO2↑+___Cr2(SO4)3+___K2SO4+___H2O
(1)配平上述化学反应方程式(请将配平的计量数依次填入上式)
(2)该反应的氧化剂是
(3)H2SO4在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应中若产生0.2 mol CO2 ,则转移电子的物质的量是
Ⅱ.三氟化氮(NF3)是一种无色无味的气体,可由氟与氨在一定条件下反应制得。
(1)写出该反应化学方程式并标明电子转移的方向和数目
(2)27.0 mL NF3和水充分反应,生成 18.0 mL NO(同温、同压下),写出反应的化学方程式:
(3)NF3是一种无色无味的气体,但一旦NF3在空气中泄漏,还是易于发现的。该气体泄漏时的现象是
您最近一年使用:0次
【推荐3】回答下列问题:
素材Ⅰ.“熬胆矾铁釜,久之亦化为铜”涉及到的化学反应为: ,结合素材回答问题(1)~(3):
,结合素材回答问题(1)~(3):
(1)该反应中 的摩尔质量是
的摩尔质量是________ 。
(2)28g铁粉中含有的Fe原子数是_______ 。
(3)若28g铁粉完全反应,析出Cu单质的物质的量为_______ 。
素材Ⅱ.宋代《洗冤集录》中记载有“银针探毒”,其原理是: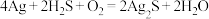 ,结合素材回答问题(4)~(5):
,结合素材回答问题(4)~(5):
(4)在相同条件下体积相同的 和
和 两种气体含有的原子数之比为
两种气体含有的原子数之比为_______ 。
(5)在0℃、101kPa条件下,11.2L氧气完全反应,消耗的 的体积是
的体积是_______ 。
素材Ⅲ.向空气中排放 会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:
会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:
(6)该雨水中氢离子的浓度
________ 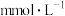 。
。
素材Ⅰ.“熬胆矾铁釜,久之亦化为铜”涉及到的化学反应为:
 ,结合素材回答问题(1)~(3):
,结合素材回答问题(1)~(3):(1)该反应中
 的摩尔质量是
的摩尔质量是(2)28g铁粉中含有的Fe原子数是
(3)若28g铁粉完全反应,析出Cu单质的物质的量为
素材Ⅱ.宋代《洗冤集录》中记载有“银针探毒”,其原理是:
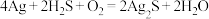 ,结合素材回答问题(4)~(5):
,结合素材回答问题(4)~(5):(4)在相同条件下体积相同的
 和
和 两种气体含有的原子数之比为
两种气体含有的原子数之比为(5)在0℃、101kPa条件下,11.2L氧气完全反应,消耗的
 的体积是
的体积是素材Ⅲ.向空气中排放
 会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:
会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:离子 |
|
|
|
|
|
浓度( | 0.06 | 0.08 | 0.02 | 0.04 | a |

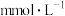 。
。
您最近一年使用:0次
【推荐1】高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,若生成2mol Na2FeO4,则反应中电子转移的物质的量为________ mol。高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含Mn2+1mg的水体样本,需要1.2mg·L-1高铁酸钾________ L。
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】测定某漂白粉样品的有效氯(是指生成氯气的质量与消耗漂白粉质量的比值):称取4.000 g漂白粉,加水溶解后转入500 mL容量瓶中并稀释至刻度。移取25.00 mL溶液到锥形瓶中,加过量的稀盐酸和KI溶液,在淀粉指示下,用0. 101 0 mol/L的Na2S2O3溶液滴定,平均消耗Na2S2O3溶液20. 00 mL。
已知:Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O; 。
。
试计算:
该样品的有效氯为__________ ,写出简要计算过程。
已知:Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O;
 。
。试计算:
该样品的有效氯为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3 mol电子时,消耗H2SO4的质量是______ g,产生氢气的体积(标准状况)________ L。
(2)反应②中________ 作氧化剂,________ 是氧化产物。
(3)当反应②中生成11.2 L SO2气体(标准状况下)时,被还原的H2SO4的物质的量是________ 。
(4)用单线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)__________ 。
(5)反应③中氧化产物与还原产物的物质的量之比为__________ 。
②Cu+2H2SO4(浓)
 CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑ ③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3 mol电子时,消耗H2SO4的质量是
(2)反应②中
(3)当反应②中生成11.2 L SO2气体(标准状况下)时,被还原的H2SO4的物质的量是
(4)用单线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)
(5)反应③中氧化产物与还原产物的物质的量之比为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题
(1)将Cl2通入KOH溶液,反应后得到KCl、 KClO 、KClO3的混合溶液(无其它溶质),经测定KClO和KClO3的个数之比为9:1,则Cl2和KOH溶液反应时,被还原和被氧化的Cl原子的个数之比为_______________ ,参加反应的Cl2和KOH个数之比为_______ 。
(2)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,NaClO被还原成NaCl,若Na2Sx与NaClO的个数之比为1∶16,则x的值为_______________ 。
(1)将Cl2通入KOH溶液,反应后得到KCl、 KClO 、KClO3的混合溶液(无其它溶质),经测定KClO和KClO3的个数之比为9:1,则Cl2和KOH溶液反应时,被还原和被氧化的Cl原子的个数之比为
(2)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,NaClO被还原成NaCl,若Na2Sx与NaClO的个数之比为1∶16,则x的值为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O。若产生的氯气在标准状况下的体积为11.2L。请完成下列问题:
(1)用双线桥表示法标出该反应的电子转移情况______ 。
(2)参加反应的MnO2的质量______ 。
(3)参加反应的HCl的物质的量______ 。
(4)反应中氧化剂与还原剂的物质的量之比______ 。
(1)用双线桥表示法标出该反应的电子转移情况
(2)参加反应的MnO2的质量
(3)参加反应的HCl的物质的量
(4)反应中氧化剂与还原剂的物质的量之比
您最近一年使用:0次








