在不同温度下的水溶液中,c(H+)和c(OH-)的关系如图所示:
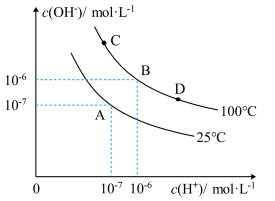
(1)A点水的离子积为________ ,C点水的离子积为_______ ,对纯水由25℃升高温度至100℃时水的离子积______ (填“增大”、“减小”或“不变”)。
(2)100℃时,若向B点溶液中滴加硫酸,体系将由B点移向_____ 点(填C或D),为什么_________ 。
(3)25℃时,0.001mol/L的盐酸溶液pH=_______ ;0.001mol/L的氢氧化钠溶液pH=_________ ;若将二者温度都升高至100℃,_________ (填“盐酸”、“氢氧化钠”、“盐酸和氢氧化钠”)的pH会改变。

(1)A点水的离子积为
(2)100℃时,若向B点溶液中滴加硫酸,体系将由B点移向
(3)25℃时,0.001mol/L的盐酸溶液pH=
20-21高二上·内蒙古乌兰察布·期中 查看更多[4]
内蒙古自治区乌兰察布市集宁一中(西校区)2020-2021学年高二上学期期中考试化学试题(已下线)第三章 水溶液中的离子反应与平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)(已下线)第三单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)新疆喀什地区疏附县第一中学2022-2023学年高二上学期期末考试化学试题
更新时间:2020-11-14 10:41:39
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】任何物质的水溶液都存在水的电离平衡,其电离方程式可表示为H2O H++OH-。请回答下列有关问题:
H++OH-。请回答下列有关问题:
(1)现欲使水的电离平衡向右移动,且所得溶液呈酸性,可以选择的方法有_______ 。
A.加热至100℃ B.加入NaHSO4(s) C.加入CH3COONa(s) D.加入NH4Cl(s)
(2)在t℃时,测得0.01 mol/L的NaOH溶液的pH=11,则该温度下水的离子积为_______ ,此温度_______ 25 ℃(选填“大于”“小于”或“等于”)。
(3)在25℃时,将pH=a的NaOH溶液Va L与pH=b的HCl溶液Vb L混合,请填写下列空白:
①若所得溶液呈中性,且a=11,b=3,则Va∶Vb=_______ 。
②若所得混合溶液的pH=10,且a=12,b=2,则Va∶Vb=_______ 。
 H++OH-。请回答下列有关问题:
H++OH-。请回答下列有关问题:(1)现欲使水的电离平衡向右移动,且所得溶液呈酸性,可以选择的方法有
A.加热至100℃ B.加入NaHSO4(s) C.加入CH3COONa(s) D.加入NH4Cl(s)
(2)在t℃时,测得0.01 mol/L的NaOH溶液的pH=11,则该温度下水的离子积为
(3)在25℃时,将pH=a的NaOH溶液Va L与pH=b的HCl溶液Vb L混合,请填写下列空白:
①若所得溶液呈中性,且a=11,b=3,则Va∶Vb=
②若所得混合溶液的pH=10,且a=12,b=2,则Va∶Vb=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】T℃时,水溶液中c(H+)、c(OH-)的关系如图所示,请回答下列问题:

(1)x表示___________ (填“H+”或“OH-”)浓度;T℃时,水的离子积Kw=___________ ;T___________ (填“>”、“<”或“=”)25。
(2)在T℃下,向Ba(OH)2溶液中逐滴加入pH=4的盐酸,测得加入盐酸前后溶液的pH如下表所示:
①Ba(OH)2溶液的浓度是___________ mol·L-1。
②忽略溶液混合前后的体积变化,则α=___________ 。
(3)T℃下,100mLpH=9的Na2CO3溶液中,水电离出的OH-的物质的量为___________ mol;c(OH-)___________ (填“>”、“<”或“=”)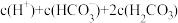 。
。

(1)x表示
(2)在T℃下,向Ba(OH)2溶液中逐滴加入pH=4的盐酸,测得加入盐酸前后溶液的pH如下表所示:
| Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| 22.00 | 0.00 | 8 |
| 22.00 | 18.00 | a |
②忽略溶液混合前后的体积变化,则α=
(3)T℃下,100mLpH=9的Na2CO3溶液中,水电离出的OH-的物质的量为
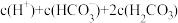 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】下表是不同温度下水的离子积数据:
试回答以下问题:
(1)若25<t1<t2,则a___________ (填“>”“<”或“=”)1×10-14。
(2)25 ℃时,某Na2SO4溶液中c(SO )=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=
)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=___________ 。
(3)在t2 ℃,pH=10的NaOH溶液中,水电离产生的OH-浓度为___________ 。
(4)在t2 ℃下,其溶液的pH=7,则该溶液___________ (填字母)。
a.呈中性 b.呈碱性 c.呈酸性 d.c(OH-)=100c(H+)
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积Kw | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a
(2)25 ℃时,某Na2SO4溶液中c(SO
 )=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=
)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=(3)在t2 ℃,pH=10的NaOH溶液中,水电离产生的OH-浓度为
(4)在t2 ℃下,其溶液的pH=7,则该溶液
a.呈中性 b.呈碱性 c.呈酸性 d.c(OH-)=100c(H+)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】水溶液中存在着各种各样的平衡,如弱电解质的电离、盐类水解等,它们的强度可以由对应的平衡常数K来衡量。
(1)已知Kw(298K)=1.0×10-14和Kw(308K)=2.1×10-14,下列有关纯水叙述正确的是_______。
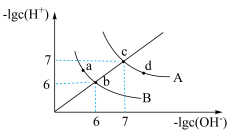
(2)已知水溶液在25℃与100℃时的电离平衡曲线如图所示,下列说法错误的是________。
(1)已知Kw(298K)=1.0×10-14和Kw(308K)=2.1×10-14,下列有关纯水叙述正确的是_______。
| A.308K时纯水pH<7 |
| B.298K时水的电离程度更大 |
| C.308K时c(H+)>c(OH-) |
| D.298K时向水中通入HCl(g),水的电离程度减小,Kw减小 |
(2)已知水溶液在25℃与100℃时的电离平衡曲线如图所示,下列说法错误的是________。

| A.曲线B为100℃时水溶液的电离平衡曲线 |
| B.只有纯水的电离符合直线bc |
| C.从b→a,水的电离可能被促进了 |
| D.从c→d,Kw不改变 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ.下列物质① 、 ②
、 ② 、③NaOH、④
、③NaOH、④ 、⑤
、⑤ 、⑥
、⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨Fe、⑩氯化钠溶液
、⑨Fe、⑩氯化钠溶液
(1)向⑦的溶液中滴加几滴浓盐酸,平衡______ 移动(填“正向”、“逆向”或“不移动”),平衡时溶液中c(H+)______ (填“增大”、“减小”或者“不变”),
______ (填“增大”、“减小”或者“不变”)。
(2)将 的①溶液和
的①溶液和 的③溶液等体积混合后溶液显酸性,原因是
的③溶液等体积混合后溶液显酸性,原因是_____________ (结合有关离子方程式说明)。
(3)将标准状况下2.24L⑥缓慢通入1L0.15mol/L的③的溶液中,气体被充分吸收,离子浓度大小关系____________ 。
(4)将足量⑥缓慢通入1L0.15mol/L的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度_________ 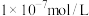 (填“大于”、“小于”、或“等于”),加水稀释后pH
(填“大于”、“小于”、或“等于”),加水稀释后pH_________ 填“增大”、“减小”、或“不变”)。
Ⅱ.常温下,向20mL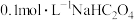 溶液中缓慢滴加pH=13的NaOH溶液,混合溶液的温度与滴加NaOH溶液体积的关系如图2所示。
溶液中缓慢滴加pH=13的NaOH溶液,混合溶液的温度与滴加NaOH溶液体积的关系如图2所示。
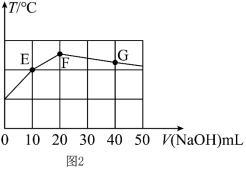
(5)试分析图中E、F、G三点,水的电离程度最大的是_________ 点。
(6)下列关系式正确的是_________ (填字母)。
a.E点存在: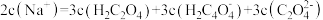
b.F点存在:
c.G点对应的溶液中:
 、 ②
、 ② 、③NaOH、④
、③NaOH、④ 、⑤
、⑤ 、⑥
、⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨Fe、⑩氯化钠溶液
、⑨Fe、⑩氯化钠溶液(1)向⑦的溶液中滴加几滴浓盐酸,平衡

(2)将
 的①溶液和
的①溶液和 的③溶液等体积混合后溶液显酸性,原因是
的③溶液等体积混合后溶液显酸性,原因是(3)将标准状况下2.24L⑥缓慢通入1L0.15mol/L的③的溶液中,气体被充分吸收,离子浓度大小关系
(4)将足量⑥缓慢通入1L0.15mol/L的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度
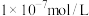 (填“大于”、“小于”、或“等于”),加水稀释后pH
(填“大于”、“小于”、或“等于”),加水稀释后pHⅡ.常温下,向20mL
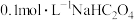 溶液中缓慢滴加pH=13的NaOH溶液,混合溶液的温度与滴加NaOH溶液体积的关系如图2所示。
溶液中缓慢滴加pH=13的NaOH溶液,混合溶液的温度与滴加NaOH溶液体积的关系如图2所示。
(5)试分析图中E、F、G三点,水的电离程度最大的是
(6)下列关系式正确的是
a.E点存在:
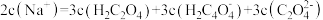
b.F点存在:

c.G点对应的溶液中:

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】I.正常体温下,人体动脉血液的 大约在7.35~7.45之所以能够控制在该范围内,主要是因为
大约在7.35~7.45之所以能够控制在该范围内,主要是因为 分子与
分子与 共存形成“缓冲溶液”(体温下
共存形成“缓冲溶液”(体温下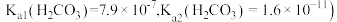 。若血液
。若血液 超出正常范围,则可能导致酸中毒或碱中毒。
超出正常范围,则可能导致酸中毒或碱中毒。
(1)若正常体温下人体动脉血 为7.8,该血液中
为7.8,该血液中
___________ 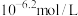 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)理论上,也可通过血液中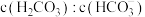 的比值为10:1时,人体发生
的比值为10:1时,人体发生___________ (填“酸中毒”或“碱中毒”或“未中毒”)
Ⅱ.从心脏出发的动脉血会被输送至器官,为有机物的代谢(如葡萄糖的充分氧化)提供所需氧气。血液中氧气被消耗,并产生代谢产物,作为静脉血流回心脏。部分代谢产物可以在呼吸中排出。
(3)葡萄糖充分氧化的产物为___________ (填物质化学式)
(4)可能导致血液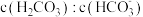 比值变小的情况是___________
比值变小的情况是___________
 大约在7.35~7.45之所以能够控制在该范围内,主要是因为
大约在7.35~7.45之所以能够控制在该范围内,主要是因为 分子与
分子与 共存形成“缓冲溶液”(体温下
共存形成“缓冲溶液”(体温下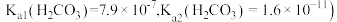 。若血液
。若血液 超出正常范围,则可能导致酸中毒或碱中毒。
超出正常范围,则可能导致酸中毒或碱中毒。(1)若正常体温下人体动脉血
 为7.8,该血液中
为7.8,该血液中
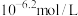 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)理论上,也可通过血液中
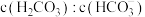 的比值为10:1时,人体发生
的比值为10:1时,人体发生Ⅱ.从心脏出发的动脉血会被输送至器官,为有机物的代谢(如葡萄糖的充分氧化)提供所需氧气。血液中氧气被消耗,并产生代谢产物,作为静脉血流回心脏。部分代谢产物可以在呼吸中排出。
(3)葡萄糖充分氧化的产物为
(4)可能导致血液
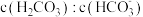 比值变小的情况是___________
比值变小的情况是___________| A.呼吸频率加快 | B.糖类物质代谢速率变慢 |
| C.呼吸频率减慢 | D.糖类物质代谢速率变快 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】完成下列问题。
(1)写出 HClO的电离方程式___________ 。
(2)在常温下,0.1mol/LCH3COONa溶液的pH=9,则溶液中由水电离出来的从c(OH-)___________ 。
(3)Al、B、N的电负性由大到小的顺序排列的顺序为:___________ 。
(4)HCHO分子中碳原子轨道杂化类型是___________ 。
(5)根据甲醇在酸性电解质中与氧气作用生成二氧化碳和水的反应,设计一种燃料电池,该燃料电池工作时,正极的电极反应式是___________ 。
(1)写出 HClO的电离方程式
(2)在常温下,0.1mol/LCH3COONa溶液的pH=9,则溶液中由水电离出来的从c(OH-)
(3)Al、B、N的电负性由大到小的顺序排列的顺序为:
(4)HCHO分子中碳原子轨道杂化类型是
(5)根据甲醇在酸性电解质中与氧气作用生成二氧化碳和水的反应,设计一种燃料电池,该燃料电池工作时,正极的电极反应式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】任何物质的水溶液都存在水的电离平衡。下表是不同温度下水的离子积数据:
完成下列填空:
(1)25℃时,向100mL纯水中加入0.01mol的NH4Cl固体,___ (选填“促进”或“抑制”)了水的电离平衡,所得溶液呈___ 性(选填“酸”、“碱”或“中”),原因是(用离子反应方程式表示)__ 。
(2)若25<t1<t2,则a___ 1×10-14(选填“>”、“<”或“=”),理由是___ 。
(3)t1℃时,测得纯水的c(H+)=2.4×10-7mol/L,则c(OH-)=__ mol/L;该温度下某盐酸溶液的c(Cl-)=0.01mol/L,该溶液的c(OH-)=___ mol/L。
(4)t2℃时,0.01mol/L的NaOH溶液的pH=___ 。
| 温度(℃) | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
完成下列填空:
(1)25℃时,向100mL纯水中加入0.01mol的NH4Cl固体,
(2)若25<t1<t2,则a
(3)t1℃时,测得纯水的c(H+)=2.4×10-7mol/L,则c(OH-)=
(4)t2℃时,0.01mol/L的NaOH溶液的pH=
您最近一年使用:0次

 的盐酸溶液中,由水电离产生的
的盐酸溶液中,由水电离产生的 是
是 。
。 的醋酸钠溶液中,由水电离产生的
的醋酸钠溶液中,由水电离产生的 。
。 和
和 浓度的乘积为
浓度的乘积为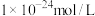 ,该溶液的
,该溶液的

