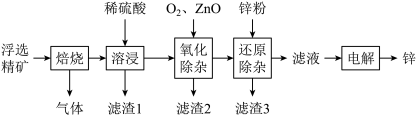
我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为_____ 。
(2)滤渣1的主要成分除SiO2外还有__ ;氧化除杂工序中ZnO的作用是___ ,若不通入氧气,其后果是__ 。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为___ 。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为___ 。

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
(1)焙烧过程中主要反应的化学方程式为
(2)滤渣1的主要成分除SiO2外还有
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为
更新时间:2020-11-22 20:25:31
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】粉煤灰是燃煤产生的重要污染物,主要成分有A12O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。

已知:i伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
ii Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-⇌[FeCl6]3-
(1)写出过程I中Fe2O3发生反应的离子方程式:____ 。
(2)过程II加入过量H2O2的作用是___ 。
(3)过程II加入伯胺一煤油对浸取液进行分离,该操作的名称是_____ 。
(4)从化学平衡角度解释过程III利用NaCI溶液进行反萃取的原理:_____ 。
(5) N2H4具有碱性,可与H+结合生成N2H5+。过程IV中先用过量的N2H4将水层2中Fe3+转化为Fe2+并生成N2,反应的离子方程式为____ ,得到的Fe2+再被O2氧化为FeOOH。
(6)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。
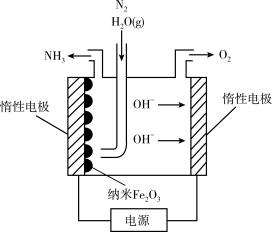
已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe。用化学用语表示Fe2O3在阴极催化生成NH3的反应过程。
第一步:____ ,
第二步:____ 。

已知:i伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O
 Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。ii Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-⇌[FeCl6]3-
(1)写出过程I中Fe2O3发生反应的离子方程式:
(2)过程II加入过量H2O2的作用是
(3)过程II加入伯胺一煤油对浸取液进行分离,该操作的名称是
(4)从化学平衡角度解释过程III利用NaCI溶液进行反萃取的原理:
(5) N2H4具有碱性,可与H+结合生成N2H5+。过程IV中先用过量的N2H4将水层2中Fe3+转化为Fe2+并生成N2,反应的离子方程式为
(6)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。

已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe。用化学用语表示Fe2O3在阴极催化生成NH3的反应过程。
第一步:
第二步:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】杭州亚运会主火炬燃料是“零碳甲醇”,是一种利用焦炉气中的H2和工业废气捕获的CO2生产的绿色燃料,在适宜的过渡金属及其氧化物催化下发生反应:
(1)已知:Ⅰ.

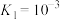
Ⅱ.

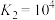
Ⅲ.


则
_________  ,
,
_________ (计算其数值)。
(2)甲醇气相脱水制甲醚(CH3OCH3)的反应可表示为: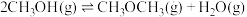
 。
。
①一定温度下,在恒容密闭容器中充入一定量的 发生上述反应,能判断反应达到化学平衡状态的是
发生上述反应,能判断反应达到化学平衡状态的是________
A.CH3OH(g)和CH3OCH3(g)的浓度比保持不变
B.
C.容器内压强不再变化
D.混合气体的平均相对分子质量不再变化
②200℃时向2 L恒容密闭容器中充入2 mol CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如下表:
达平衡时该反应放出的热量为________ kJ,若此时平衡压强为P0,则该温度条件下,压强平衡常数Kp=________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③200℃时,向该容器中投入三种成分的浓度如下:
此时,正、逆反应速率的大小关系为:
________ 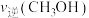 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
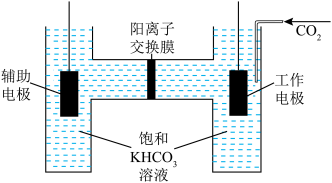
(3)我国科研团队在CO2电化学还原反应机理的研究上取得新突破,CO2电化学还原法中采用TiO2纳米管作电解池工作电极,惰性电极作辅助电极,以一定流速通入CO2,测得CO2生成CO的产率接近80%。
①工作电极上主要发生的电极反应为_____________ ;
②电解一段时间,交换膜左侧溶液的浓度_________ (填“增大”、“减小”或“不变”)。
(1)已知:Ⅰ.


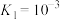
Ⅱ.



Ⅲ.



则

 ,
,
(2)甲醇气相脱水制甲醚(CH3OCH3)的反应可表示为:
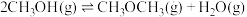
 。
。①一定温度下,在恒容密闭容器中充入一定量的
 发生上述反应,能判断反应达到化学平衡状态的是
发生上述反应,能判断反应达到化学平衡状态的是A.CH3OH(g)和CH3OCH3(g)的浓度比保持不变
B.

C.容器内压强不再变化
D.混合气体的平均相对分子质量不再变化
②200℃时向2 L恒容密闭容器中充入2 mol CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
c(CH3OH)/(mol·L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
③200℃时,向该容器中投入三种成分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
c/(mol·L-1) | 0.64 | 0.68 | 0.68 |

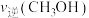 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)我国科研团队在CO2电化学还原反应机理的研究上取得新突破,CO2电化学还原法中采用TiO2纳米管作电解池工作电极,惰性电极作辅助电极,以一定流速通入CO2,测得CO2生成CO的产率接近80%。
①工作电极上主要发生的电极反应为
②电解一段时间,交换膜左侧溶液的浓度
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】现用蓄电池Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2为电源,制取少量高铁酸钾(K2FeO4)。反应装置如图所示:
Fe(OH)2+Ni(OH)2为电源,制取少量高铁酸钾(K2FeO4)。反应装置如图所示:

(1)电解时,石墨电极连接的a极上放电的物质为___________ (填“Fe”或“NiO2”)。
(2)在电解池中,铁电极作为___________ (“阴”或“阳”)极,该电极发生的电极反应式为___________ 。
(3)当消耗掉0.1 mol NiO2时,生成高铁酸钾___________ g,左侧KOH溶液质量变化___________ g。
(4)Mg和Fe都是生产生活中的常用金属。加热锅炉时,水中的MgCO3可以先转化为Mg(HCO3)2,然后转化为Mg(OH)2,求MgCO3+H2O⇌Mg2++ +OH-在80℃时的平衡常数
+OH-在80℃时的平衡常数___________ 。(已知:80℃时H2O的Kw=2.5×10−13,Ksp(MgCO3)=8.4×10−6,Ka1(H2CO3)=4.2×10−7、Ka2(H2CO3)=5.6×10−11)。
 Fe(OH)2+Ni(OH)2为电源,制取少量高铁酸钾(K2FeO4)。反应装置如图所示:
Fe(OH)2+Ni(OH)2为电源,制取少量高铁酸钾(K2FeO4)。反应装置如图所示:
(1)电解时,石墨电极连接的a极上放电的物质为
(2)在电解池中,铁电极作为
(3)当消耗掉0.1 mol NiO2时,生成高铁酸钾
(4)Mg和Fe都是生产生活中的常用金属。加热锅炉时,水中的MgCO3可以先转化为Mg(HCO3)2,然后转化为Mg(OH)2,求MgCO3+H2O⇌Mg2++
 +OH-在80℃时的平衡常数
+OH-在80℃时的平衡常数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】2021 年10月16日神舟十三号载人飞船发射成功,肼是一种良好的火箭燃料,分子式N2H4,为无色油状液体,与水按任意比例互溶形成稳定的水合肼N2H4·H2O,沸点118°C,有强还原性。实验室先制备次氯酸钠,再与尿素[CO(NH2)2]反应制备水合肼,进一步脱水制得肼,实验装置如图所示(部分装置省略)。已知:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl

(1)装置C中制备NaClO的离子方程式为_______ 。反应过程中温度升高易产生副产物NaClO3,可采取的措施是_______ 。装置B中装有饱和食盐水,反应完后关闭K1,装置B的作用是_______ 。
(2)将装置C中制备的溶液转移到装置D的_______ 中,并缓缓滴入,原因是_______ 。
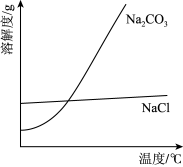
(3)装置D蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3 ·10H2O,获得NaCl粗品的操作是_______ (NaCl和Na2CO3的溶解度曲线如图)。
(4)称取5.0g水合肼样品,加水配成500mL溶液,从中取出10.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.20mol/L的I2溶液进行滴定,滴定终点的现象是_______ ,测得消耗I2溶液的体积为17.50mL,则样品中水合肼N2H4·H2O)的质量百分数为_______ (用百分数表示并保留3位有效数字)。(已知:N2H4·H2O +2I2=N2↑+4HI+H2O)
(5)脱水制得的液态肼,在加热条件下可与新制的Cu(OH)2制备纳米级Cu2O,并产生无污染气体,写出该反应的化学方程式:_______ 。

(1)装置C中制备NaClO的离子方程式为
(2)将装置C中制备的溶液转移到装置D的
(3)装置D蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3 ·10H2O,获得NaCl粗品的操作是

(4)称取5.0g水合肼样品,加水配成500mL溶液,从中取出10.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.20mol/L的I2溶液进行滴定,滴定终点的现象是
(5)脱水制得的液态肼,在加热条件下可与新制的Cu(OH)2制备纳米级Cu2O,并产生无污染气体,写出该反应的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】利用软锰矿(主要成分是 ,其中还含有少量
,其中还含有少量 、
、 、
、 、
、 等杂质)制取高纯硫酸锰的工艺流程如下图所示。
等杂质)制取高纯硫酸锰的工艺流程如下图所示。
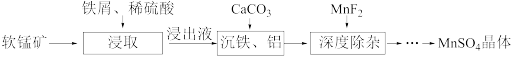
已知:常温下,一些金属氢氧化物沉淀时的 如下表:
如下表:
常温下,一些难溶电解质的溶度积常数如下表:
回答下列问题:
(1)“浸取”时,铁屑与 反应生成
反应生成 的离子方程式为
的离子方程式为_______ ;“浸出液”需要鼓入一段时间空气后,再进行“沉铁”的原因是_______ 。
(2)“沉铁、铝”时,加 控制溶液
控制溶液 范围是
范围是_______ ;完全沉淀时,金属离子浓度为 ,则常温下
,则常温下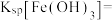
_______ 。
(3)深度除杂中加入 可以除去钙离子、镁离子的原因是
可以除去钙离子、镁离子的原因是_______ (用平衡移动原理解释,已知: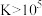 可以认为反应几乎完全进行)。
可以认为反应几乎完全进行)。
(4)用石墨和金属 作电极,电解硫酸锰溶液可以制取金属锰,其中金属
作电极,电解硫酸锰溶液可以制取金属锰,其中金属 应与电源
应与电源_______ (填“正”或“负”)极相连;阳极产生标准状况下体积为 气体时,理论上可以制取
气体时,理论上可以制取_______  。
。
 ,其中还含有少量
,其中还含有少量 、
、 、
、 、
、 等杂质)制取高纯硫酸锰的工艺流程如下图所示。
等杂质)制取高纯硫酸锰的工艺流程如下图所示。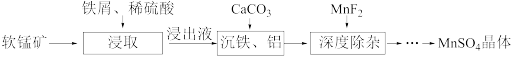
已知:常温下,一些金属氢氧化物沉淀时的
 如下表:
如下表:| 氢氧化物 |  |  |  |  |
开始沉淀 | 1.5 | 6.5 | 7.7 | 3.8 |
沉淀完全 | 3.7 | 9.7 | 9.8 | 5.2 |
| 难溶电解质 |  |  |  |
 | 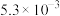 | 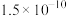 | 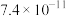 |
(1)“浸取”时,铁屑与
 反应生成
反应生成 的离子方程式为
的离子方程式为(2)“沉铁、铝”时,加
 控制溶液
控制溶液 范围是
范围是 ,则常温下
,则常温下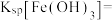
(3)深度除杂中加入
 可以除去钙离子、镁离子的原因是
可以除去钙离子、镁离子的原因是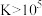 可以认为反应几乎完全进行)。
可以认为反应几乎完全进行)。(4)用石墨和金属
 作电极,电解硫酸锰溶液可以制取金属锰,其中金属
作电极,电解硫酸锰溶液可以制取金属锰,其中金属 应与电源
应与电源 气体时,理论上可以制取
气体时,理论上可以制取 。
。
您最近一年使用:0次
【推荐3】冶金工业中,从冶铅废渣中再提取铅的工艺流程如下:
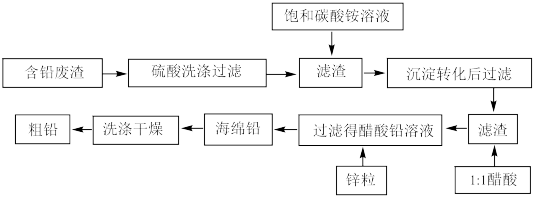
已知:Ksp (PbSO4) =1.6×10 -8;Ksp (PbCO3) =8.0×10 -14;醋酸铅易溶于水,难电离。
回答下列问题:
(1)此化工工艺达到了以下哪些目的:______________ 。
A.减少环境污染 B.提高资源利用率 C.制备醋酸铅 D.制备了纯铅
(2)硫酸洗涤后,生成的PbSO4表面常含有铜单质,为溶解铜,常需要同时加入一定量的H2O2溶液,写出溶解铜的离子方程式:________________________________ ;为加快此反应的速率,下列方法合适的是:_____________ 。
A.搅拌 B.适当加热 C.减压 D.将PbSO4固体粉碎
(3)加入碳酸铵溶液后PbSO4转化为PbCO3。转化的方程式为:PbSO4(s)+ (aq)=PbCO3(s)+
(aq)=PbCO3(s)+ (aq),通过计算,说明该反应能进行的原因:
(aq),通过计算,说明该反应能进行的原因:_________________________ 。这一步骤中,也可以将碳酸铵改用碳酸氢铵,但实际生产效果不好,请说明其中的一个原因:______________________________________________________ 。
(4)处理含铅废渣1000g(含铅以PbSO4计,质量分数为0.303),若回收率为 95% 。经原子吸收分光光度法及 EDTA 滴定法测定,产品(粗铅)纯度为 90%。则得到的粗铅质量为(保留一位小数)______________ 。

已知:Ksp (PbSO4) =1.6×10 -8;Ksp (PbCO3) =8.0×10 -14;醋酸铅易溶于水,难电离。
回答下列问题:
(1)此化工工艺达到了以下哪些目的:
A.减少环境污染 B.提高资源利用率 C.制备醋酸铅 D.制备了纯铅
(2)硫酸洗涤后,生成的PbSO4表面常含有铜单质,为溶解铜,常需要同时加入一定量的H2O2溶液,写出溶解铜的离子方程式:
A.搅拌 B.适当加热 C.减压 D.将PbSO4固体粉碎
(3)加入碳酸铵溶液后PbSO4转化为PbCO3。转化的方程式为:PbSO4(s)+
 (aq)=PbCO3(s)+
(aq)=PbCO3(s)+ (aq),通过计算,说明该反应能进行的原因:
(aq),通过计算,说明该反应能进行的原因:(4)处理含铅废渣1000g(含铅以PbSO4计,质量分数为0.303),若回收率为 95% 。经原子吸收分光光度法及 EDTA 滴定法测定,产品(粗铅)纯度为 90%。则得到的粗铅质量为(保留一位小数)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】氢气和氯气都是重要的化工原料。回答下列问题:
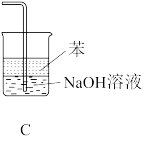
(1)利用下图装置制备并收集干燥纯净的氯气。

①装置甲中发生反应的离子方程式为_____________ ;装置乙的作用是____________ ;
②某同学提出,戊装置中可能会发生倒吸,建议使用下列装置中的____________ (填标号);


(2)利用启普发生器(如图所示)可以便捷地制取氢气。
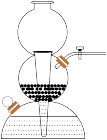
①使用启普发生器前首先应进行的操作是____________ ;
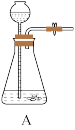
②下列装置与启普发生器原理相近的是____________ (填标号);


(3)某同学设计了如图装置,在获得盐酸的同时对外提供电能。
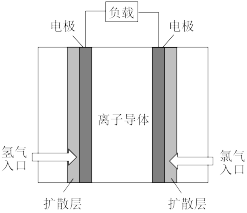
①该装置中的“离子导体”宜选用____________ (填标号);
A.稀盐酸 B.稀氢氧化钠溶液 C.浓硫酸 D.乙醇
②写出负极的电极反应式:____________ 。
(1)利用下图装置制备并收集干燥纯净的氯气。

①装置甲中发生反应的离子方程式为
②某同学提出,戊装置中可能会发生倒吸,建议使用下列装置中的



(2)利用启普发生器(如图所示)可以便捷地制取氢气。

①使用启普发生器前首先应进行的操作是
②下列装置与启普发生器原理相近的是



(3)某同学设计了如图装置,在获得盐酸的同时对外提供电能。

①该装置中的“离子导体”宜选用
A.稀盐酸 B.稀氢氧化钠溶液 C.浓硫酸 D.乙醇
②写出负极的电极反应式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】硫代硫酸钠是一种常见化学试剂,临床医学上用于氰化物、砷、铋、碘、汞、铅等中毒治疗。实验室用SO2通入Na2S和 Na2CO3的混合溶液中来制备Na2S2O3·5H2O。回答下列问题:
I.提纯Na2S。
已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。在如图装置圆底烧瓶中放入工业级Na2S,并加入一定量的酒精和少量水。待烧瓶中固体不再减少时,停止加热,将烧瓶取下,立即趁热过滤,再冷却结晶,抽滤。将所得固体洗涤、干燥,得到Na2S晶体。

(1)图中冷凝管的作用是_______ ,步骤中趁热过滤的目的是_______
II.利用如图装置合成硫代硫酸钠。
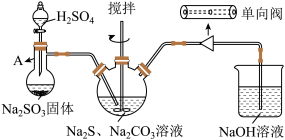
(2)装置中单向阀的作用是_______ ,三颈瓶中生成Na2S2O3的化学方程式为_______ ,充分反应后将三颈瓶中溶液进行一系列操作得到Na2S2O3·5H2O晶体。
III.测定产品纯度。
准确称取wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1mol/L碘的标准溶液滴定。反应原理为:I2+2S2O =S4O
=S4O +2I-。
+2I-。
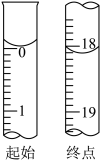
(3)①滴定至终点时,滴定终点的现象是_______ 。
②滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_______ mL,若滴定终点时俯视视凹液面,则测定产品的纯度结果_______ (填“偏高”、“偏低”、或“无影响”)。
(4)硫代硫酸钠晶体中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂实验,检测产品中是否存在Na2SO4杂质,简要说明实验操作、现象和结论。_______ 。(可供选择的试剂有:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)
I.提纯Na2S。
已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。在如图装置圆底烧瓶中放入工业级Na2S,并加入一定量的酒精和少量水。待烧瓶中固体不再减少时,停止加热,将烧瓶取下,立即趁热过滤,再冷却结晶,抽滤。将所得固体洗涤、干燥,得到Na2S晶体。

(1)图中冷凝管的作用是
II.利用如图装置合成硫代硫酸钠。

(2)装置中单向阀的作用是
III.测定产品纯度。
准确称取wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1mol/L碘的标准溶液滴定。反应原理为:I2+2S2O
 =S4O
=S4O +2I-。
+2I-。(3)①滴定至终点时,滴定终点的现象是
②滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为

(4)硫代硫酸钠晶体中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂实验,检测产品中是否存在Na2SO4杂质,简要说明实验操作、现象和结论。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】利用某油脂厂制硬化油废弃的镍催化剂(主要含有Ni,还含有Fe、Cu)为原料制备电池材料Ni(OH)2及Cu2S的工艺流程如下:

已知:①Ni2++6NH3·H2O⇌[Ni(NH3)6]2++6H2O
②制备过程中,降低Ni(OH)2沉淀速率,可以避免沉淀团聚,提升电池性能
③25℃时相关物质的Ksp见下表
回答下列问题:
(1)反应器I中加入NaOH溶液的主要目的是_______ 。
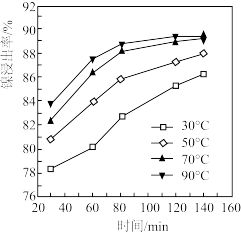
(2)保持其它条件不变,在不同温度下进行稀H2SO4溶浸,镍浸出率随时间变化如图。酸浸的最佳温度和时间分别为_______ ℃、_______ min。
(3)25℃时加入NiCO3调节溶液的pH,则pH的理论最小值为_______ (溶液中离子浓度≤1.0×10-5mol·L-1时,认为该离子沉淀完全)。滤渣II中含有少量FeOOH,写出由Fe3+生成FeOOH的离子方程式_______ 。
(4)反应器IV中,需先加氨水,再加过量NaOH。先加氨水的目的是_______ 。
(5)反应器V中,加入稀硫酸制取Cu2S的化学方程式为_______ 。Cu2S可溶于FeCl3溶液,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为①Cu2S+2CuCl2=4CuCl+S;②_______ 。

已知:①Ni2++6NH3·H2O⇌[Ni(NH3)6]2++6H2O
②制备过程中,降低Ni(OH)2沉淀速率,可以避免沉淀团聚,提升电池性能
③25℃时相关物质的Ksp见下表
| 物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | NiCO3 |
| Ksp | 1.0×10-17 | 1.0×10-38 | 1.0×10-15 | 1.0×10-5 |
(1)反应器I中加入NaOH溶液的主要目的是
(2)保持其它条件不变,在不同温度下进行稀H2SO4溶浸,镍浸出率随时间变化如图。酸浸的最佳温度和时间分别为

(3)25℃时加入NiCO3调节溶液的pH,则pH的理论最小值为
(4)反应器IV中,需先加氨水,再加过量NaOH。先加氨水的目的是
(5)反应器V中,加入稀硫酸制取Cu2S的化学方程式为
您最近一年使用:0次



