AgNO3是中学化学常用试剂,某兴趣小组设计如下实验探究其性质。
Ⅰ.AgNO3的热稳定性
AgNO3受热易分解,用下图装置加热AgNO3固体,试管内有红棕色气体生成,一段时间后,在末端导管口可收集到无色气体a。

(1)实验室检验气体a的方法为______ 。
(2)已知B中只生成一种盐,据此判断AgNO3受热分解的化学方程式为______ 。
(3)从安全角度考虑,上述实验装置存在一处明显缺陷,改进措施为______ 。
Ⅱ.AgNO3与盐溶液的反应
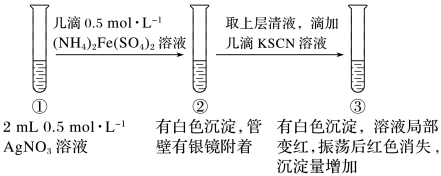
(4)甲同学认为试管②中产生银镜是Fe2+所致,其离子方程式为___ ;
(5)已知:AgSCN为白色沉淀。试管③中红色褪去的原因为___ (请从平衡移动的角度解释)。
Ⅰ.AgNO3的热稳定性
AgNO3受热易分解,用下图装置加热AgNO3固体,试管内有红棕色气体生成,一段时间后,在末端导管口可收集到无色气体a。

(1)实验室检验气体a的方法为
(2)已知B中只生成一种盐,据此判断AgNO3受热分解的化学方程式为
(3)从安全角度考虑,上述实验装置存在一处明显缺陷,改进措施为
Ⅱ.AgNO3与盐溶液的反应

(4)甲同学认为试管②中产生银镜是Fe2+所致,其离子方程式为
(5)已知:AgSCN为白色沉淀。试管③中红色褪去的原因为
更新时间:2020-11-29 19:32:35
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】氮的氧化物(用NOx表示)是大气污染物,必须加以处理。
(1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。反应化学方程式可表示为:______________ 。
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3和NOx反应生成无毒的物质。某同学采用以下装置(见下图)和步骤模拟工业上氮的氧化物处理过程。
Ⅰ.提供的装置。
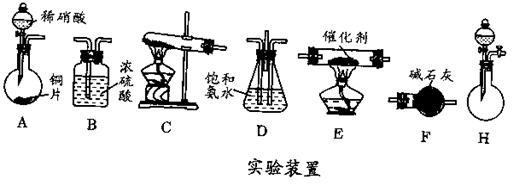
Ⅱ.NH3的制取。
①所提供的装置中能快速、简便制取NH3的装置是:__________ (填仪器序号)。
②若采用C装置制取氨气(控制实验条件相同),情况如表所示。
实验记录
分析表中数据,实验室制NH3产率最高的是:___________________ (填序号),其他组合NH3产率不高的原因是:____________ 。
Ⅲ.模拟尾气的处理。
选用上述部分装置,按下列顺序连接成模拟尾气处理装置:
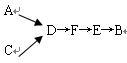
①A中反应的离子方程式:_________ 。
②D装置作用除使气体混合均匀和调节气流速度以外,还有一个作用是_____________ 。
③D装置中的液体可换成_________ (填序号)。
a.CuSO4溶液 b.H2O c.CCl4d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是________________ 。
(1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。反应化学方程式可表示为:
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3和NOx反应生成无毒的物质。某同学采用以下装置(见下图)和步骤模拟工业上氮的氧化物处理过程。
Ⅰ.提供的装置。

Ⅱ.NH3的制取。
①所提供的装置中能快速、简便制取NH3的装置是:
②若采用C装置制取氨气(控制实验条件相同),情况如表所示。
实验记录
| 试剂组合序号 | 固体试剂/g | NH3体积/mL |
| a | 12.0g Ca(OH)2(过量) 10.8g NH4Cl | 2688 |
| b | 12.0g Ca(OH)2(过量) 10.8g(NH4)2SO4 | 2728 |
| c | 12.0g NaOH(过量) 10.8g NH4Cl | 3136 |
| d | 12.0g NaOH(过量) 10.8g (NH4)2SO4 | 3118 |
| e | 12.0g CaO(过量) 10.8g NH4Cl | 3506 |
| f | 12.0g CaO(过量) 10.8g (NH4)2SO4 | 3584 |
分析表中数据,实验室制NH3产率最高的是:
Ⅲ.模拟尾气的处理。
选用上述部分装置,按下列顺序连接成模拟尾气处理装置:
①A中反应的离子方程式:
②D装置作用除使气体混合均匀和调节气流速度以外,还有一个作用是
③D装置中的液体可换成
a.CuSO4溶液 b.H2O c.CCl4d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】依据图1和图2,回答下列问题。
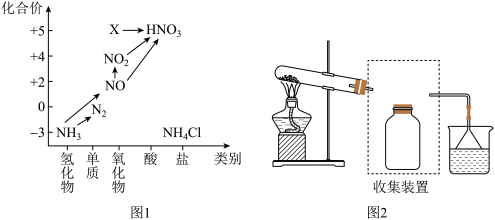
(1)图1能反映出氮元素及其化合物的转化关系。
①X的化学式为___ ,X转化为硝酸___ (填“是”或“不是”)氧化还原反应。
②汽车排气管上装有催化转化器可将尾气中的有害气体CO和NO2反应转化为无害气体排放,反应的化学方程式为___ 。
③在完成氨气的催化氧化实验时,先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达700℃以上。说明反应过程中断键的总能量___ (填“大于”、“小于”或“等于”)成键的总能量。
④若要将NH3转化为N2,从原理上分析,下列试剂可行的是___ (填字母)。
A.O2 B.Na C.NH4Cl D.NO2
⑤用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。现有VL某NaOH溶液能完全吸收nmolNO2和mmolNO组成的大气污染物,则NaOH溶液的物质的量浓度至少为___ mol·L-1。若所得溶液中c(NO )∶c(NO
)∶c(NO )=1∶9,则原混合气体中NO2和NO物质的量之比n∶m=
)=1∶9,则原混合气体中NO2和NO物质的量之比n∶m=___ 。
(2)图2为实验室制取氨气的实验装置。
①实验室常用的制取氨气的化学方程式为___ 。
②下列试剂不能用于干燥NH3的是___ (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体 D.生石灰
③若要收集一瓶氨气,请将上述装置补充完整,在图2虚框内画出连接图___ 。
④氯碱工业中可用氨气检查氯气管道是否泄漏,泄漏的氯气遇到氨气会产生白烟,反应的化学方程式为___ 。

(1)图1能反映出氮元素及其化合物的转化关系。
①X的化学式为
②汽车排气管上装有催化转化器可将尾气中的有害气体CO和NO2反应转化为无害气体排放,反应的化学方程式为
③在完成氨气的催化氧化实验时,先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达700℃以上。说明反应过程中断键的总能量
④若要将NH3转化为N2,从原理上分析,下列试剂可行的是
A.O2 B.Na C.NH4Cl D.NO2
⑤用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。现有VL某NaOH溶液能完全吸收nmolNO2和mmolNO组成的大气污染物,则NaOH溶液的物质的量浓度至少为
 )∶c(NO
)∶c(NO )=1∶9,则原混合气体中NO2和NO物质的量之比n∶m=
)=1∶9,则原混合气体中NO2和NO物质的量之比n∶m=(2)图2为实验室制取氨气的实验装置。
①实验室常用的制取氨气的化学方程式为
②下列试剂不能用于干燥NH3的是
A.浓硫酸 B.碱石灰 C.NaOH固体 D.生石灰
③若要收集一瓶氨气,请将上述装置补充完整,在图2虚框内画出连接图
④氯碱工业中可用氨气检查氯气管道是否泄漏,泄漏的氯气遇到氨气会产生白烟,反应的化学方程式为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,可配制成混凝土防冻剂、钢筋阻锈剂等。某学习小组用如图所示实验装置及药品来制备亚硝酸钙(夹持装置略去)。
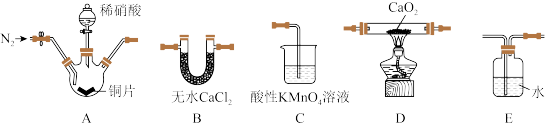
已知:①2NO+CaO2=Ca(NO2)2;2NO2+CaO2=Ca(NO3)2
②酸性条件下,NO能与KMnO4溶液反应生成NO 和Mn2+。
和Mn2+。
请回答下列问题:
(1)盛装铜片的仪器名称为___ ,上述装置按气流方向连接的顺序为___ (填字母)。
(2)检查装置的气密性,装入药品,实验开始前通入一段时间N2,然后关闭弹簧夹,再滴加稀硝酸,通入N2的作用是___ 。
(3)A装置中反应的化学方程式为___ ,E装置的作用是___ 。
(4)C装置中反应的离子方程式为___ ,观察到的现象是___ 。
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,反应原理为:Ca(OH)2+NO+NO2=Ca(NO2)2+H2O。若n(NO):n(NO2)<1:1,则会导致___ 。
(6)将2.88gCaO2完全转化为Ca(NO2)2,理论上至少需要铜的物质的量为___ 。
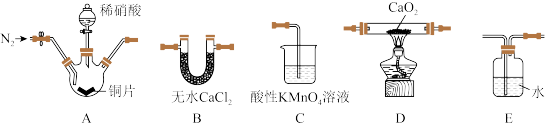
已知:①2NO+CaO2=Ca(NO2)2;2NO2+CaO2=Ca(NO3)2
②酸性条件下,NO能与KMnO4溶液反应生成NO
 和Mn2+。
和Mn2+。请回答下列问题:
(1)盛装铜片的仪器名称为
(2)检查装置的气密性,装入药品,实验开始前通入一段时间N2,然后关闭弹簧夹,再滴加稀硝酸,通入N2的作用是
(3)A装置中反应的化学方程式为
(4)C装置中反应的离子方程式为
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,反应原理为:Ca(OH)2+NO+NO2=Ca(NO2)2+H2O。若n(NO):n(NO2)<1:1,则会导致
(6)将2.88gCaO2完全转化为Ca(NO2)2,理论上至少需要铜的物质的量为
您最近半年使用:0次
【推荐1】含结晶水的化合物X由四种常见元素组成。某同学为探究其组成进行了如下实验:
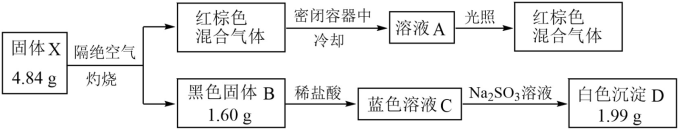
已知:溶液A中仅存在一种溶质,且质量分数为77.8%,光照时又会反应生成红棕色混合气体。请回答下列问题:
(1)化合物X中所含的元素除H和O外,还有______ (用元素符号表示),其化学式为______ 。
(2)写出化合物X隔绝空气加热的化学方程式______ 。
(3)写出向蓝色溶液C中加入Na2SO3溶液生成白色沉淀D的离子方程式______ 。

已知:溶液A中仅存在一种溶质,且质量分数为77.8%,光照时又会反应生成红棕色混合气体。请回答下列问题:
(1)化合物X中所含的元素除H和O外,还有
(2)写出化合物X隔绝空气加热的化学方程式
(3)写出向蓝色溶液C中加入Na2SO3溶液生成白色沉淀D的离子方程式
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】A~G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色,C的硫酸盐溶液通常为蓝色,它们之间有如图转化关系(其中反应③④⑦的产物中的水已略去)。
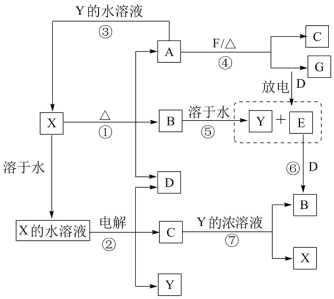
(1)写出G分子的结构式____
(2)写出反应⑦的离子方程式____
(3)写出反应④的化学方程式____
(4)若使F按下列途径完全转化为Y:
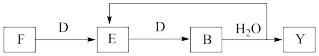
则参加反应的F与整个过程中消耗D的物质的量之比为____

(1)写出G分子的结构式
(2)写出反应⑦的离子方程式
(3)写出反应④的化学方程式
(4)若使F按下列途径完全转化为Y:

则参加反应的F与整个过程中消耗D的物质的量之比为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】 及
及 是中学化学常用试剂,某兴趣小组设计如下实验探究试剂性质。
是中学化学常用试剂,某兴趣小组设计如下实验探究试剂性质。
Ⅰ. 的强氧化性
的强氧化性
采用下列装置,对浓硝酸与木炭的反应进行探究。请回答下列问题:
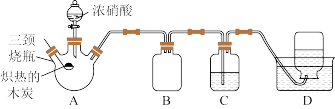
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,立即伸入三颈烧瓶中,并塞紧瓶塞,滴加浓硝酸,三颈烧瓶中反应的化学方程式是
(2)从实现的功能上来说,装置
 的名称是
的名称是(3)装置
 中盛有足量
中盛有足量 溶液,
溶液, 中可能观察到的现象是
中可能观察到的现象是 溶液
溶液 填“能”或“不能”
填“能”或“不能” 用
用 溶液代替。
溶液代替。(4)装置
 中收集到无色气体,部分同学认为是
中收集到无色气体,部分同学认为是 ,还有部分同学认为是
,还有部分同学认为是 。假设装置内空气已排净,
。假设装置内空气已排净, 瓶中收集的气体仅为产物。下列对该气体的检验方法合适的是
瓶中收集的气体仅为产物。下列对该气体的检验方法合适的是 填字母
填字母 。
。A.将试剂瓶取出,放在通风条件良好的桌上敞口观察试剂瓶内气体的颜色是否变红
B.将润湿的蓝色石蕊试纸伸入试剂瓶内,观察试纸是否变红
C.将带火星的木条伸入试剂瓶中,观察木条是否复燃
Ⅱ.AgNO3的热稳定性
受热易分解,用如图装置加热固体,试管内有红棕色气体生成,一段时间后,在末端导管口可收集到无色气体

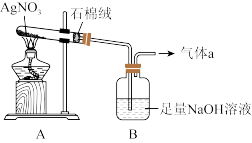
(5)若
 中只生成一种盐,则
中只生成一种盐,则 受热分解的化学方程式为
受热分解的化学方程式为(6)上述实验装置存在的安全隐患为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
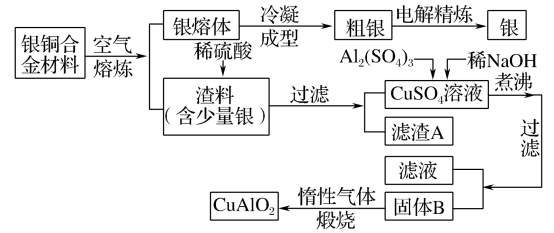
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,电解质溶液可选用_____ ;滤渣A与稀HNO3反应的化学方程式为______ 。
(2)固体混合物B的组成为_______ ;过滤得到固体B时,实验室如何进行洗涤操作?_____ 。
(3)在第一步过滤所得的CuSO4溶液中含有过量的硫酸,若要用该溶液来检测糖尿病需要对溶液进行哪些处理_______ 。检测糖尿病时发生的反应方程__________ 。
(4)完成煅烧过程中一个反应的化学方程式:_____ CuO+ Al2O2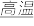 CuAlO2+
CuAlO2+_____ ↑。
(5)理论上生产6.15kgCuAlO2需要含铜的质量分数为64%的银铜合金废料_____ kg。

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,电解质溶液可选用
(2)固体混合物B的组成为
(3)在第一步过滤所得的CuSO4溶液中含有过量的硫酸,若要用该溶液来检测糖尿病需要对溶液进行哪些处理
(4)完成煅烧过程中一个反应的化学方程式:
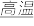 CuAlO2+
CuAlO2+(5)理论上生产6.15kgCuAlO2需要含铜的质量分数为64%的银铜合金废料
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】氨气能与金属氧化物(MxOy)反应生成M、N2和H2O,根据测定出H2O的量可推出金属M的相对原子质量,某研究小组同学用下列装置进行相关实验探究。请回答下列问题:
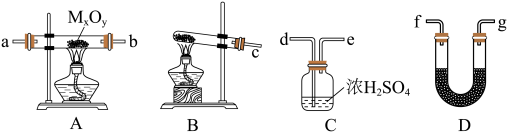
(1)按气流方向,正确的装置接口顺序为c→_________ (填序号,装置可重复使用)。
(2)装置D中盛放的药品名称为______ ,装置C的作用是_______ 。
(3)若实验中准确称取金属氧化物的质量为zg,完全反应后,测得D中生成水的质量为wg。则M的相对原子质量为_____ (用含x、y、z、w的式子表示)。
(4)某同学仔细分析上述装置后认为仍存在缺陷。你认为该如何改进:_________ .
(5)某同学用装置A、B、D以及装置E进行NH3的催化氧化实验研究,其中装置D盛放的药品为Na2O2。
①装置B中盛放的药品为________ .
②装置A中发生反应的化学方程式为_____________
③验证有NO生成的反应现象为_________ ,E中发生反应的化学方程式为____________


(1)按气流方向,正确的装置接口顺序为c→
(2)装置D中盛放的药品名称为
(3)若实验中准确称取金属氧化物的质量为zg,完全反应后,测得D中生成水的质量为wg。则M的相对原子质量为
(4)某同学仔细分析上述装置后认为仍存在缺陷。你认为该如何改进:
(5)某同学用装置A、B、D以及装置E进行NH3的催化氧化实验研究,其中装置D盛放的药品为Na2O2。
①装置B中盛放的药品为
②装置A中发生反应的化学方程式为
③验证有NO生成的反应现象为

您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】为了探究Fe2+、Cu2+、Ag+的氧化性强弱,设计实验如下图所示。

回答下列问题:
(1)写出AgNO3的电离方程式__________________________ 。
(2)已知实验Ⅰ、Ⅱ的现象和结论如下表:
①实验Ⅰ的现象是_____________________
②实验Ⅱ的结论是______________________________ 。
③写出实验Ⅱ的离子方程式______________________________ 。
(3)Cu、Fe、CuSO4溶液、AgNO3溶液均能导电,其中属于纯净物有_________ 种,CuSO4溶液、AgNO3溶液均能导电的原因是_____________________ 。

回答下列问题:
(1)写出AgNO3的电离方程式
(2)已知实验Ⅰ、Ⅱ的现象和结论如下表:
| 实验编号 | 实验现象 | 实验结论 |
| Ⅰ | ① | 氧化性:Cu2+>Fe2+ |
| Ⅱ | 溶液变蓝色 | ② |
②实验Ⅱ的结论是
③写出实验Ⅱ的离子方程式
(3)Cu、Fe、CuSO4溶液、AgNO3溶液均能导电,其中属于纯净物有
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某实验小组利用以下装置制取并探究氨气的性质:
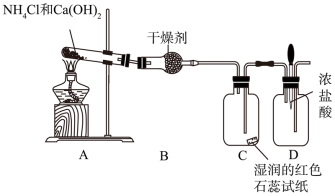
(1)装置A中发生反应的化学方程式为_______ 。加热一段时间发现在试管口处的内壁附着一些白色物质,其原因可能是 _______ 。
(2)装置B中的干燥剂是_______ (填名称)。
(3)装置C中的现象是_______ 。
(4)实验进行一段时间后,挤压装置D中的胶头滴管,滴入1~2滴浓盐酸,装置D中可观察到的现象是_______ 。
(5)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气吸收装置,应选用的装置是_______ (填“E”或“F”), 尾气吸收过程中发生反应的化学方程式为 _______ 。


(1)装置A中发生反应的化学方程式为
(2)装置B中的干燥剂是
(3)装置C中的现象是
(4)实验进行一段时间后,挤压装置D中的胶头滴管,滴入1~2滴浓盐酸,装置D中可观察到的现象是
(5)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气吸收装置,应选用的装置是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】亚硝酸钠(NaNO2)是一种重要化工原料,外观酷似食盐且有咸味,是一种常用的防腐剂,其广泛存在于自然环境中,如蔬菜、肉类、豆类、腌制品等都可以测出一定量的亚硝酸钠。某化学兴趣小组设计如图所示装置(省略夹持装置)制备NaNO2并探究其性质。
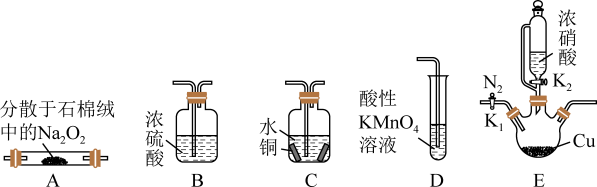
已知:①2NO+Na2O2 =2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO ;
;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3 +2NO↑+ H2O。
回答下列问题:
(1)A中盛Na2O2的玻璃仪器名称是_______ 。
(2)上述实验装置中,依据气流从左至右,装置连接顺序(可重复使用)为_______ 。
(3)连接仪器并检查气密性,检查气密性的具体操作是_______ 。
(4)打开活塞K2之前先通入氮气,其理由是_______ 。
(5)实验时观察到C中溶液变为蓝色,其离子方程式为_______ 。
(6)探究NaNO2性质:实验完毕后,甲同学取少量A中白色粉末(假设为纯净物)溶于水,并滴加几滴稀盐酸,然后加入KI淀粉溶液,溶液变蓝色,甲同学得出结论NaNO2有氧化性,乙同学认为甲同学的结论不严谨,其理由是_______ 。
(7)家里腌制的咸菜中含有一定量的亚硝酸盐,为测定咸菜中亚硝酸根离子的含量,取1 kg咸菜榨汁,将榨出的液体收集后,加入提取剂,过滤得到无色滤液,将该滤液稀释至1 L,取50. 00 mL滤液与过量的稀硫酸和碘化钾溶液的混合液反应,再滴加几滴指示剂,用0. 100 mol·L-1 Na2S2O3溶液进行滴定,共消耗20. 00 mL。计算该咸菜中亚硝酸根离子的含量为______ mg·kg-1。
已知:①2NO +4H++2I- =2NO↑ +I2 +2H2O
+4H++2I- =2NO↑ +I2 +2H2O
②I2+2Na2S2O3=2NaI+Na2S4O6

已知:①2NO+Na2O2 =2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO
 ;
;③HNO2为弱酸,室温下存在反应3HNO2=HNO3 +2NO↑+ H2O。
回答下列问题:
(1)A中盛Na2O2的玻璃仪器名称是
(2)上述实验装置中,依据气流从左至右,装置连接顺序(可重复使用)为
(3)连接仪器并检查气密性,检查气密性的具体操作是
(4)打开活塞K2之前先通入氮气,其理由是
(5)实验时观察到C中溶液变为蓝色,其离子方程式为
(6)探究NaNO2性质:实验完毕后,甲同学取少量A中白色粉末(假设为纯净物)溶于水,并滴加几滴稀盐酸,然后加入KI淀粉溶液,溶液变蓝色,甲同学得出结论NaNO2有氧化性,乙同学认为甲同学的结论不严谨,其理由是
(7)家里腌制的咸菜中含有一定量的亚硝酸盐,为测定咸菜中亚硝酸根离子的含量,取1 kg咸菜榨汁,将榨出的液体收集后,加入提取剂,过滤得到无色滤液,将该滤液稀释至1 L,取50. 00 mL滤液与过量的稀硫酸和碘化钾溶液的混合液反应,再滴加几滴指示剂,用0. 100 mol·L-1 Na2S2O3溶液进行滴定,共消耗20. 00 mL。计算该咸菜中亚硝酸根离子的含量为
已知:①2NO
 +4H++2I- =2NO↑ +I2 +2H2O
+4H++2I- =2NO↑ +I2 +2H2O②I2+2Na2S2O3=2NaI+Na2S4O6
您最近半年使用:0次

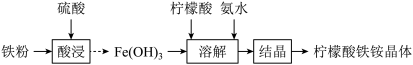
 的实验方案:
的实验方案: 溶液、NaOH溶液,
溶液、NaOH溶液, 溶液;
溶液; 开始沉淀和沉淀完全的pH分别为1.5和3.2。)
开始沉淀和沉淀完全的pH分别为1.5和3.2。)


