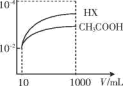
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如右图所示。请回答:
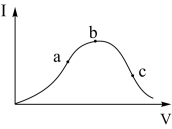
(1)a、b、c三点溶液中c(H+)由大到小的顺序为_____________ ;
(2)a、b、c三点中醋酸电离度最大的是_____________ ;
(3)若使C点溶液的c(CH3COO-)提高,在如下措施中可采取_____ (填标号)
A.通HCl气体
B.加Zn粒
C.加入固体KOH
D.加水
E.加固体CH3COONa

(1)a、b、c三点溶液中c(H+)由大到小的顺序为
(2)a、b、c三点中醋酸电离度最大的是
(3)若使C点溶液的c(CH3COO-)提高,在如下措施中可采取
A.通HCl气体
B.加Zn粒
C.加入固体KOH
D.加水
E.加固体CH3COONa
更新时间:2020-12-01 12:16:04
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】常压下,取不同浓度、不同温度的氨水进行各项内容的测定,得到下表实验数据。
(1)温度升高, 的电离平衡向
的电离平衡向________ (填“左”或“右”)移动,能支持该结论的表中数据是________ (填序号)。
a.电离常数 b.电离度 c. d.
d.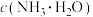
(2)表中 基本不变的原因是
基本不变的原因是________________ 。
(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是________ (填序号)。
A.溶液的 增大 B.氨水的电离度减小 C.
增大 B.氨水的电离度减小 C. 减小 D.
减小 D. 减小
减小
温度 | 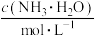 | 电离常数 | 电离度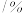 |  |
| 0 | 16.56 | 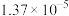 | 9.098 | 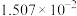 |
| 10 | 15.16 | 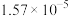 | 10.18 | 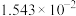 |
| 20 | 13.63 | 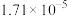 | 11.2 | 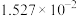 |
(1)温度升高,
 的电离平衡向
的电离平衡向a.电离常数 b.电离度 c.
 d.
d.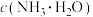
(2)表中
 基本不变的原因是
基本不变的原因是(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是
A.溶液的
 增大 B.氨水的电离度减小 C.
增大 B.氨水的电离度减小 C. 减小 D.
减小 D. 减小
减小
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】25℃时,三种酸的电离平衡常数如表所示。
回答下列问题:
(1)浓度均为0.1mol/L的CH3COOH、HClO、H3PO3溶液中,c(H+)由大到小的排列是______ 。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性Na2HPO3是___________ (填“酸式盐”“碱式盐”或“正盐”),此时亚磷酸的电离平衡常数表达式K=___________ 。
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是___________(填字母)。
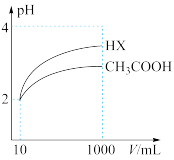
(4)体积为10mL、pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数___________ (填“大于”“小于”或“等于”,下同)醋酸的电离平衡常数。稀释后,HX溶液中水电离出来的c(H+)___________ 醋酸溶液中水电离出来的c(H+)。
| 化学式 | CH3COOH | HClO | H3PO3 |
| 名称 | 醋酸 | 次氯酸 | 亚磷酸 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2=5.6×10-6 |
(1)浓度均为0.1mol/L的CH3COOH、HClO、H3PO3溶液中,c(H+)由大到小的排列是
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性Na2HPO3是
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是___________(填字母)。
| A.c(H+) | B. | C.c(CH3COO-) | D.c(CH3COOH) |

您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】25℃时,三种酸的电离平衡常数如表所示。
回答下列问题:
(1)浓度均为0.1mol/L的CH3COOH,HClO,H3PO3溶液中,c(H+)最小的是___ 。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性Na2HPO3是___ (填“酸式盐”“碱式盐”或“正盐”)。H3PO3的第二级电离方程式为___ 。此时的电离平衡常数表达式K=___ 。
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是___ (填字母)。
A.c(H+) B. C.c(CH3COO-) D.c(CH3COOH)
C.c(CH3COO-) D.c(CH3COOH)
(4)体积均为10mL、c(H+)均为10-2mol/L的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中c(H+)的变化如图所示测HX的电离平衡常数___ (填“大于”、“小于”或“等于”)醋酸的电离平衡常数,理由是___ 。
| 化学式 | CH3COOH | HClO | H3PO3 |
| 名称 | 醋酸 | 次氯酸 | 亚磷酸 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | Ki=8.3×10-3 K2=5.6×10-6 |
回答下列问题:
(1)浓度均为0.1mol/L的CH3COOH,HClO,H3PO3溶液中,c(H+)最小的是
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性Na2HPO3是
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是
A.c(H+) B.
 C.c(CH3COO-) D.c(CH3COOH)
C.c(CH3COO-) D.c(CH3COOH)(4)体积均为10mL、c(H+)均为10-2mol/L的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中c(H+)的变化如图所示测HX的电离平衡常数

您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】蚊虫、蚂蚁等叮咬人时,常向人体血液(存在平衡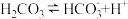 )中注入一种含有蚁酸(即甲酸,分子式为
)中注入一种含有蚁酸(即甲酸,分子式为 )的液体。
)的液体。
(1) 同
同 一样是一种有机弱酸,则
一样是一种有机弱酸,则 在溶液中的电离方程式为
在溶液中的电离方程式为______ 。
(2)当人受到蚂蚁叮咬时,皮肤上会起小疱,即使不治疗,过一段时间小疱也能痊愈,其原因是_________ 。有同学认为,受到蚂蚁叮咬时及时涂抹稀氨水或肥皂水能起到治疗作用,这一观点_______ (填“正确”或“不正确”)。
(3)已知:25℃时, 的电离平衡常数
的电离平衡常数 ,
, 的电离平衡常数
的电离平衡常数 ,
,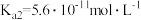 。下列说法正确的是
。下列说法正确的是________ (填标号)。
A 向 溶液中加入甲酸无明显现象
溶液中加入甲酸无明显现象
B 25℃时,向甲酸溶液中加入 溶液,
溶液, 的电离程度和
的电离程度和 均增大
均增大
C 向 甲酸溶液中加入蒸馏水,
甲酸溶液中加入蒸馏水, 增大
增大
D 向碳酸溶液中加入 固体,
固体, 减小
减小
 )中注入一种含有蚁酸(即甲酸,分子式为
)中注入一种含有蚁酸(即甲酸,分子式为 )的液体。
)的液体。(1)
 同
同 一样是一种有机弱酸,则
一样是一种有机弱酸,则 在溶液中的电离方程式为
在溶液中的电离方程式为(2)当人受到蚂蚁叮咬时,皮肤上会起小疱,即使不治疗,过一段时间小疱也能痊愈,其原因是
(3)已知:25℃时,
 的电离平衡常数
的电离平衡常数 ,
, 的电离平衡常数
的电离平衡常数 ,
,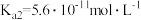 。下列说法正确的是
。下列说法正确的是A 向
 溶液中加入甲酸无明显现象
溶液中加入甲酸无明显现象B 25℃时,向甲酸溶液中加入
 溶液,
溶液, 的电离程度和
的电离程度和 均增大
均增大C 向
 甲酸溶液中加入蒸馏水,
甲酸溶液中加入蒸馏水, 增大
增大D 向碳酸溶液中加入
 固体,
固体, 减小
减小
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】回答下列问题:
I.列出了几组物质,请将物质的合适组号填写在空格上。
(1)其中互为同分异构体的是___________ ,(CH3)2CHCH2CH3的核磁共振氢谱有___________ 组峰。
①金刚石与“足球烯”C60; ②D与T; ③16O、17O和18O; ④氧气(O2)与臭氧(O3); ⑤CH4和CH3CH2CH3; ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑦ 和(CH3)2CHCH2CH3⑧
和(CH3)2CHCH2CH3⑧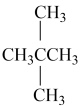 和(CH3)2CHCH2CH3
和(CH3)2CHCH2CH3
II.常温下,浓度均为0.1 mol·L-1的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水。试回答下列问题:
(2)上述溶液中有水解反应发生的是___________ (填编号,下同),溶液中溶质存在电离平衡的是___________
(3)比较等浓度的①、②溶液,pH较大的是___________
(4)在溶液④中加入少量NH4Cl固体,此时 的值将
的值将___________ (填“变小”“变大”或“不变)
I.列出了几组物质,请将物质的合适组号填写在空格上。
(1)其中互为同分异构体的是
①金刚石与“足球烯”C60; ②D与T; ③16O、17O和18O; ④氧气(O2)与臭氧(O3); ⑤CH4和CH3CH2CH3; ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑦
 和(CH3)2CHCH2CH3⑧
和(CH3)2CHCH2CH3⑧ 和(CH3)2CHCH2CH3
和(CH3)2CHCH2CH3II.常温下,浓度均为0.1 mol·L-1的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水。试回答下列问题:
(2)上述溶液中有水解反应发生的是
(3)比较等浓度的①、②溶液,pH较大的是
(4)在溶液④中加入少量NH4Cl固体,此时
 的值将
的值将
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】电离平衡常数(用 表示)的大小可以判断电解质的相对强弱。
表示)的大小可以判断电解质的相对强弱。
(1)水是极弱的电解质, 可表示水的电离程度,其表达式是
可表示水的电离程度,其表达式是_______ ,温度升高, 的值
的值_______ (填“变大”“变小”或“不变”)。
(2) 通常表示弱酸的电离平衡常数,
通常表示弱酸的电离平衡常数, 值越大表示该弱酸的酸性
值越大表示该弱酸的酸性_______ ,当用蒸馏水稀释 醋酸时,醋酸的
醋酸时,醋酸的
_______ (填“变大”“变小”或“不变”)。
(3)常温下, 的盐酸中由水电离出的
的盐酸中由水电离出的 浓度为
浓度为_______ , 的NaOH溶液中由水电离出的
的NaOH溶液中由水电离出的 浓度为
浓度为_______ 。
(4)常温下,4种酸的电离平衡常数如下:
①物质的量浓度相同的HF、 、
、 、HClO中,
、HClO中, 由大到小的顺序是
由大到小的顺序是_______ 。
② 、
、 、
、 、
、 、
、 结合
结合 的能力由大到小的顺序是
的能力由大到小的顺序是_______ 。
 表示)的大小可以判断电解质的相对强弱。
表示)的大小可以判断电解质的相对强弱。(1)水是极弱的电解质,
 可表示水的电离程度,其表达式是
可表示水的电离程度,其表达式是 的值
的值(2)
 通常表示弱酸的电离平衡常数,
通常表示弱酸的电离平衡常数, 值越大表示该弱酸的酸性
值越大表示该弱酸的酸性 醋酸时,醋酸的
醋酸时,醋酸的
(3)常温下,
 的盐酸中由水电离出的
的盐酸中由水电离出的 浓度为
浓度为 的NaOH溶液中由水电离出的
的NaOH溶液中由水电离出的 浓度为
浓度为(4)常温下,4种酸的电离平衡常数如下:
| 化学式 | HF |  |  | HClO |
| 电离平衡常数 | 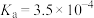 |  |   | 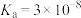 |
 、
、 、HClO中,
、HClO中, 由大到小的顺序是
由大到小的顺序是②
 、
、 、
、 、
、 、
、 结合
结合 的能力由大到小的顺序是
的能力由大到小的顺序是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】回答下列问题。
(1)常温时,FeCl3溶液的pH___ 7(填“>”、“<”或“=”),原因是:(用方程式表示)___ ;
(2)25℃时,向0.1mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH减小,主要原因是______ ;
(3)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。若溶液中只溶解了一种溶质,这四种离子的浓度大小关系为:_____ 。
(1)常温时,FeCl3溶液的pH
(2)25℃时,向0.1mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH减小,主要原因是
(3)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。若溶液中只溶解了一种溶质,这四种离子的浓度大小关系为:
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】现有下列8种物质:①Na2CO3(aq)②NaHCO3(s)③液态氯化氢④Al(OH)3(s)⑤NaOH(s)⑥氯水⑦浓氨水⑧熔融的NaCl
(1)其中能导电且属于电解质的是___ (填序号),NaOH的电离方程式为___ 。
(2)Na2CO3溶液显碱性的原因____ (用离子方程式表示)。
(3)④加入⑤的水溶液中,反应的离子方程式为____ 。
(4)实验室可在⑦中加入⑤快速制取氨气,请用化学平衡移动原理简述原因____ 。
(5)分别采取下列措施后,氯水的漂白能力从强到弱的顺序为___ (用字母表示)。
A.加入少量CaCO3固体 B.不加任何物质 C.加入少量Na2SO3固体
(1)其中能导电且属于电解质的是
(2)Na2CO3溶液显碱性的原因
(3)④加入⑤的水溶液中,反应的离子方程式为
(4)实验室可在⑦中加入⑤快速制取氨气,请用化学平衡移动原理简述原因
(5)分别采取下列措施后,氯水的漂白能力从强到弱的顺序为
A.加入少量CaCO3固体 B.不加任何物质 C.加入少量Na2SO3固体
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】在稀氨水中存在平衡:NH3+H2O NH4++OH-,如进行下列操作,则NH3、NH4+、H+、OH-浓度及pH值如何变化?(试用“增大”“减小”“不变”填写。)(1)通适量HCl气体时,c(NH3)
NH4++OH-,如进行下列操作,则NH3、NH4+、H+、OH-浓度及pH值如何变化?(试用“增大”“减小”“不变”填写。)(1)通适量HCl气体时,c(NH3)____________ ,c(H+)_________ ,pH值__________ 。
(2加入少量NaOH固体时,c(NH4+)________ ,c(OH-)_______ ,PH值____ 。
(3)加入NH4Cl晶体时,c(NH4+)____________ ,c(OH-)____________ 。
 NH4++OH-,如进行下列操作,则NH3、NH4+、H+、OH-浓度及pH值如何变化?(试用“增大”“减小”“不变”填写。)(1)通适量HCl气体时,c(NH3)
NH4++OH-,如进行下列操作,则NH3、NH4+、H+、OH-浓度及pH值如何变化?(试用“增大”“减小”“不变”填写。)(1)通适量HCl气体时,c(NH3)(2加入少量NaOH固体时,c(NH4+)
(3)加入NH4Cl晶体时,c(NH4+)
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】25℃时,50mL0.1mol/L醋酸中存在下述平衡:____________________________
若分别作如下改变,对上述平衡有何影响?
⑴加入少量冰醋酸,平衡将_________ ,溶液中c(H+)将________ (增大、减小、不变);
⑵加入一定量蒸馏水,平衡将_________ ,溶液中c(H+)将________ (增大、减小、不变)
⑶加入少量0.1mol/L盐酸,平衡将_________ ,溶液中c(H+)将________ (增大、减小、不变)
⑷加入20mL0.10mol/LNaCl,平衡将_________ ,溶液中c(H+)将________ (增大、减小、不变)
若分别作如下改变,对上述平衡有何影响?
⑴加入少量冰醋酸,平衡将
⑵加入一定量蒸馏水,平衡将
⑶加入少量0.1mol/L盐酸,平衡将
⑷加入20mL0.10mol/LNaCl,平衡将
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】25 ℃时,50 mL 0.10 mol·L-1醋酸中存在下述平衡:CH3COOH CH3COO-+H+,若分别作如下改变,对上述平衡有何影响?
CH3COO-+H+,若分别作如下改变,对上述平衡有何影响?
(1) 加入少量纯醋酸,电离平衡将___________ (填“向左移动”“向右移动”或“不移动”),溶液中c(H+)将___________ (填“增大”“减小”或“不变”)。
(2)加入一定量蒸馏水,电离平衡将___________ (填“向左移动”“向右移动”或“不移动”),溶液中c(H+)将___________ (填“增大”“减小”或“不变”)。
(3) 加入少量0.10 mol·L-1盐酸,电离平衡将___________ (填“向左移动”“向右移动”或“不移动”),溶液中c(H+)将___________ (填“增大”“减小”或“不变”)。
(4) 加入20 mL 0.10 mol·L-1 NaCl溶液,平衡将___________ (填“向左移动”“向右移动”或“不移动”),溶液中c(H+)将___________ (填“增大”“减小”或“不变”)。
 CH3COO-+H+,若分别作如下改变,对上述平衡有何影响?
CH3COO-+H+,若分别作如下改变,对上述平衡有何影响?(1) 加入少量纯醋酸,电离平衡将
(2)加入一定量蒸馏水,电离平衡将
(3) 加入少量0.10 mol·L-1盐酸,电离平衡将
(4) 加入20 mL 0.10 mol·L-1 NaCl溶液,平衡将
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】ⅰ.(1)氨气极易溶于水,氨气与水反应的化学方程式为_____________________ ;
氨水显碱性的原因是_____________________________ (用离子方程式表示)。
(2)在6份0.01 mol·L-1的氨水中分别加入下列物质:
A.浓氨水 B.纯水 C.少量浓硫酸 D.少量NaOH固体 E.少量Al2(SO4)3固体
①能使c(OH-)减少、c(NH4+)增大的是____ (填字母,下同)。
②能使c(OH-)增大、c(NH4+)减少的是____ 。
③能使c(OH-)和c(NH4+)都增大的是____ 。
④能使c(OH-)和c(NH4+)都减少的是____ 。
ⅱ.某温度下纯水中c(H+)=2×10-7 mol·L-1,则此时c(OH-)=________ ;该温度下向纯水中加盐酸使c(H+)=5×10-6 mol·L-1,则此时c(OH-)=______________________________ 。
氨水显碱性的原因是
(2)在6份0.01 mol·L-1的氨水中分别加入下列物质:
A.浓氨水 B.纯水 C.少量浓硫酸 D.少量NaOH固体 E.少量Al2(SO4)3固体
①能使c(OH-)减少、c(NH4+)增大的是
②能使c(OH-)增大、c(NH4+)减少的是
③能使c(OH-)和c(NH4+)都增大的是
④能使c(OH-)和c(NH4+)都减少的是
ⅱ.某温度下纯水中c(H+)=2×10-7 mol·L-1,则此时c(OH-)=
您最近一年使用:0次



