Ⅰ.利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
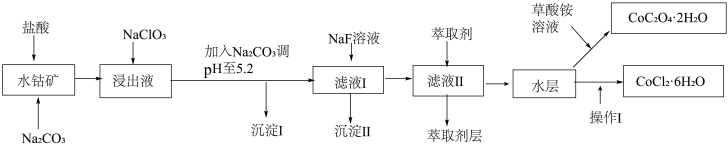
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3目的是______ 。
(2)NaClO3在浸出液中发生反应的离子方程式为______ 。
(3)加入Na2CO3调pH至5.2,目的是______ ;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为______ 。
Ⅱ.科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-=2O2-)
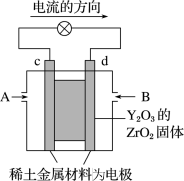
甲 乙
(1)d电极上的电极反应式为______ ;
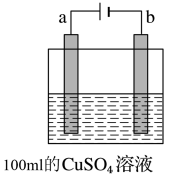
(2)图乙是用惰性电极电解100mL 0.5mol•L-1 CuSO4溶液,a电极上的电极反应式为______ ;若a电极产生56mL(标准状况)气体,则所得溶液的pH=______ (不考虑溶液体积变化及离子的水解),若要使电解质溶液恢复到电解前的状态,可加入______ (选填字母序号)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3目的是
(2)NaClO3在浸出液中发生反应的离子方程式为
(3)加入Na2CO3调pH至5.2,目的是
Ⅱ.科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-=2O2-)


甲 乙
(1)d电极上的电极反应式为
(2)图乙是用惰性电极电解100mL 0.5mol•L-1 CuSO4溶液,a电极上的电极反应式为
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
更新时间:2020-12-31 22:46:56
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】铝及其化合物在医药、食品、污水处理等多个行业有重要作用。以高岭土(主要成分为Al2Si2Ox(OH)y,合有SiO2,Fe3O4、NiO等杂质)为原料,制备Al2O3的一种流程如下:
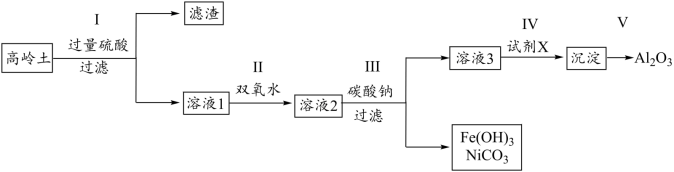
已知部分金属离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表所示:
(1)Al2Si2Ox(OH)y中x、y的值可能是_______ (填字母)
A.7、2 B.5、4 C.6、3 D.3、8
(2)过程I中形成的滤渣主要成分为_______ (填化学式)。
(3)过程II中,加入双氧水的目的是_______ 。
(4)过程III中形成NiCO3的化学方程式_______ 。检验溶液3中铁元素是否沉淀完全的方法是_______ 。
(5)在过程IV中,试剂X应选用_______ (填字母,a.氨水,b.NaOH溶液,c.澄清石灰水),写出对应反应的离子方程式_______ 。

已知部分金属离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表所示:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀时的pH | 3.7 | 2.3 | 7.6 | 5.9 |
| 完全沉淀时的pH | 5.2 | 3.2 | 9.7 | 8.9 |
(1)Al2Si2Ox(OH)y中x、y的值可能是
A.7、2 B.5、4 C.6、3 D.3、8
(2)过程I中形成的滤渣主要成分为
(3)过程II中,加入双氧水的目的是
(4)过程III中形成NiCO3的化学方程式
(5)在过程IV中,试剂X应选用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
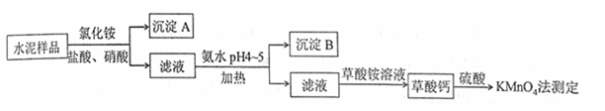
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是将Fe2+氧化为Fe3+ ,其离子方程式________________________ ,还可使用双氧水代替硝酸,其优点是_________________________________________ 。
(2)沉淀B的主要成分是_____ 、_______ ,往沉淀B中加入足量氢氧化钠溶液,现象是_________ ,该反应的离子方程式为____________________________________ 。
(3)加氨水过程需控制溶液的pH值,如何用pH试纸测定溶液的pH值___________ 。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:2 +6H++5H2C2O4=2Mn2++10CO2+8H2O。实验中称取0.800 g水泥样品,滴定时消耗了0.100 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为
+6H++5H2C2O4=2Mn2++10CO2+8H2O。实验中称取0.800 g水泥样品,滴定时消耗了0.100 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________ 。

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是将Fe2+氧化为Fe3+ ,其离子方程式
(2)沉淀B的主要成分是
(3)加氨水过程需控制溶液的pH值,如何用pH试纸测定溶液的pH值
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:2
 +6H++5H2C2O4=2Mn2++10CO2+8H2O。实验中称取0.800 g水泥样品,滴定时消耗了0.100 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为
+6H++5H2C2O4=2Mn2++10CO2+8H2O。实验中称取0.800 g水泥样品,滴定时消耗了0.100 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】明矾[KAl(SO4)2•12H2O]是一种常用的净水剂,以废易拉罐(主要成分为铝和少量不溶于碱性溶液的物质)为原料制取明矾晶体的实验流程如图:

回答下列问题:
(1)“碱溶”步骤中发生反应的化学方程式为___________ 。
(2)“沉铝”步骤在煮沸条件下进行,生成Al(OH)3、NH3和NaHCO3.检验“沉铝”所得滤液中主要阳离子的定性分析操作为___________ (填操作名称)。
(3)由浓硫酸配制250mL“酸溶”所需的9mol•L-1H2SO4溶液需要用到的玻璃仪器有烧杯、玻璃棒、量筒、___________ 、___________ 。
(4)“酸溶”步骤在如图所示的装置中进行,导管的作用是___________ 。圆底烧瓶中发生反应的离子方程式为___________ 。
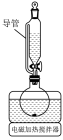

回答下列问题:
(1)“碱溶”步骤中发生反应的化学方程式为
(2)“沉铝”步骤在煮沸条件下进行,生成Al(OH)3、NH3和NaHCO3.检验“沉铝”所得滤液中主要阳离子的定性分析操作为
(3)由浓硫酸配制250mL“酸溶”所需的9mol•L-1H2SO4溶液需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
(4)“酸溶”步骤在如图所示的装置中进行,导管的作用是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】铝(熔点660℃)是一种应用广泛的金属,镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业上以铝土矿(含有Al2O3、Ga2O3、SiO2等物质)为原料提取Al2O3(熔点2045℃),并将Al2O3和冰晶石(Na3AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
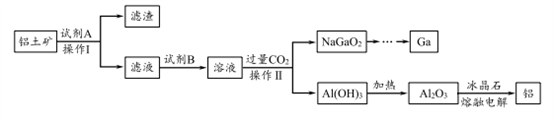
(1)冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,写出铝与CrO3在高温下反应的化学方程式___________________ 。
(2)操作I得到滤渣的主要成分有________________ 。
(3)将0.1 mol/L AlCl3溶液和10% NH4F溶液等体积混合,充分反应后滴加氨水,无沉淀析出。则AlCl3与NH4F反应的化学方程式为________________ ;该实验所用试管及盛装NH4F溶液的试剂瓶均为塑料材质,原因是 _________________________ 。
(4)饮用水中的NO3-对人类健康会产生危害。为了降低饮用水中的NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为_________ ,此方法的缺点是处理后的水中生成了AlO2-,仍然可能对人类健康产生危害,还需对该饮用水进行一系列后续处理。已知:25℃时,Ksp[Al(OH)3]=1.3×10-33,Al(OH)3 AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH=
AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH=____ ,此时水中 =
=__________ 。
(5)工业上常用碳棒作电极电解熔融氧化铝的方法冶炼铝(如图所示)。
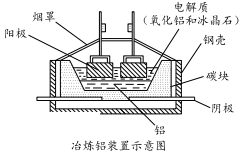
①阴极电极反应式为________________________ 。
②工业生产中,阳极材料要定期补充,其原因是:____________________ 。
(6)下列有关推理不合理的是______ 。
a.工业上可以用热还原法来制取Ga
b.酸性:Al(OH)3>Ga(OH)3
c.由最外层电子数相同可知,镓与铝的化学性质相似
d.可用GaCl3溶液、氨水和盐酸设计实验证明Ga(OH)3的两性

(1)冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,写出铝与CrO3在高温下反应的化学方程式
(2)操作I得到滤渣的主要成分有
(3)将0.1 mol/L AlCl3溶液和10% NH4F溶液等体积混合,充分反应后滴加氨水,无沉淀析出。则AlCl3与NH4F反应的化学方程式为
(4)饮用水中的NO3-对人类健康会产生危害。为了降低饮用水中的NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为
 AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH=
AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH= =
=(5)工业上常用碳棒作电极电解熔融氧化铝的方法冶炼铝(如图所示)。

①阴极电极反应式为
②工业生产中,阳极材料要定期补充,其原因是:
(6)下列有关推理不合理的是
a.工业上可以用热还原法来制取Ga
b.酸性:Al(OH)3>Ga(OH)3
c.由最外层电子数相同可知,镓与铝的化学性质相似
d.可用GaCl3溶液、氨水和盐酸设计实验证明Ga(OH)3的两性
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】对下图中两极加以必要的联接并填空:
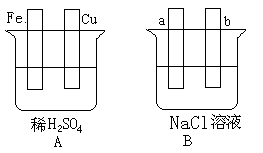
(1)在A图中,请加以必要联接 ,使铜片上冒H2气泡。________
Fe片的电极反应式:________________ ,溶液中SO42-向____ (填“铁”或“铜”)片迁移。
(2)在B图中,请加以必要联接, 使b极析出Cl2。总反应方程式:___________________ 。
(3)若将A、B串联(a接Cu,b接Fe),则a极析出的物质是____________ 。若导线中有0.2mol的电子通过, 则Fe片质量减少________ , 同时a电极产生的气体在标准状况下的体积为__________ 。

(1)在A图中,
Fe片的电极反应式:
(2)在B图中,
(3)若将A、B串联(a接Cu,b接Fe),则a极析出的物质是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】以菱锰矿(主要成分MnCO3,还含有FeCO3、CaCO3、SiO2、Al2O3、Fe2O3、MgCO3等杂质)为原料制备二氧化锰的工艺流程如下:
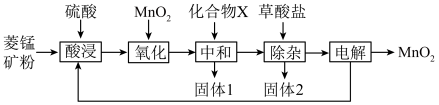
已知草酸钙、草酸镁不溶于水。
(1)写出“氧化”时发生反应的离子方程式:__________________________________________ 。
(2)“中和”的目的是将铁、铝元素转化为沉淀除去,化合物X可用______________________ (写一种物质的化学式)。
(3)该工艺流程中固体1和固体2均需用水洗涤,目的是______________________ 。
(4)“除杂”时,除去的金属离子有______________________________________ 。
(5) 该流程中可以循环使用的物质有________ 。
(6)电解过程中MnO2在______ (填“阴”或“阳”)极生成。

已知草酸钙、草酸镁不溶于水。
(1)写出“氧化”时发生反应的离子方程式:
(2)“中和”的目的是将铁、铝元素转化为沉淀除去,化合物X可用
(3)该工艺流程中固体1和固体2均需用水洗涤,目的是
(4)“除杂”时,除去的金属离子有
(5) 该流程中可以循环使用的物质有
(6)电解过程中MnO2在
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞 (如图1)。
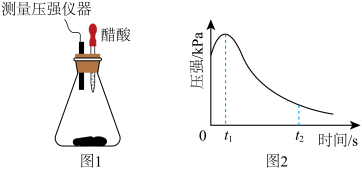
从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了____________ 腐蚀,此时,碳粉表面发生的电极反应式是____________ 。
(2)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确 的是______ 。
A.太阳光催化分解水制氢气比电解水制氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH溶液为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH溶液为介质的氢氧燃料电池的总反应式相同
(3)电动车采用了一种高效耐用的新型可充电电池,该电池的总反应式为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
①该电池放电时负极电极反应式为_________ ;
②充电时阳极电极反应式为_______ 。
(4)下列描述中,符合生产实际的是( )
A. 电解食盐水制得金属钠 B. 电解熔融氯化铝制取金属铝,用石墨作阳极
C. 一氧化碳高温还原铁矿石制得铁 D.电解熔融氧化镁制取金属镁,用铁作阳极
(5)金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阴极发生还原反应,其电极反应式:Ni2++2e-=Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt

从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了
(2)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法
A.太阳光催化分解水制氢气比电解水制氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH溶液为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH溶液为介质的氢氧燃料电池的总反应式相同
(3)电动车采用了一种高效耐用的新型可充电电池,该电池的总反应式为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。①该电池放电时负极电极反应式为
②充电时阳极电极反应式为
(4)下列描述中,符合生产实际的是
A. 电解食盐水制得金属钠 B. 电解熔融氯化铝制取金属铝,用石墨作阳极
C. 一氧化碳高温还原铁矿石制得铁 D.电解熔融氧化镁制取金属镁,用铁作阳极
(5)金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阴极发生还原反应,其电极反应式:Ni2++2e-=Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】图甲为甲烷燃料电池,图乙是在铜钥匙上镀银,图丙是电解精炼铜(粗铜中只含银、铜和锌),请回答下列问题:
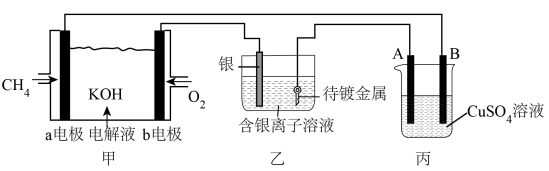
(1)甲装置中a极发生_______ 反应(填“氧化”、“还原”),电极反应式为_______ 。电解质溶液中OH-从_______ 极移向_______ 极(填“a、b”)。
(2)丙装置中A电极上发生的电极反应有_______ 、_______ 。溶液中c(Cu2+)_______ (填“变大”、“变小”或“不变”。)
(3)乙装置电解质溶液中c(Ag+)_______ (填“变大”、“变小”或“不变”。)
(4)如果利用甲电池给铅蓄电池充电,阳极的电极反应式为_______ 。 (已知铅蓄电池的工作原理为: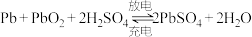 )
)

(1)甲装置中a极发生
(2)丙装置中A电极上发生的电极反应有
(3)乙装置电解质溶液中c(Ag+)
(4)如果利用甲电池给铅蓄电池充电,阳极的电极反应式为
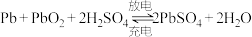 )
)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】 三种强电解质,它们在水中电离出的离子如下表所示:
三种强电解质,它们在水中电离出的离子如下表所示:
如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C作为溶质的三种溶液,电极均为石墨电极,接通电源,经过一段时间后,测得乙中 电极质量增加了
电极质量增加了 。常温下各烧杯中溶液的
。常温下各烧杯中溶液的 与电解时间
与电解时间 的关系如图2所示,据此回答下列问题:
的关系如图2所示,据此回答下列问题:
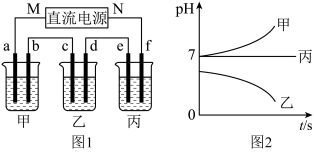
(1) 为电源的
为电源的_____ (填写“正”或“负”)极,f电极的电极反应式为_____ 。
(2)写出乙烧杯中电解反应的离子方程式_____ 。
(3)要使甲恢复到原来的状态,理论上应通入标准状态下的_____ 气体(填化学式)_____ L。
(4)若直流电源使用的是铅酸蓄电池,则放电时 极的电极反应式为
极的电极反应式为_____ , 极附近溶液的
极附近溶液的
_____ (填“升高”或“降低”或“不变”)。铅酸蓄电池充电时,若阳极和阴极之间用质子交换膜隔开,当外电路通过 电子时,则有
电子时,则有_____  阳离子由阳极室转移到阴极室。
阳离子由阳极室转移到阴极室。
 三种强电解质,它们在水中电离出的离子如下表所示:
三种强电解质,它们在水中电离出的离子如下表所示:| 阳离子 |  、 、 |
| 阴离子 |  、 、 、 、 |
 电极质量增加了
电极质量增加了 。常温下各烧杯中溶液的
。常温下各烧杯中溶液的 与电解时间
与电解时间 的关系如图2所示,据此回答下列问题:
的关系如图2所示,据此回答下列问题:
(1)
 为电源的
为电源的(2)写出乙烧杯中电解反应的离子方程式
(3)要使甲恢复到原来的状态,理论上应通入标准状态下的
(4)若直流电源使用的是铅酸蓄电池,则放电时
 极的电极反应式为
极的电极反应式为 极附近溶液的
极附近溶液的
 电子时,则有
电子时,则有 阳离子由阳极室转移到阴极室。
阳离子由阳极室转移到阴极室。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
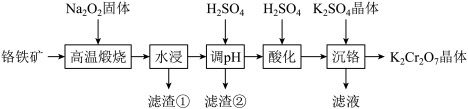
【推荐1】铬铁矿的主要成分为Fe(CrO2)2,还含有MgO、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7的工艺如下(部分操作和条件略)。
注:各物质不同温度溶解度数据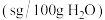
回答下列问题:
(1)“高温煅烧”中Fe(CrO2)2转化为NaFeO2和Na2CrO4,则Na2O2的作用是___________ ;写出Fe(CrO2)2转化为NaFeO2和Na2CrO4反应的化学方程式:___________ 。
(2)“水浸”过程NaFeO2强烈水解,滤渣①的成分是MgO和___________ 。
(3)“调pH”中有沉淀生成,生成沉淀反应的离子方程式为___________ 。
(4)“酸化”用的是硫酸而不是盐酸,原因是:___________ ;室温下,“酸化”反应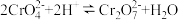 的
的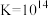 ,酸化后溶液中c(Cr2O
,酸化后溶液中c(Cr2O )=0.25mol·L-1。若
)=0.25mol·L-1。若 有
有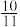 转化为
转化为 ,则此时该温度下溶液的
,则此时该温度下溶液的
___________ 。
(5)“沉铬”中析出K2Cr2O7晶体的方法是___________ 。

注:各物质不同温度溶解度数据
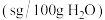
| 物质 | 50℃ | 80℃ | 100℃ |
| K2Cr2O7 | 37.0 | 73.0 | 102.0 |
| Na2SO4 | 46.2 | 43.7 | 42.5 |
回答下列问题:
(1)“高温煅烧”中Fe(CrO2)2转化为NaFeO2和Na2CrO4,则Na2O2的作用是
(2)“水浸”过程NaFeO2强烈水解,滤渣①的成分是MgO和
(3)“调pH”中有沉淀生成,生成沉淀反应的离子方程式为
(4)“酸化”用的是硫酸而不是盐酸,原因是:
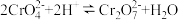 的
的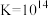 ,酸化后溶液中c(Cr2O
,酸化后溶液中c(Cr2O )=0.25mol·L-1。若
)=0.25mol·L-1。若 有
有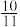 转化为
转化为 ,则此时该温度下溶液的
,则此时该温度下溶液的
(5)“沉铬”中析出K2Cr2O7晶体的方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
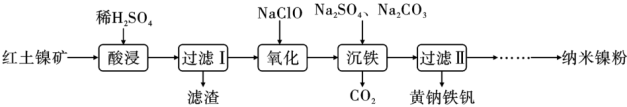
【推荐2】以红土镍矿(主要含有 、FeO、NiO、
、FeO、NiO、 等)为原料,获取高效净水剂黄钠铁矾[
等)为原料,获取高效净水剂黄钠铁矾[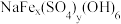 ]和纳米镍粉的部分工艺流程如图:
]和纳米镍粉的部分工艺流程如图:
已知: 在pH约为3.7时可完全转化为
在pH约为3.7时可完全转化为 ,
, 在pH约为9时可完全转化为
在pH约为9时可完全转化为 。
。
(1)若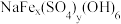 中y=2,则黄钠铁矾的化学式为
中y=2,则黄钠铁矾的化学式为_______ 。
(2)“酸浸”过程,欲提高铁和镍元素的浸出率,可采取的措施为_______ (写出一条即可)。
(3)滤渣的主要成分为_______ 。
(4)“氧化”过程中氧化剂与还原剂的物质的量之比为_______ ,“沉铁”过程中加入碳酸钠的作用是调节溶液的酸碱度,生成黄钠铁矾,应将pH控制在_______ ,写出该反应的化学方程式:_______ 。
(5)高铁酸盐也是优良的含铁净水剂,利用纯铁作电极插入浓的NaOH溶液电解制得 ,请写出阳极生成
,请写出阳极生成 的电极反应式为
的电极反应式为_______ 。
 、FeO、NiO、
、FeO、NiO、 等)为原料,获取高效净水剂黄钠铁矾[
等)为原料,获取高效净水剂黄钠铁矾[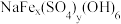 ]和纳米镍粉的部分工艺流程如图:
]和纳米镍粉的部分工艺流程如图:
已知:
 在pH约为3.7时可完全转化为
在pH约为3.7时可完全转化为 ,
, 在pH约为9时可完全转化为
在pH约为9时可完全转化为 。
。(1)若
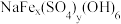 中y=2,则黄钠铁矾的化学式为
中y=2,则黄钠铁矾的化学式为(2)“酸浸”过程,欲提高铁和镍元素的浸出率,可采取的措施为
(3)滤渣的主要成分为
(4)“氧化”过程中氧化剂与还原剂的物质的量之比为
(5)高铁酸盐也是优良的含铁净水剂,利用纯铁作电极插入浓的NaOH溶液电解制得
 ,请写出阳极生成
,请写出阳极生成 的电极反应式为
的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
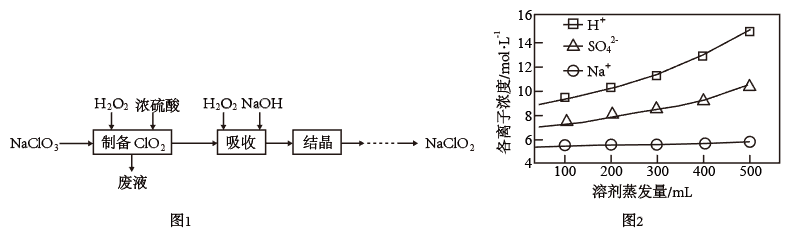
【推荐3】过氧化氢法制备亚氯酸钠(NaClO2)的流程如图1:
已知:①NaClO2常温下稳定,潮湿的NaClO2加热到130℃分解。
②ClO2气体在碱性溶液中会转化为ClO 和ClO
和ClO 。
。
(1)制备ClO2气体的化学方程式为_______ 。
(2)取1L废液,蒸发结晶,测定不同蒸发量下,残留液中各离子的浓度如图2,则析出的晶体为_______ (填化学式)。
(3)吸收时的主要反应为2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O。
①吸收时,需控制反应温度为3℃,可采取的措施为_______ 。
②温度过高,产品的纯度会降低,主要原因是_______ 。
(4)从NaClO2溶液获得产品的可行措施有_______ (填序号)。
a.减压蒸发 b.溶液雾状喷出干燥 c.300℃热空气烘干
(5)准确称取所得亚氯酸钠样品mg于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知ClO +4I-+4H+=2H2O+2I2+Cl-)。取所得混合液的1/10于锥形瓶中,加几滴淀粉溶液,用cmol•L-lNa2S2O3标准液滴定,重复3次,测得平均消耗标准液VmL(已知I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-)。取所得混合液的1/10于锥形瓶中,加几滴淀粉溶液,用cmol•L-lNa2S2O3标准液滴定,重复3次,测得平均消耗标准液VmL(已知I2+2S2O =2I-+S4O
=2I-+S4O ),该样品中NaClO2的纯度为
),该样品中NaClO2的纯度为_______ (用含m、c、V的代数式表示)。

已知:①NaClO2常温下稳定,潮湿的NaClO2加热到130℃分解。
②ClO2气体在碱性溶液中会转化为ClO
 和ClO
和ClO 。
。(1)制备ClO2气体的化学方程式为
(2)取1L废液,蒸发结晶,测定不同蒸发量下,残留液中各离子的浓度如图2,则析出的晶体为
(3)吸收时的主要反应为2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O。
①吸收时,需控制反应温度为3℃,可采取的措施为
②温度过高,产品的纯度会降低,主要原因是
(4)从NaClO2溶液获得产品的可行措施有
a.减压蒸发 b.溶液雾状喷出干燥 c.300℃热空气烘干
(5)准确称取所得亚氯酸钠样品mg于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知ClO
 +4I-+4H+=2H2O+2I2+Cl-)。取所得混合液的1/10于锥形瓶中,加几滴淀粉溶液,用cmol•L-lNa2S2O3标准液滴定,重复3次,测得平均消耗标准液VmL(已知I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-)。取所得混合液的1/10于锥形瓶中,加几滴淀粉溶液,用cmol•L-lNa2S2O3标准液滴定,重复3次,测得平均消耗标准液VmL(已知I2+2S2O =2I-+S4O
=2I-+S4O ),该样品中NaClO2的纯度为
),该样品中NaClO2的纯度为
您最近一年使用:0次



