化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效广谱的灭菌消毒剂。某化学小组针对氯气及其化合物展开以下实验。
Ⅰ.氯碱工业是工业上制备氯气的主要方法,该实验小组采用如下图所示的装置来模拟工业制取氯气。回答下列问题:
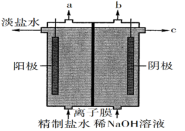
(1)氯气的逸出口是___________ (填“a”或“b”),为了获得比较纯净的NaOH溶液,电解过程中最好选用___________ 离子交换膜(填“阴”或“阳”),电解过程总反应的离子方程式为___________
(2)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为___________
Ⅱ.“84”消毒液是生活中常见的高效杀毒剂,其主要成分为NaClO。某校学生为了测定蓝月亮牌“84”消毒液中NaClO的浓度,进行了如下实验:
①取10.00mL“84”消毒液于烧杯中,加水稀释并恢复至室温后,转移到1000mL容量瓶中定容后备用。
②取20.00mL稀释后的溶液于锥形瓶中,滴加稀H2SO4和过量的KI溶液,NaClO将KI氧化成I2。
③用淀粉做指示剂,生成的I2用0.0800 mol/L Na2S2O3标准溶液滴定至终点,发生的反应为:I2 + 2S2O =2I-+S4O
=2I-+S4O 。
。
④重复滴定3次。
所得数据如下:
回答下列问题:
(3)步骤①定容时还需要的玻璃仪器是___________ ,Na2S2O3标准溶液应该装在___________ 滴定管中
(4)步骤②发生反应的离子方程式为___________
(5)步骤③滴定终点的现象为___________
(6)若滴定前标准液滴定管尖嘴管处有气泡,滴定结束后气泡消失,则会使测定结果___________ (填“偏高”或“偏低”或“不变”)。经过计算测出蓝月亮牌“84”消毒液中NaClO的物质的量浓度为___________ mol/L(精确到小数点后1位)
Ⅰ.氯碱工业是工业上制备氯气的主要方法,该实验小组采用如下图所示的装置来模拟工业制取氯气。回答下列问题:

(1)氯气的逸出口是
(2)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
Ⅱ.“84”消毒液是生活中常见的高效杀毒剂,其主要成分为NaClO。某校学生为了测定蓝月亮牌“84”消毒液中NaClO的浓度,进行了如下实验:
①取10.00mL“84”消毒液于烧杯中,加水稀释并恢复至室温后,转移到1000mL容量瓶中定容后备用。
②取20.00mL稀释后的溶液于锥形瓶中,滴加稀H2SO4和过量的KI溶液,NaClO将KI氧化成I2。
③用淀粉做指示剂,生成的I2用0.0800 mol/L Na2S2O3标准溶液滴定至终点,发生的反应为:I2 + 2S2O
 =2I-+S4O
=2I-+S4O 。
。④重复滴定3次。
所得数据如下:
| 待测液体积(mL) | 标准液滴定前读数(mL) | 标准液滴定后读数(mL) | 消耗标准液体积(mL) | |
| 1 | 20.00 | 0.02 | 20.02 | |
| 2 | 20.00 | 0.24 | 20.26 | |
| 3 | 20.00 | 0.12 | 20.10 | |
| 4 | 20.00 | 0.20 | 21.20 |
(3)步骤①定容时还需要的玻璃仪器是
(4)步骤②发生反应的离子方程式为
(5)步骤③滴定终点的现象为
(6)若滴定前标准液滴定管尖嘴管处有气泡,滴定结束后气泡消失,则会使测定结果
更新时间:2021-01-04 13:26:34
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】我国力争实现2030年前“碳达峰”、2060年前“碳中和”的目标,二氧化碳的捕捉与封存是目标实现的重要途径。回答下列问题:
I.常温下,某同学用 溶液捕捉一定体积空气中的
溶液捕捉一定体积空气中的 。为测定所得溶液的成分,该同学向其中逐滴加入
。为测定所得溶液的成分,该同学向其中逐滴加入 的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑
的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑 在水中的溶解)。
在水中的溶解)。
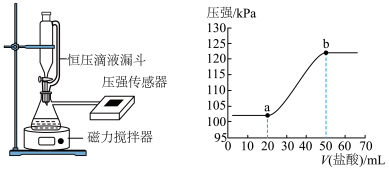
(1) 段反应的离子方程式为
段反应的离子方程式为___________ 。
(2)所得溶液的溶质成分为___________ (填化学式), 溶液的浓度为
溶液的浓度为___________  。
。
Ⅱ. 蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的
蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的 通过两步法可制取
通过两步法可制取 ,原理如图2所示。
,原理如图2所示。
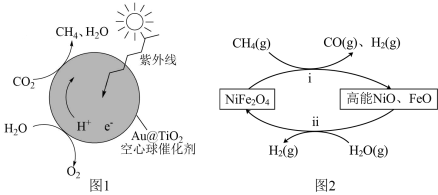
(3)图1中 为
为___________ (填“氧化剂”“还原剂”或“既是氧化剂又是还原剂”),空心球催化过程的总反应方程式为___________ 。
(4)图2第i步反应转移 时,该步反应生成
时,该步反应生成 的物质的量为
的物质的量为___________  ,若不考虑过程中原料损失,则
,若不考虑过程中原料损失,则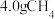 通过两步法最多可制得
通过两步法最多可制得 的物质的量为
的物质的量为___________  。
。
I.常温下,某同学用
 溶液捕捉一定体积空气中的
溶液捕捉一定体积空气中的 。为测定所得溶液的成分,该同学向其中逐滴加入
。为测定所得溶液的成分,该同学向其中逐滴加入 的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑
的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑 在水中的溶解)。
在水中的溶解)。
(1)
 段反应的离子方程式为
段反应的离子方程式为(2)所得溶液的溶质成分为
 溶液的浓度为
溶液的浓度为 。
。Ⅱ.
 蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的
蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的 通过两步法可制取
通过两步法可制取 ,原理如图2所示。
,原理如图2所示。
(3)图1中
 为
为(4)图2第i步反应转移
 时,该步反应生成
时,该步反应生成 的物质的量为
的物质的量为 ,若不考虑过程中原料损失,则
,若不考虑过程中原料损失,则 通过两步法最多可制得
通过两步法最多可制得 的物质的量为
的物质的量为 。
。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】.氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A 和B。A 为铵盐,B 在标准状况下为气态。在此反应中,若每有1体积氨气参加反应,同时有0.75 体积氟气参加反应;若每有8.96L 氨气(标准状况)参加反应,同时生成0.3 mol A。
(1) 写出氨气和氟气反应的化学方程式___________ 。
(2) 在标准状况下,每生成2.24LB,转移电子的物质的量为______ mol。
Ⅱ.某固体可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现取该固体进行如下实验,所得现象和有关数据如下所示(气体体积的数据均已折算成标准状况下):
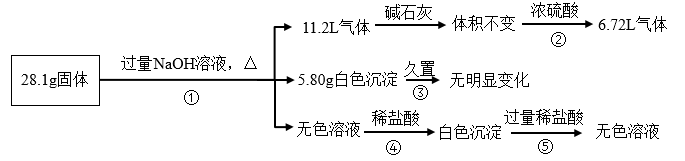
请回答下列问题:
(3)混合物中存在的物质有________ (填化学式)。
(4)依照反应顺序写出步骤④的离子方程式:_________ ,___________ 。
(1) 写出氨气和氟气反应的化学方程式
(2) 在标准状况下,每生成2.24LB,转移电子的物质的量为
Ⅱ.某固体可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现取该固体进行如下实验,所得现象和有关数据如下所示(气体体积的数据均已折算成标准状况下):

请回答下列问题:
(3)混合物中存在的物质有
(4)依照反应顺序写出步骤④的离子方程式:
您最近一年使用:0次
【推荐3】氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式____________________ 。
②直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=______________ (用n表示)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
____  +
+____ Ag++_________ =____  +
+____ Ag+__________
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:
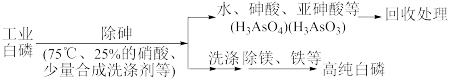
①除砷过程在75℃下进行,其合理的原因是_______ (填字母)。
a.使白磷熔化,并溶于水 b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解 d.适当提高温度,加快化学反应速率
②硝酸氧化除砷时被还原为NO,氧化相同质量的砷,当转化为亚砷酸的量越多,消耗硝酸的量越__________ (填“多”或“少”)。
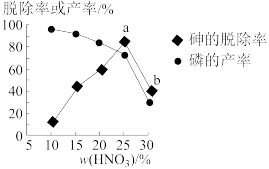
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如右图,砷的脱除率从a点到b点降低的原因是_________________ 。
(4)查阅资料可知:银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)
 (aq),该反应平衡常数的表达式K稳[Ag(NH3)2+]=
(aq),该反应平衡常数的表达式K稳[Ag(NH3)2+]=________ ,已知某温度下,K稳[ ]=1.10×107,Ksp[AgCl]=1.45×10﹣10。计算得到可逆反应AgCl(s)+2NH3(aq)
]=1.10×107,Ksp[AgCl]=1.45×10﹣10。计算得到可逆反应AgCl(s)+2NH3(aq)
 (aq)+Cl-(aq)的化学平衡常数K=
(aq)+Cl-(aq)的化学平衡常数K=________ (保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl________ mol(保留1位有效数字)。
(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式
②直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
 +
+ +
+(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:


①除砷过程在75℃下进行,其合理的原因是
a.使白磷熔化,并溶于水 b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解 d.适当提高温度,加快化学反应速率
②硝酸氧化除砷时被还原为NO,氧化相同质量的砷,当转化为亚砷酸的量越多,消耗硝酸的量越
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如右图,砷的脱除率从a点到b点降低的原因是
(4)查阅资料可知:银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)

 (aq),该反应平衡常数的表达式K稳[Ag(NH3)2+]=
(aq),该反应平衡常数的表达式K稳[Ag(NH3)2+]= ]=1.10×107,Ksp[AgCl]=1.45×10﹣10。计算得到可逆反应AgCl(s)+2NH3(aq)
]=1.10×107,Ksp[AgCl]=1.45×10﹣10。计算得到可逆反应AgCl(s)+2NH3(aq)
 (aq)+Cl-(aq)的化学平衡常数K=
(aq)+Cl-(aq)的化学平衡常数K=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某同学用邻苯二甲酸氢钾溶液来滴定NaOH溶液有下列操作:
①向溶液中加入1~2滴指示剂
②取20.00mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是_______ ,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是_______ ,选用指示剂是_______ 。
(2)滴定,并记录NaOH的终读数。重复滴定几次,数据记录如下表:
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=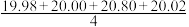 mL=20.20 mL,他的计算合理吗?理由是
mL=20.20 mL,他的计算合理吗?理由是_______ 。
(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作_______ ;滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果_______ (填“偏大”、“偏小”或“无影响”)。
①向溶液中加入1~2滴指示剂
②取20.00mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是
(2)滴定,并记录NaOH的终读数。重复滴定几次,数据记录如下表:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
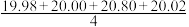 mL=20.20 mL,他的计算合理吗?理由是
mL=20.20 mL,他的计算合理吗?理由是(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某化学兴趣小组用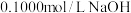 标准溶液滴定食用白醋,测定白醋中醋酸(
标准溶液滴定食用白醋,测定白醋中醋酸( )的含量(
)的含量(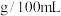 ),并判断白醋的等级。已知:
),并判断白醋的等级。已知:
(1)取100mL白醋样品溶于水,加水稀释配成1000mL溶液。准确量取25.00mL所配白醋溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂。下列仪器可用于准确量取白醋溶液的是___________。
(2)滴定管在使用之前应进行的操作是___________ ,洗涤,润洗。滴定管盛装好NaOH溶液后排气泡,下列排气泡操作正确的是___________ 。
a.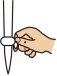 b.
b.  c.
c. d.
d.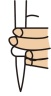
(3)若用50mL的滴定管进行实验,当滴定管中的凹液面最低处在刻度“15”处时,则管内液体的体积___________(填标号)。
(4)判断达到滴定终点的方法是___________ 。
(5)某同学一共进行了三次实验,实验数据如下:
数据处理:消耗标准NaOH溶液的体积
___________ mL。通过计算可知该白醋中醋酸的含量为___________ 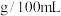 (保留两位有效数字),该白醋的级别为
(保留两位有效数字),该白醋的级别为___________ 。
(6)下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是___________。
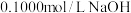 标准溶液滴定食用白醋,测定白醋中醋酸(
标准溶液滴定食用白醋,测定白醋中醋酸( )的含量(
)的含量(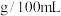 ),并判断白醋的等级。已知:
),并判断白醋的等级。已知:| 级别 | 优质醋 | 一级醋 | 二级醋 |
醋酸含量(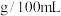 ) ) | 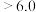 | 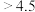 | 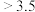 |
(1)取100mL白醋样品溶于水,加水稀释配成1000mL溶液。准确量取25.00mL所配白醋溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂。下列仪器可用于准确量取白醋溶液的是___________。
| A.酸式滴定管 | B.碱式滴定管 | C.量筒 | D.容量瓶 |
(2)滴定管在使用之前应进行的操作是
a.
 b.
b.  c.
c. d.
d.
(3)若用50mL的滴定管进行实验,当滴定管中的凹液面最低处在刻度“15”处时,则管内液体的体积___________(填标号)。
A.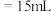 | B.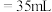 | C.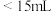 | D.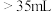 |
(4)判断达到滴定终点的方法是
(5)某同学一共进行了三次实验,实验数据如下:
| 实验次数 | 量取稀释后白醋体积(mL) | 消耗标准NaOH溶液体积(mL) |
| 1 | 25.00 | 17.95 |
| 2 | 25.00 | 18.95 |
| 3 | 25.00 | 18.05 |

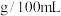 (保留两位有效数字),该白醋的级别为
(保留两位有效数字),该白醋的级别为(6)下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是___________。
| A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液 |
| B.滴定过程中振荡时有液滴溅出 |
| C.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某学生用0.100 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度“0”以上2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
回答下列问题:
(1)正确操作步骤的顺序是(用字母序号填写)_________ 。
(2)排去碱式滴定管中气泡的方法应采用下图操作中的________ (填标号),然后轻轻挤压玻璃球使尖嘴部分充满碱液。
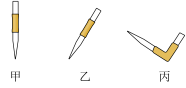
(3)滴定过程中,眼睛应注视______________ 。
(4)判断到达滴定终点的实验现象是__________________ 。
(5)数据记录如下:
根据上述数据,可计算出该盐酸的浓度约为_____________ (保留小数点后两位数)。
(6)在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有_____ (填字母)。
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.碱式滴定管尖嘴部分有气泡,滴定后消失
D.滴定终点读数时俯视读数
E.滴定终点读数时仰视读数
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度“0”以上2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
回答下列问题:
(1)正确操作步骤的顺序是(用字母序号填写)
(2)排去碱式滴定管中气泡的方法应采用下图操作中的
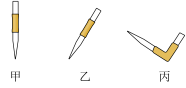
(3)滴定过程中,眼睛应注视
(4)判断到达滴定终点的实验现象是
(5)数据记录如下:
| 滴定次数 | 待测盐酸的体积/mL | 标准NaOH溶液体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |
(6)在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.碱式滴定管尖嘴部分有气泡,滴定后消失
D.滴定终点读数时俯视读数
E.滴定终点读数时仰视读数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】二氧化氯(ClO2)是一种高效、安全的消毒剂,常温下是一种黄绿色气体,11℃时液化成红棕色液体,易溶于水但不与水反应。工业上著名的开斯汀法制备二氧化氯的部分流程图如图1。某研究小组用图2装置模拟ClO2发生器中的反应来制备ClO2(夹持装置已略去)

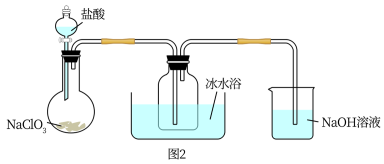
(1)写出NaClO3与盐酸反应的化学方程式_______ 。
(2)冰水浴的作用是_______ 。
(3)NaOH溶液中发生的主要反应的离子方程式为_______ 。
(4)将ClO2通入到KI溶液中,再向其中加入适量CCl4,振荡、静置,观察到_______ ,证明ClO2具有氧化性。
(5)ClO2常用作自来水消毒剂,碘量法可以检测水中ClO2的浓度,步骤如下:
①取1L水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝(已知ClO2全部转化为NaClO2);
②用1×10-3mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液10.00mL(已知:2S2O +I2=S4O
+I2=S4O +2I-);确定操作②达到滴定终点的现象是
+2I-);确定操作②达到滴定终点的现象是_______ ;经计算,水样中ClO2的浓度是_______ mg·L-1。
(6)一定温度和电压下,电解精制食盐水可制得NaClO3和H2.已知3Cl2+6OH-=ClO +5Cl-+3H2O,电解时应选用
+5Cl-+3H2O,电解时应选用_______ 交换膜(填“阳离子”或“阴离子”),阴极电极反应式为_______ 。


(1)写出NaClO3与盐酸反应的化学方程式
(2)冰水浴的作用是
(3)NaOH溶液中发生的主要反应的离子方程式为
(4)将ClO2通入到KI溶液中,再向其中加入适量CCl4,振荡、静置,观察到
(5)ClO2常用作自来水消毒剂,碘量法可以检测水中ClO2的浓度,步骤如下:
①取1L水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝(已知ClO2全部转化为NaClO2);
②用1×10-3mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液10.00mL(已知:2S2O
 +I2=S4O
+I2=S4O +2I-);确定操作②达到滴定终点的现象是
+2I-);确定操作②达到滴定终点的现象是(6)一定温度和电压下,电解精制食盐水可制得NaClO3和H2.已知3Cl2+6OH-=ClO
 +5Cl-+3H2O,电解时应选用
+5Cl-+3H2O,电解时应选用
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】氯碱工业是以电解饱和食盐水为基础的基本化学工业。如图是某氯碱工业生产原理示意图:
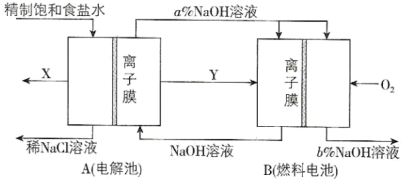
(1)写出装置A在通电条件下反应的化学方程式:___ 。
(2)装置A所用食盐水由粗盐水精制而成。精制时,为除去粗盐水中的Mg2+和Ca2+,要加入的试剂分别为___ 、___ 。
(3)氯碱工业是高耗能产业,将电解池与燃料电池相组合的新工艺可以节能30%以上,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中Y是___ (填化学式);X与稀NaOH溶液反应的离子方程式为___ 。
②比较图示中氢氧化钠的质量分数a%与b%的大小:___ 。
③若用装置B作为装置A的辅助电源,每当消耗标准状况下11.2L氧气时,则装置B可向装置A提供的电量约为___ (一个e-的电量为1.60×10-19C;计算结果精确到0.01)。

(1)写出装置A在通电条件下反应的化学方程式:
(2)装置A所用食盐水由粗盐水精制而成。精制时,为除去粗盐水中的Mg2+和Ca2+,要加入的试剂分别为
(3)氯碱工业是高耗能产业,将电解池与燃料电池相组合的新工艺可以节能30%以上,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中Y是
②比较图示中氢氧化钠的质量分数a%与b%的大小:
③若用装置B作为装置A的辅助电源,每当消耗标准状况下11.2L氧气时,则装置B可向装置A提供的电量约为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
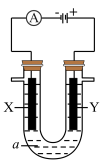
【推荐3】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,在 X极附近观察到的现象是:________________ 。
(2)Y电极上的电极反应式是_________ ,检验该电极反应产物的方法是:______________ 。
(3)如果用电解方法精炼粗铜(粗铜中含有杂质锌和银),电解液a选用CuSO4溶液,则Y 电极的材料是____ ,电极反应式是_________________ 。
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,在 X极附近观察到的现象是:
(2)Y电极上的电极反应式是
(3)如果用电解方法精炼粗铜(粗铜中含有杂质锌和银),电解液a选用CuSO4溶液,则Y 电极的材料是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
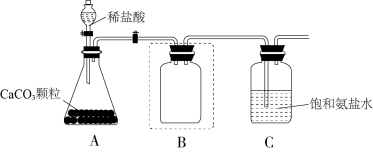
【推荐1】某兴趣小组模拟侯氏制碱法的实验流程如下:

(1)二氧化碳通入饱和氨盐水的装置如图所示。
①图 A装置制备二氧化碳气体,该装置主要玻璃仪器名称是_______ 。
②用图B装置对二氧化碳气体进行净化,在图中方框内补齐净化装置和净化试剂_______ 。
(2)母液中加入NaCl固体并通入NH3,在_______ (填温度范围)下析出NH4Cl。
(3)验证产品纯碱中是否含有杂质NaCl的方法:取少量试样溶于水后,_______ 。
(4)由实验流程分析可知,可以循环利用的物质是_______ (用化学式表示)。
(5)称取制得的NaHCO3(杂质NaCl)5.20 g,配制成100 mL溶液,取出20 mL用0.6000 mol/L标准盐酸滴定(甲基橙做指示剂),消耗盐酸溶液体积为20.20 mL。
①滴定终点颜色变化_______ 。
②制得的NaHCO3纯度ω (NaHCO3)=_______ 。
③若滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测定的NaHCO3含量_______ (填“偏高”、“偏低”或“无影响”)。

(1)二氧化碳通入饱和氨盐水的装置如图所示。
①图 A装置制备二氧化碳气体,该装置主要玻璃仪器名称是
②用图B装置对二氧化碳气体进行净化,在图中方框内补齐净化装置和净化试剂

(2)母液中加入NaCl固体并通入NH3,在
| 温度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl溶解度(g/100g水) | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| NH4Cl溶解度(g/100g水) | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |
(4)由实验流程分析可知,可以循环利用的物质是
(5)称取制得的NaHCO3(杂质NaCl)5.20 g,配制成100 mL溶液,取出20 mL用0.6000 mol/L标准盐酸滴定(甲基橙做指示剂),消耗盐酸溶液体积为20.20 mL。
①滴定终点颜色变化
②制得的NaHCO3纯度ω (NaHCO3)=
③若滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测定的NaHCO3含量
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】“侯氏制碱法”是我国化工专家侯德榜为世界制碱工业做出的突出贡献。模拟“侯氏制碱法”以粗盐水为原料制备纯碱的流程以及各物质的溶解度变化趋势如图所示。
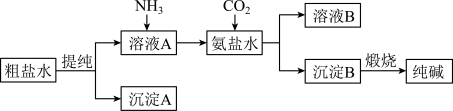
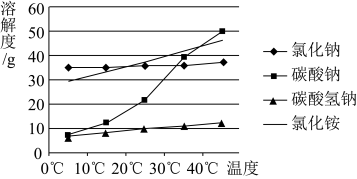
(1)以NaCl为原料还可用于生产NaOH和Cl2,该工业生产称为_______ 。
(2)溶液A中先通入NH3再通CO2的原因是_______ 。
(3)在饱和食盐水中通入氨气和二氧化碳发生反应:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl,请解释NaHCO3析出的原因:_______ 。
(4)溶液 中主要溶质的电子式为
中主要溶质的电子式为_______ 。
(5)写出煅烧沉淀B生成纯碱时发生反应的化学方程式:_______ 。


(1)以NaCl为原料还可用于生产NaOH和Cl2,该工业生产称为
(2)溶液A中先通入NH3再通CO2的原因是
(3)在饱和食盐水中通入氨气和二氧化碳发生反应:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl,请解释NaHCO3析出的原因:
(4)溶液
 中主要溶质的电子式为
中主要溶质的电子式为(5)写出煅烧沉淀B生成纯碱时发生反应的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下
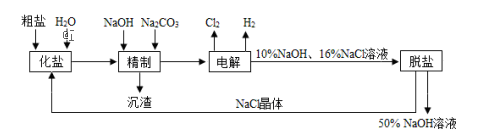
(1)粗盐中含CaCl2、MgCl2等杂质,写出精制过程中发生反应的离子方程式是________ ,________ .
(2)如果粗盐中SO42﹣含量较高,必须添加钡式剂除去SO42﹣ ,该钡试剂可以是____
A. Ba(OH)2 B. Ba(NO3)2 C. BaCl2
(3)电解过程中所发生反应的化学方程式为________ ,与电源正极相连的电极附近产生的气体是________ ,检验该气体可使用的试纸及现象是.
(4)氯碱工厂生产的氯气和氢气可以进一步用于生产盐酸,主要过程如下:
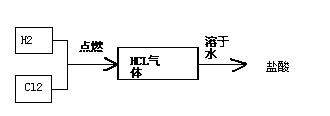
其中关键的一步为氯气和氢气在燃烧管口燃烧生成HCl,氯气有毒,应采取的措施是________ .合成盐酸厂要求合成气中的HCl的含量要大于97%,试用最简便的方法进行分析是否含量大于97%________ .
(5)氯碱工厂生产的氯气和氢氧化钠溶液可以用于制取“84消毒液”,反应的化学方程式为________ .
(6)某同学欲证明盐酸与氯化氢气体性质不同,他分别向A、B、C三支洁净试管中各放入一片干燥的蓝色石蕊试纸,然后往A试管内加入盐酸,试纸显________ 色,往B试管中通入干燥的氯化氢气体,试纸显________ 色.最后向C试管中加入物质________ (填化学式),他之所以加入这种物质的理由是________ .

(1)粗盐中含CaCl2、MgCl2等杂质,写出精制过程中发生反应的离子方程式是
(2)如果粗盐中SO42﹣含量较高,必须添加钡式剂除去SO42﹣ ,该钡试剂可以是
A. Ba(OH)2 B. Ba(NO3)2 C. BaCl2
(3)电解过程中所发生反应的化学方程式为
(4)氯碱工厂生产的氯气和氢气可以进一步用于生产盐酸,主要过程如下:

其中关键的一步为氯气和氢气在燃烧管口燃烧生成HCl,氯气有毒,应采取的措施是
(5)氯碱工厂生产的氯气和氢氧化钠溶液可以用于制取“84消毒液”,反应的化学方程式为
(6)某同学欲证明盐酸与氯化氢气体性质不同,他分别向A、B、C三支洁净试管中各放入一片干燥的蓝色石蕊试纸,然后往A试管内加入盐酸,试纸显
您最近一年使用:0次



