(1)S单质的常见形式为 ,其环状结构如图所示,S原子采用的轨道杂化方式是
,其环状结构如图所示,S原子采用的轨道杂化方式是_______ 。
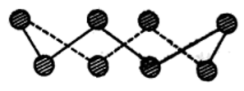
(2)现有H、N、O、S、Cu几种元素,回答下列问题。
①氢元素和N、O、S、Cu形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为_______ ;分子中既含有极性共价键又含有非极性共价键的化合物是_______ (填化学式,写出两种)。
②这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是_______ (填化学式,下同);酸根呈三角锥形的酸是_______ 。
 ,其环状结构如图所示,S原子采用的轨道杂化方式是
,其环状结构如图所示,S原子采用的轨道杂化方式是
(2)现有H、N、O、S、Cu几种元素,回答下列问题。
①氢元素和N、O、S、Cu形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为
②这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是
更新时间:2021-02-16 14:00:21
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】砷化镓(GaAs)是优良的半导体材料或用于制作微型激光器或太阳能电池的材料等。部分元素在周期表中位置如下:
回答下列问题:
(1)六种元素中,非金属性最强的元素是:________ .写出As原子的最外层的电子排布式_________ ,As原子核外有_____ 个未成对电子。
(2)根据元素周期律,可判断原子半径Ga_____ As。(选填“>”、 “<”或“=”)。写出铝的最高价氧化物对应水化物的电离方程式:________________
(3)NH3 的分子构型是_______ 。GaF3的熔点高于1000°C,GaCl3的熔点为77.9°C,可能的原因是_______ .写出C2H2的电子式为:_________
(4)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因___________
| A1 | Si | P |
| Ga | Ge | As |
回答下列问题:
(1)六种元素中,非金属性最强的元素是:
(2)根据元素周期律,可判断原子半径Ga
(3)NH3 的分子构型是
(4)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/°C | -49.5 | 26 | 146 |
| 沸点/°C | 83.1 | 186 | 约400 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】硫代硫酸盐是一类具有应用前景的浸金试剂。硫代碳酸根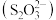 可看作是
可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。
(1)基态S原子价层电子排布式是_______ 。
(2)比较S原子和O原子的第一电离能大小,从原子结构的角度说明理由:_______ 。
(3) 的空间结构是
的空间结构是_______ 。
(4)浸金时, 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成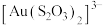 。分别判断
。分别判断 中的中心S原子和端基S原子能否做配位原子并说明理由:
中的中心S原子和端基S原子能否做配位原子并说明理由:_______ 。
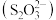 可看作是
可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。(1)基态S原子价层电子排布式是
(2)比较S原子和O原子的第一电离能大小,从原子结构的角度说明理由:
(3)
 的空间结构是
的空间结构是(4)浸金时,
 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成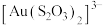 。分别判断
。分别判断 中的中心S原子和端基S原子能否做配位原子并说明理由:
中的中心S原子和端基S原子能否做配位原子并说明理由:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】二氧化硫分子(SO2)分子中共有__ 个σ键,其中心原子(硫原子)的孤电子对数为__ ;价层电子对数为__ ,该分子的VSEPR模型为__ ;则该分子呈__ 形,二氧化硫分子的中心原子的杂化类型为__ 。
您最近一年使用:0次
填空题
|
适中
(0.65)
真题
【推荐2】金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是_____ .
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是____ .
(3)过滤金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=___ .CO与N2结构相似,CO分子内σ键与π键个数之比为______ .
(4)甲醛(H2C═O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为_____ ,甲醇分子内的O﹣C﹣H键角____ (填“大于”“等于”或“小于”)甲醛分子内的O﹣C﹣H键角.
(1)下列关于金属及金属键的说法正确的是
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是
(3)过滤金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=
(4)甲醛(H2C═O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】 是生命之源,由
是生命之源,由 分子形成的物质种类繁多。
分子形成的物质种类繁多。
(1) 分子内
分子内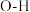 键、分子间的范德华力和氢键从强到弱依次为
键、分子间的范德华力和氢键从强到弱依次为_______ 。
(2) 可与
可与 形成
形成 ,
, 是三角锥空间构型。
是三角锥空间构型。 中O原子采用的杂化方式为
中O原子采用的杂化方式为_______ 。
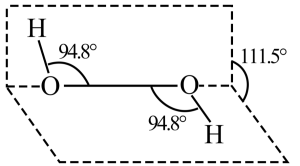
(3) 是一种无色液体,其结构如图所示。根据“相似相溶规则”
是一种无色液体,其结构如图所示。根据“相似相溶规则”  在水中的溶解度
在水中的溶解度_______ (填“大于”、“小于”、“等于”)其在 中的溶解度。
中的溶解度。
(4)在 的水溶液中,一定条件下存在组成为
的水溶液中,一定条件下存在组成为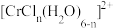 (n为正整数)的配离子。则
(n为正整数)的配离子。则
①
_______ 。
②在该配离子中,提供空轨道的元素是_______ ,提供孤电子对的是_______ 。
A. B.H C.O D.Cr
B.H C.O D.Cr
 是生命之源,由
是生命之源,由 分子形成的物质种类繁多。
分子形成的物质种类繁多。(1)
 分子内
分子内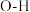 键、分子间的范德华力和氢键从强到弱依次为
键、分子间的范德华力和氢键从强到弱依次为(2)
 可与
可与 形成
形成 ,
, 是三角锥空间构型。
是三角锥空间构型。 中O原子采用的杂化方式为
中O原子采用的杂化方式为(3)
 是一种无色液体,其结构如图所示。根据“相似相溶规则”
是一种无色液体,其结构如图所示。根据“相似相溶规则”  在水中的溶解度
在水中的溶解度 中的溶解度。
中的溶解度。
(4)在
 的水溶液中,一定条件下存在组成为
的水溶液中,一定条件下存在组成为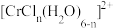 (n为正整数)的配离子。则
(n为正整数)的配离子。则①

②在该配离子中,提供空轨道的元素是
A.
 B.H C.O D.Cr
B.H C.O D.Cr
您最近一年使用:0次



