碘化钠可用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等,实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。已知:水合肼易被空气氧化。回答下列问题:
(1)水合肼的制备
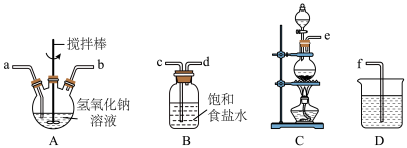
①制取次氯酸钠和氢氧化钠的混合液。盛装氢氧化钠溶液的仪器名称是__ ,正确的连接顺序为__ (按气流方向,用小写字母表示)。__ [填“NaClO”或“CO(NH2)2”]。
(2)碘化钠的制备
I.向锥形瓶中加入40mL6mol·L-1NaOH溶液,搅拌、冷却,加入25.4g单质碘,打开恒温磁力搅拌器,保持60~70℃至反应完全;
II.继续加入稍过量的N2H4·H2O,还原生成的NaIO和NaIO3,得到NaI溶液,同时释放出一种空气中主要成分的气体;
III.将溶液蒸发浓缩、冷却结晶过滤、洗涤、干燥,得产品25.5g。
①步骤I反应完全的现象是__ 。
②步骤II中IO-参与反应的离子方程式为__ 。
③实验发现,水合肼实际用量比理论值偏高,可能的原因是__ 。
④测定产品中NaI含量的实验步骤如下:
a.称取10.00g产品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量FeCl3溶液,充分反应后,再加入M溶液作指示剂;
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(化学方程式为2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次.测得平均消耗Na2S2O3标准溶液的体积为15.00mL。则M为__ (写名称);该产品中NI的质量分数为__ 。
⑤工业上也可用硫化钠或铁屑还原碘酸钠来制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因__ 。
(1)水合肼的制备
①制取次氯酸钠和氢氧化钠的混合液。盛装氢氧化钠溶液的仪器名称是
(2)碘化钠的制备
I.向锥形瓶中加入40mL6mol·L-1NaOH溶液,搅拌、冷却,加入25.4g单质碘,打开恒温磁力搅拌器,保持60~70℃至反应完全;
II.继续加入稍过量的N2H4·H2O,还原生成的NaIO和NaIO3,得到NaI溶液,同时释放出一种空气中主要成分的气体;
III.将溶液蒸发浓缩、冷却结晶过滤、洗涤、干燥,得产品25.5g。
①步骤I反应完全的现象是
②步骤II中IO-参与反应的离子方程式为
③实验发现,水合肼实际用量比理论值偏高,可能的原因是
④测定产品中NaI含量的实验步骤如下:
a.称取10.00g产品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量FeCl3溶液,充分反应后,再加入M溶液作指示剂;
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(化学方程式为2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次.测得平均消耗Na2S2O3标准溶液的体积为15.00mL。则M为
⑤工业上也可用硫化钠或铁屑还原碘酸钠来制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因
21-22高三上·甘肃白银·期末 查看更多[2]
更新时间:2021-02-15 20:57:33
|
相似题推荐
解答题-工业流程题
|
容易
(0.94)
【推荐1】为了从海带中制取碘,某学习小组将海带灼烧后,加水溶解配成海带浸取原液(浸取原液中的碘元素主要以I-形式存在),并设计了如下甲、乙两种实验方案:
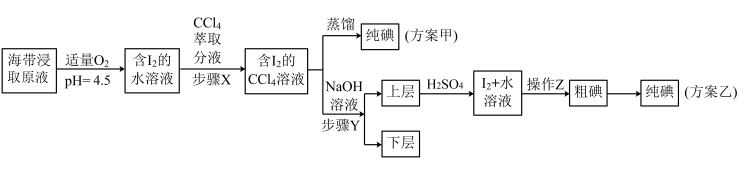
已知:①步骤Y中加NaOH时发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O;
②碘单质常温为紫黑色固体,在通常状况下,100g水中约溶解0.02g碘单质。
请回答:
(1)灼烧海带应该在___________ (填仪器名称)中进行。
(2)分液漏斗使用前须先___________ ;步骤X中,萃取后分液漏斗内观察到的现象是___________ 。
(3)步骤Y中需要控制加入的NaOH溶液的量不宜过多,原因是___________ 。
(4)操作Z的名称是___________ 。
(5)方案甲中采用蒸馏不合理,理由是___________ 。

已知:①步骤Y中加NaOH时发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O;
②碘单质常温为紫黑色固体,在通常状况下,100g水中约溶解0.02g碘单质。
请回答:
(1)灼烧海带应该在
(2)分液漏斗使用前须先
(3)步骤Y中需要控制加入的NaOH溶液的量不宜过多,原因是
(4)操作Z的名称是
(5)方案甲中采用蒸馏不合理,理由是
您最近一年使用:0次
解答题-实验探究题
|
容易
(0.94)
名校
解题方法
【推荐1】一种制备氢氧化铜产品的生产流程如图所示,CuSO4和NaOH恰好完全反应的比例加料。

请回答下列问题:
(1)写出步骤c中发生反应的离子方程式:___ 。
(2)为保证步骤c中的两种溶液恰好完全反应,x=___ 。
(3)在反应池中进行步骤c,历时10min,得到的产品质量是___ g。
(4)欲用硫酸铜晶体(CuSO4•5H2O)配制0.1mol•L-1的CuSO4溶液480mL,需要___ g晶体,应选用的玻璃仪器除量筒、烧杯和玻璃棒外,还有___ 。
(5)下列操作会使所配硫酸铜溶液的物质的量浓度偏低的是___ (填字母序号)。
a.用托盘天平称量时,物体和砝码放反了,且使用了游码
b.容量瓶中有少量水
c.定容摇匀时,液面下降又加水
d.定容时俯视刻度线

请回答下列问题:
(1)写出步骤c中发生反应的离子方程式:
(2)为保证步骤c中的两种溶液恰好完全反应,x=
(3)在反应池中进行步骤c,历时10min,得到的产品质量是
(4)欲用硫酸铜晶体(CuSO4•5H2O)配制0.1mol•L-1的CuSO4溶液480mL,需要
(5)下列操作会使所配硫酸铜溶液的物质的量浓度偏低的是
a.用托盘天平称量时,物体和砝码放反了,且使用了游码
b.容量瓶中有少量水
c.定容摇匀时,液面下降又加水
d.定容时俯视刻度线
您最近一年使用:0次
【推荐2】磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂。
(1)磷元素在元素周期表中的位置:_____ 。AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为_____ 。
(2)工业制备PH3的流程如图所示。

①次磷酸属于_____ 元酸。
②次磷酸分解反应Ⅲ的化学方程式为:_____ 。
③若起始时有1molP4参加反应,则整个工业流程中共生成_____ molPH3。(不考虑产物的损失)
(1)磷元素在元素周期表中的位置:
(2)工业制备PH3的流程如图所示。

①次磷酸属于
②次磷酸分解反应Ⅲ的化学方程式为:
③若起始时有1molP4参加反应,则整个工业流程中共生成
您最近一年使用:0次
解答题-工业流程题
|
容易
(0.94)
名校
解题方法
【推荐3】肼(N2H4)是氮和氢形成的一种化合物,易溶于水。工业上利用尿素法生产肼,同时得到副产品十水合碳酸钠,其工艺流程如图:
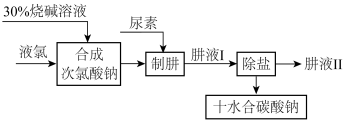
制肼过程的反应为:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O
(1)实验室若配制30%烧碱溶液,所需的玻璃仪器除玻璃棒外,还有______ (填标号)。
A.漏斗 B.烧杯 C.烧瓶 D.量筒
(2)已知:Cl2+H2O=HCl+HClO,请推测C12与NaOH溶液发生反应的化学方程式:____ 。从后续反应过程来看,若要使原料不浪费,合成次氯酸钠时投入的液氯与烧碱的质量之比为71:_________ 。
(3)实验室中,欲从母液中分离出十水合碳酸钠晶体。可采用的操作依次为________ 。(填标号)
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
(4)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等。请写出肼除氧时发生反应的化学方程式:______________ 。

制肼过程的反应为:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O
(1)实验室若配制30%烧碱溶液,所需的玻璃仪器除玻璃棒外,还有
A.漏斗 B.烧杯 C.烧瓶 D.量筒
(2)已知:Cl2+H2O=HCl+HClO,请推测C12与NaOH溶液发生反应的化学方程式:
(3)实验室中,欲从母液中分离出十水合碳酸钠晶体。可采用的操作依次为
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
(4)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等。请写出肼除氧时发生反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
容易
(0.94)
名校
解题方法
【推荐1】请回答与HCl的制法和性质探究的相关问题。
(1)实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体,反应的化学方程式为:_______ 。
(2)氯化氢气体的发生装置应该选择下图A、B、C中的_______ (填装置的编号)。实验室常用装置D来收集氯化氢,则收集氯化氢时,气体从_______ 管(填“a”或“b”)进入。用水吸收多余的氯化氢气体时,不能选择的装置①~⑤中的_______ (填装置的编号)。

(3)某同学欲证明盐酸与氯化氢气体性质不同,他向X、Y、Z三支洁净试管里各放一片干燥的蓝色石蕊试纸,然后向试管X中加入盐酸,试纸显_______ 色;往试管Y中通入干燥的氯化氢气体,试纸显_______ 色,这时他认为由此还不能得出满意的结论,于是向试管Z中加入化学式为_______ 的物质。
(4)写出工业合成氯化氢的化学方程式:_______ 。
(5)如图所示,为防止污染空气,在刚开始合成时,应先从_______ (填“a”或“b”)口通入_______ (填电子式)气体,并使该气体过量。
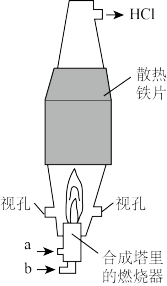
(1)实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体,反应的化学方程式为:
(2)氯化氢气体的发生装置应该选择下图A、B、C中的

(3)某同学欲证明盐酸与氯化氢气体性质不同,他向X、Y、Z三支洁净试管里各放一片干燥的蓝色石蕊试纸,然后向试管X中加入盐酸,试纸显
(4)写出工业合成氯化氢的化学方程式:
(5)如图所示,为防止污染空气,在刚开始合成时,应先从

您最近一年使用:0次
解答题-工业流程题
|
容易
(0.94)
名校
解题方法
【推荐2】肼(N2H4)是氮和氢形成的一种化合物,易溶于水。工业上利用尿素法生产肼,同时得到副产品十水合碳酸钠,其工艺流程如图:

制肼过程的反应为:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O
(1)实验室若配制30%烧碱溶液,所需的玻璃仪器除玻璃棒外,还有______ (填标号)。
A.漏斗 B.烧杯 C.烧瓶 D.量筒
(2)已知:Cl2+H2O=HCl+HClO,请推测C12与NaOH溶液发生反应的化学方程式:____ 。从后续反应过程来看,若要使原料不浪费,合成次氯酸钠时投入的液氯与烧碱的质量之比为71:_________ 。
(3)实验室中,欲从母液中分离出十水合碳酸钠晶体。可采用的操作依次为________ 。(填标号)
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
(4)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等。请写出肼除氧时发生反应的化学方程式:______________ 。

制肼过程的反应为:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O
(1)实验室若配制30%烧碱溶液,所需的玻璃仪器除玻璃棒外,还有
A.漏斗 B.烧杯 C.烧瓶 D.量筒
(2)已知:Cl2+H2O=HCl+HClO,请推测C12与NaOH溶液发生反应的化学方程式:
(3)实验室中,欲从母液中分离出十水合碳酸钠晶体。可采用的操作依次为
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
(4)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等。请写出肼除氧时发生反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
容易
(0.94)
【推荐3】实验室中用浓盐酸与MnO2制取Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉。已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高易发生副反应:
6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。现有三位同学分别设计的三套实验装置如下(U形管中放有玻璃纤维,气体能顺利通过):
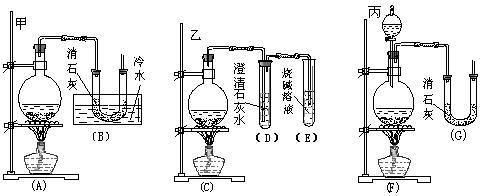
(1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内:
a.不易控制反应速率 b.容易控制反应速率 c.有副反应发生
d.可防止副反应发生 e.容易污染环境 f.可防止污染环境
(2)请从甲、乙、丙三套装置中,选取合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,连接顺序(按气流从左到右的方向)为___________ ;在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,并说明原因_________________________________________________________________________________________________________________________________________ 。
(3)如果反应前加入了mg Ca(OH)2,反应结束并冷却后倒出固体物质称量为ng(设反应中产生的水仍留在固体物质中)。则该固体物质中Ca(ClO)2的质量分数的表达式为(不必化简):__________________________________________________ 。
6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。现有三位同学分别设计的三套实验装置如下(U形管中放有玻璃纤维,气体能顺利通过):

(1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内:
a.不易控制反应速率 b.容易控制反应速率 c.有副反应发生
d.可防止副反应发生 e.容易污染环境 f.可防止污染环境
| 优点 | 缺点 | |
| 甲装置 | ||
| 乙装置 | ||
| 丙装置 |
(3)如果反应前加入了mg Ca(OH)2,反应结束并冷却后倒出固体物质称量为ng(设反应中产生的水仍留在固体物质中)。则该固体物质中Ca(ClO)2的质量分数的表达式为(不必化简):
您最近一年使用:0次



