某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体A[Coa(NH3)bClc]。回答下列问题:
已知:(1)Coa(NH3)b Clc在溶液中完全电离生成[Coa(NH3)b]c+ 和Cl-。
(2)Ksp[Co(OH)2]=1.09×10-15 Ksp[Co(OH)3]=1.6×10-44
I.A的制取:先向盛有混合物的三颈烧瓶中加入浓氨水,再加入双氧水,控制反应温度在50-60℃,充分反应后,再将反应后的混合物冷却、过滤,除去滤渣中的杂质即可得橙黄色晶体A.制备装置图如下:

(1)滴加氨水时,氨水无法正常流下,其原因可能是__________ 。
(2)采用水浴加热的优点是____________ 。
(3)如果先向溶液中加入双氧水,易生成沉淀,该沉淀为___________ (填化学式)。
II.A的提纯:提纯的主要过程如下图所示:
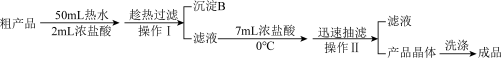
(4)趁热过滤的目的是__________ ;沉淀B中主要的物质是__________ (填名称)。
(5)有两处操作中加入浓盐酸,其目的是_______________ 。
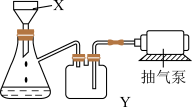
(6)下图为操作Ⅱ中用到的抽滤装置,操作时将物质放在X装置(布氏漏斗)中,打开抽气泵,最终X装置中剩余橙黄色固体,抽滤装置可以加快过滤速率,其工作原理是___________ 。抽滤结束后,向X中加入乙醇,再抽滤,选用乙醇而不用水作沉淀洗涤剂的原因是____________ 。
III.组成测定:精确称取5.350g晶体A,配成溶液后,分为两等份;向一份溶液中加入足量氢氧化钠溶液,加热,所放出的气体能与60mL 1mol/L的盐酸恰好完全反应。向另一份溶液中加入足量硝酸银溶液,生成4.305g白色沉淀;
(7)A的分子式为_________________ 。
已知:(1)Coa(NH3)b Clc在溶液中完全电离生成[Coa(NH3)b]c+ 和Cl-。
(2)Ksp[Co(OH)2]=1.09×10-15 Ksp[Co(OH)3]=1.6×10-44
I.A的制取:先向盛有混合物的三颈烧瓶中加入浓氨水,再加入双氧水,控制反应温度在50-60℃,充分反应后,再将反应后的混合物冷却、过滤,除去滤渣中的杂质即可得橙黄色晶体A.制备装置图如下:

(1)滴加氨水时,氨水无法正常流下,其原因可能是
(2)采用水浴加热的优点是
(3)如果先向溶液中加入双氧水,易生成沉淀,该沉淀为
II.A的提纯:提纯的主要过程如下图所示:

(4)趁热过滤的目的是
(5)有两处操作中加入浓盐酸,其目的是
(6)下图为操作Ⅱ中用到的抽滤装置,操作时将物质放在X装置(布氏漏斗)中,打开抽气泵,最终X装置中剩余橙黄色固体,抽滤装置可以加快过滤速率,其工作原理是

III.组成测定:精确称取5.350g晶体A,配成溶液后,分为两等份;向一份溶液中加入足量氢氧化钠溶液,加热,所放出的气体能与60mL 1mol/L的盐酸恰好完全反应。向另一份溶液中加入足量硝酸银溶液,生成4.305g白色沉淀;
(7)A的分子式为
更新时间:2021-02-20 21:48:59
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
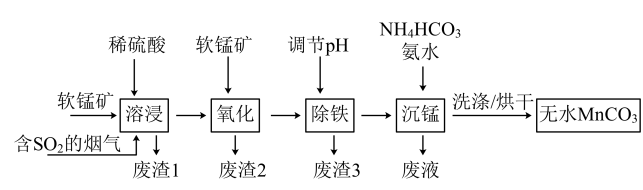
【推荐1】工业上利用软锰矿(主要成分为 ,含少量
,含少量 、FeO和
、FeO和 等杂质)和含
等杂质)和含 的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。
的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。
已知:① 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为 。
。
②不同金属离子生成氢氧化物沉淀的pH如下表:
③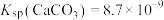 ,
,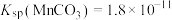 。
。
回答下列问题:
(1)下列说法正确的是___________(填序号)。
(2)调节溶液的pH前,加入软锰矿发生“氧化”作用的离子方程式是___________ 。
(3)调节pH的方法是加入适量的熟石灰,调节 ,充分反应后生成的沉淀有
,充分反应后生成的沉淀有___________ 。如果没有“氧化”过程的进行,pH就需要调节到更大的数值,这样会造成___________ 的不良后果。
(4)“沉锰”过程中加入氨水的目的是___________ (从化学平衡移动的角度解释)。“沉锰”过程宜在较低温度下进行,可能原因是___________ (写1条即可)。“沉锰”时通过控制合理的pH,就可以控制 的浓度,达到不产生
的浓度,达到不产生 的目的。原因是
的目的。原因是___________ 。
(5)工业上可用石墨为电极电解硫酸锰和稀硫酸的混合溶液制备二氧化锰,其阳极的电极反应式是___________ 。
 ,含少量
,含少量 、FeO和
、FeO和 等杂质)和含
等杂质)和含 的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。
的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。
已知:①
 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为 。
。②不同金属离子生成氢氧化物沉淀的pH如下表:
| 离子 |  |  |  |
| 开始沉淀时pH | 2.7 | 7.5 | 7.8 |
| 完全沉淀时pH | 3.7 | 9.7 | 9.8 |
③
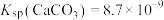 ,
,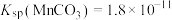 。
。回答下列问题:
(1)下列说法正确的是___________(填序号)。
| A.最好使用粉状软锰矿进行“溶浸” | B.废渣1的主要成分和“芯片”相同 |
| C.溶浸时不会发生氧化还原反应 | D.废液经处理可用于灌溉农作物 |
(3)调节pH的方法是加入适量的熟石灰,调节
 ,充分反应后生成的沉淀有
,充分反应后生成的沉淀有(4)“沉锰”过程中加入氨水的目的是
 的浓度,达到不产生
的浓度,达到不产生 的目的。原因是
的目的。原因是(5)工业上可用石墨为电极电解硫酸锰和稀硫酸的混合溶液制备二氧化锰,其阳极的电极反应式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】三氧化二镍( )是一种重要的电子元件材料、蓄电池材料。工业上以金属镍废料生产
)是一种重要的电子元件材料、蓄电池材料。工业上以金属镍废料生产 的工艺流程如图:
的工艺流程如图:

已知:①“酸浸”后的酸性溶液中含有 、
、 、
、 、
、 等离子;
等离子;
②表中为金属离子生成氢氧化物沉淀的pH(设开始沉淀时金属离子浓度均为 ):
):
(1)为提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有_______ (写两点即可)。
(2)加入足量 的作用是
的作用是_______ ,有关反应的离子方程式为_______
(3)在“沉镍”前,需加 控制溶液pH的范围为
控制溶液pH的范围为_______ ,滤渣A主要是_______ 。
(4)氧化生成 的离子方程式为
的离子方程式为_______ 。
 )是一种重要的电子元件材料、蓄电池材料。工业上以金属镍废料生产
)是一种重要的电子元件材料、蓄电池材料。工业上以金属镍废料生产 的工艺流程如图:
的工艺流程如图:
已知:①“酸浸”后的酸性溶液中含有
 、
、 、
、 、
、 等离子;
等离子;②表中为金属离子生成氢氧化物沉淀的pH(设开始沉淀时金属离子浓度均为
 ):
):| 氢氧化物 |  |  |  |  |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)为提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有
(2)加入足量
 的作用是
的作用是(3)在“沉镍”前,需加
 控制溶液pH的范围为
控制溶液pH的范围为(4)氧化生成
 的离子方程式为
的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸,需量取浓硫酸__ mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________ 。
(2)酸浸时,为了提高浸取率可采取的措施有____________________ 。(答出两点)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式_________________ 。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有_______ ;但溶液的pH不能超过8,其理由是________________________ 。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____ 。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:________________ 。
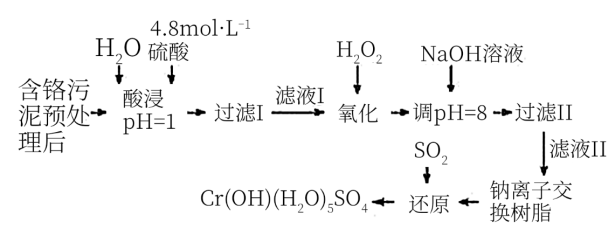
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸,需量取浓硫酸
(2)酸浸时,为了提高浸取率可采取的措施有
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的ph | 2.7 | — | — | — |
| 沉淀完全时的ph | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】次氯酸钠溶液和二氯异氰尿酸钠(C3N3O3Cl2Na)都是常用的杀菌消毒剂。NaClO可用于制备二氯异氰尿酸钠。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备 NaClO的离子方程式为_______ 。
(2)二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为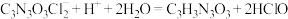


准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL 上述溶液于容量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用 Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液20.00mL。
Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①请算出该样品的有效氯等于_______ ,通过计算判断该样品是否为优质品_______ (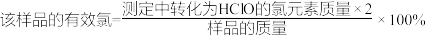 )。
)。
②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值_______ (填“偏高”或“偏低”)。
③向次氯酸钠溶液溶液中通入过量二氧化硫的离子反应方程式为_______ 。
(3)与次氯酸钠中的氯同主族的碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。 的一种制备方法如下图所示,回答下列问题:
的一种制备方法如下图所示,回答下列问题:
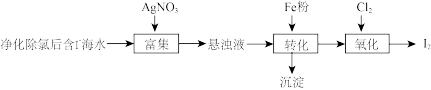
①加入Fe粉进行转化反应的离子方程式为_______ 。
②通入少量 的过程中,若氧化产物只有一种,反应的离子方程式为
的过程中,若氧化产物只有一种,反应的离子方程式为_______ 。
③若以 为原料制备
为原料制备 的方法是:向
的方法是:向 溶液中加入适量的酸化的
溶液中加入适量的酸化的 ,反应得到
,反应得到 ,上述制备
,上述制备 的离子方程式为
的离子方程式为_______ 。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备 NaClO的离子方程式为
(2)二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为
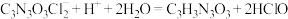


准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取
 Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液20.00mL。
Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液20.00mL。①请算出该样品的有效氯等于
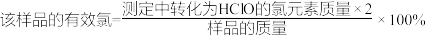 )。
)。②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值
③向次氯酸钠溶液溶液中通入过量二氧化硫的离子反应方程式为
(3)与次氯酸钠中的氯同主族的碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。
 的一种制备方法如下图所示,回答下列问题:
的一种制备方法如下图所示,回答下列问题:
①加入Fe粉进行转化反应的离子方程式为
②通入少量
 的过程中,若氧化产物只有一种,反应的离子方程式为
的过程中,若氧化产物只有一种,反应的离子方程式为③若以
 为原料制备
为原料制备 的方法是:向
的方法是:向 溶液中加入适量的酸化的
溶液中加入适量的酸化的 ,反应得到
,反应得到 ,上述制备
,上述制备 的离子方程式为
的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】秋耳是中国的传统食材,其中含有丰富的蛋白质、多糖及有益元素:
(一)秋耳中铁元素的检验
实验方案:取适量干秋耳粉平均分成三份,实验操作和现象记录如下:
根据上述实验,回答下列问题:
(1)灼烧秋耳粉时,除了坩埚还需要下列仪器中的_______ (填代号)。
(2)实验三加入H2O2的目的是_______ ,写出H2O2参与的最主要反应的离子方程式_______ 。
(3)由三组实验做出如下推断,其中合理的是:_______(填代号)。
(二)秋耳中铁元素的含量测定
实验步骤如下:
①取5.000g秋耳粉,在坩埚中充分灼烧至灰白色,将灰分转移至干燥器中冷却,称其质量为0.235g;
②向灰分中加入4mL浓硝酸,微热10min,过滤,并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
③将合并液定容成50mL待测液,利用分光光度法测得铁的浓度为 。
。
根据上述实验,回答下列问题:
(4)步骤②洗涤烧杯和沉淀的目的是_______ 。
(5)步骤③定容操作若仰视容量瓶刻度线,会造成秋耳样品含铁量测定结果_______ (填“偏高”、“偏低”或“无影响”)。
(6)根据实验数据计算秋耳含铁量为_______ 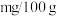 。
。
(一)秋耳中铁元素的检验
实验方案:取适量干秋耳粉平均分成三份,实验操作和现象记录如下:
| 实验 | 操作步骤 | 检验试剂 | 现象 |
| 实验一 | 适量蒸馏水浸泡,过滤,取滤液,加检验试剂,后加入适量H2O2,再次加入检验试剂 | KSCN溶液 | 均无明显现象 |
| 实验二 | 在坩埚中充分灼烧,加适量盐酸浸泡,取滤液,加检验试剂 | KSCN溶液 | 极浅的红色 |
| 实验三 | 在坩埚中充分灼烧,加适量盐酸、H2O2浸泡,取滤液,加检验试剂 | KSCN溶液 | 较深的红色 |
(1)灼烧秋耳粉时,除了坩埚还需要下列仪器中的
A. B.
B. C.
C. D.
D. E.
E.
(2)实验三加入H2O2的目的是
(3)由三组实验做出如下推断,其中合理的是:_______(填代号)。
| A.秋耳粉样品中含铁量极低 | B.秋耳中的铁元素很难用蒸馏水直接溶出 |
| C.仅用盐酸无法溶出秋耳灰分中的铁元素 | D.灼烧的目的是将秋耳中的铁元素氧化 |
(二)秋耳中铁元素的含量测定
实验步骤如下:
①取5.000g秋耳粉,在坩埚中充分灼烧至灰白色,将灰分转移至干燥器中冷却,称其质量为0.235g;
②向灰分中加入4mL浓硝酸,微热10min,过滤,并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
③将合并液定容成50mL待测液,利用分光光度法测得铁的浓度为
 。
。根据上述实验,回答下列问题:
(4)步骤②洗涤烧杯和沉淀的目的是
(5)步骤③定容操作若仰视容量瓶刻度线,会造成秋耳样品含铁量测定结果
(6)根据实验数据计算秋耳含铁量为
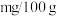 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:
①Al4C3与硫酸反应可生成CH4
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与过量NaOH溶液反应的化学方程式____ 。
(2)实验装置(如图所示,量气管为碱式滴定管改装)

连好装置后,首先应进行的操作是__________ 。
(3)实验过程:称得装置D的初始质量为yg;称取xgAlN样品置于装置B锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管的初始读数为amL(量气装置左右液面相平)。
①欲首先测量Al4C3质量分数的有关数据,对三个活塞的操作是: 关闭活塞___ ,打开活塞___
②若无恒压管,对所测气体体积的影响是____ (填“偏大”“偏小”或“无影响”)
③量气管中液面不再发生变化,说明反应已经结束。读取读数之前,应对量气管进行的操作为,首先恢复至室温,然后____ ;若量气管中的液面高于A右侧干燥管中的液面,所测气体的体积___ (填“偏大”“偏小”或“无影响”)。
④记录滴定管的读数为bmL(已知:该实验条件下的气体摩尔体积为VmL·mol-1),则Al4C3的质量分数为____ (用含a、b、x、Vm的代数式表示)。
⑤测量AlN质量分数的数据:首先关闭活塞K1,打开活塞K3,通过分液漏斗加入____ ,与装置B瓶内物质充分反应;反应完成后,____ (填入该步应进行的操作),最后称得装置D的质量为zg。则样品中AlN的质量分数为____ (用含x、y、z、的代数式表示)。
(1)实验原理:
①Al4C3与硫酸反应可生成CH4
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与过量NaOH溶液反应的化学方程式
(2)实验装置(如图所示,量气管为碱式滴定管改装)

连好装置后,首先应进行的操作是
(3)实验过程:称得装置D的初始质量为yg;称取xgAlN样品置于装置B锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管的初始读数为amL(量气装置左右液面相平)。
①欲首先测量Al4C3质量分数的有关数据,对三个活塞的操作是: 关闭活塞
②若无恒压管,对所测气体体积的影响是
③量气管中液面不再发生变化,说明反应已经结束。读取读数之前,应对量气管进行的操作为,首先恢复至室温,然后
④记录滴定管的读数为bmL(已知:该实验条件下的气体摩尔体积为VmL·mol-1),则Al4C3的质量分数为
⑤测量AlN质量分数的数据:首先关闭活塞K1,打开活塞K3,通过分液漏斗加入
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某化学小组为测定有机物G的组成和结构,设计实验装置及实验步骤如图:
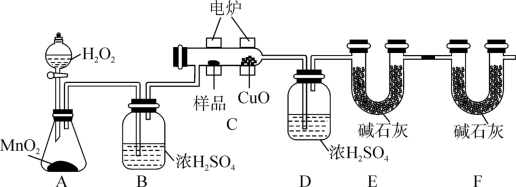
回答下列问题:
(1)“加热反应管C”和“打开分液漏斗活塞”这两步操作应先进行___ 。
(2)装置B中浓H2SO4的作用是___ 。
(3)装置F中碱石灰的作用是___ 。
(4)若准确称取8.8g样品G(只含C、H、O三种元素),经充分燃烧后(CuO的作用是确保有机物充分氧化,最终生成CO2和H2O),洗气瓶D质量增加7.2g。U型管E质量增加17.6g,又知有机物G的质谱图(如图所示)为:
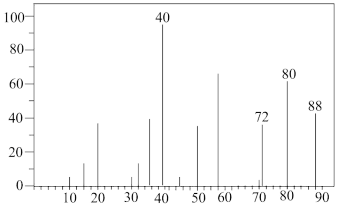
该有机物的分子式为___ 。
(5)另取有机物G8.8g,跟足量NaHCO3溶液反应,生成2.24LCO2(标准状况),经测定其核磁共振氢谱有3组峰,且峰面积之比为6:1:1,综上所述,G的结构简式为___ 。

回答下列问题:
(1)“加热反应管C”和“打开分液漏斗活塞”这两步操作应先进行
(2)装置B中浓H2SO4的作用是
(3)装置F中碱石灰的作用是
(4)若准确称取8.8g样品G(只含C、H、O三种元素),经充分燃烧后(CuO的作用是确保有机物充分氧化,最终生成CO2和H2O),洗气瓶D质量增加7.2g。U型管E质量增加17.6g,又知有机物G的质谱图(如图所示)为:

该有机物的分子式为
(5)另取有机物G8.8g,跟足量NaHCO3溶液反应,生成2.24LCO2(标准状况),经测定其核磁共振氢谱有3组峰,且峰面积之比为6:1:1,综上所述,G的结构简式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如下:
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)Co2+ 的价电子排布式________ , 空间构型为
空间构型为________
(2)提高“酸浸”速率的方法有_________ 。(任写一条)
(3)“滤渣1”的主要成分是_________ 。(写化学式)
(4)黄钠铁矾的化学式为Na2 Fe 6(SO4)4(OH)12,“除铁”的离子方程式为___________ 。
(5)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是________ (结合平衡理论解释)。Ca2+和Mg2+沉淀完全时,溶液中F-的浓度c(F- )最小为______ mol·L-1(已知离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全,Ksp(CaF2)=1.0 ×10-10,Ksp(MgF2)=7.5×10-11)。
(6)获得NiSO4(s)的“一系列操作”是________ 。
(7)工艺流程中,可循环利用的物质是___________ 。
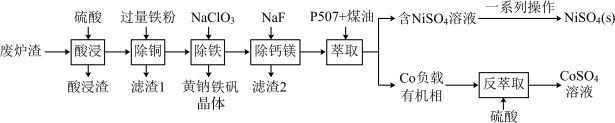
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)Co2+ 的价电子排布式
 空间构型为
空间构型为(2)提高“酸浸”速率的方法有
(3)“滤渣1”的主要成分是
(4)黄钠铁矾的化学式为Na2 Fe 6(SO4)4(OH)12,“除铁”的离子方程式为
(5)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是
(6)获得NiSO4(s)的“一系列操作”是
(7)工艺流程中,可循环利用的物质是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】亚硝酸钠 是一种工业盐,外观与食盐非常相似,毒性较强。某化学实验小组用如图装置(略去夹持仪器)制备亚硝酸钠。
是一种工业盐,外观与食盐非常相似,毒性较强。某化学实验小组用如图装置(略去夹持仪器)制备亚硝酸钠。

已知: ;酸性条件下
;酸性条件下 和
和 均能与
均能与 生成
生成 和
和 。
。
(1)装置B中发生反应的化学方程式为________________ 。
(2)装置C、E的作用是________________ 。
(3) 反应完全后,为测定产品纯度,该小组取D中的产品
反应完全后,为测定产品纯度,该小组取D中的产品 溶于水配成
溶于水配成 溶液,取
溶液,取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 酸性
酸性 溶液进行滴定,实验所得数据如表(假设酸性
溶液进行滴定,实验所得数据如表(假设酸性 溶液不与杂质反应):
溶液不与杂质反应):
① 标准溶液应用
标准溶液应用________ (填“酸式”或“碱式”)滴定管盛装,注入 标准溶液之前,滴定管需要
标准溶液之前,滴定管需要________ 、洗涤和润洗。
②以下操作会造产品中 纯度的测定值偏高的是
纯度的测定值偏高的是________ (填代号)。
a.锥形瓶洗净后未干燥
b.盛装 的滴定管用蒸馏水洗净后未用标准液润洗
的滴定管用蒸馏水洗净后未用标准液润洗
c.滴定前平视读数,滴定终点时俯视读数
d.盛装 的滴定管滴定前有气泡,滴定后气泡消失
的滴定管滴定前有气泡,滴定后气泡消失
③滴定终点的实验现象为________________ ,该产品中亚硝酸钠的质量分数为________ 。(计算结果保留4位有效数字)。
(4)若 未反应完全,则会使产品纯度的测定结果
未反应完全,则会使产品纯度的测定结果________ (“偏大”“偏小”或“无影响”)。
 是一种工业盐,外观与食盐非常相似,毒性较强。某化学实验小组用如图装置(略去夹持仪器)制备亚硝酸钠。
是一种工业盐,外观与食盐非常相似,毒性较强。某化学实验小组用如图装置(略去夹持仪器)制备亚硝酸钠。
已知:
 ;酸性条件下
;酸性条件下 和
和 均能与
均能与 生成
生成 和
和 。
。(1)装置B中发生反应的化学方程式为
(2)装置C、E的作用是
(3)
 反应完全后,为测定产品纯度,该小组取D中的产品
反应完全后,为测定产品纯度,该小组取D中的产品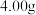 溶于水配成
溶于水配成 溶液,取
溶液,取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 酸性
酸性 溶液进行滴定,实验所得数据如表(假设酸性
溶液进行滴定,实验所得数据如表(假设酸性 溶液不与杂质反应):
溶液不与杂质反应):滴定次数 | 1 | 2 | 3 | 4 |
消耗 | 20.90 | 20.02 | 20.00 | 19.98 |
 标准溶液应用
标准溶液应用 标准溶液之前,滴定管需要
标准溶液之前,滴定管需要②以下操作会造产品中
 纯度的测定值偏高的是
纯度的测定值偏高的是a.锥形瓶洗净后未干燥
b.盛装
 的滴定管用蒸馏水洗净后未用标准液润洗
的滴定管用蒸馏水洗净后未用标准液润洗c.滴定前平视读数,滴定终点时俯视读数
d.盛装
 的滴定管滴定前有气泡,滴定后气泡消失
的滴定管滴定前有气泡,滴定后气泡消失③滴定终点的实验现象为
(4)若
 未反应完全,则会使产品纯度的测定结果
未反应完全,则会使产品纯度的测定结果
您最近一年使用:0次




