家庭厨房实际上就是一个化学世界,“柴米油盐酱醋糖”等均是化学物质。学好化学知识,享受健康生活。回答下列问题:
(1)厨房中使用的纯碱( ),可用于洗涤油污等,洗涤原理为
),可用于洗涤油污等,洗涤原理为_______ (用离子方程式表示)。
(2)食醋的主要成分为CH3COOH,常温下,取pH=3的食醋稀释100倍,pH的取值范围为_______ 。
(3)酱油是一种厨房常用调味剂,根据国家《食品添加剂使用标准》要求,酱油中NaCl的含量不应低于15g/100mL。莫尔法是较简单的一种测量 含量的方法。现采用该法测量某市售酱油是否符合NaCl含量标准要求。实验原理如下(25℃):
含量的方法。现采用该法测量某市售酱油是否符合NaCl含量标准要求。实验原理如下(25℃):
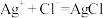 (白色沉淀)
(白色沉淀) 
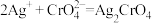 (砖红色沉淀)
(砖红色沉淀) 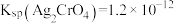
准确移取酱油样品5.00mL稀释至100.00mL,从其中取出10.00mL置于锥形瓶中,再向其中加入适量的 溶液(指示剂),以0.1000mol/L的硝酸银标准溶液滴定,重复实验三次。
溶液(指示剂),以0.1000mol/L的硝酸银标准溶液滴定,重复实验三次。
①滴定终点的判断依据为_______ 。
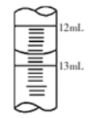
②滴定结束时,滴定管中液面如图所示,则读数为_______ 。
③滴定过程中,下列操作会导致结果偏大的是_______ 。
A.滴定过程中,锥形瓶内有部分液体溅出
B.滴定过程中,部分标准液滴到锥形瓶外
C.滴定前读数时平视,滴定后读数时俯视
D.滴定前读数时尖嘴处有气泡,滴定后读数时尖嘴处无气泡
④若三次消耗硝酸银标准溶液的平均体积为12.50mL,则稀释后的酱油中NaCl的浓度为_______ mol/L,该市售酱油是否符合NaCl含量标准_______ (填“符合”或“不符合”)。
(1)厨房中使用的纯碱(
 ),可用于洗涤油污等,洗涤原理为
),可用于洗涤油污等,洗涤原理为(2)食醋的主要成分为CH3COOH,常温下,取pH=3的食醋稀释100倍,pH的取值范围为
(3)酱油是一种厨房常用调味剂,根据国家《食品添加剂使用标准》要求,酱油中NaCl的含量不应低于15g/100mL。莫尔法是较简单的一种测量
 含量的方法。现采用该法测量某市售酱油是否符合NaCl含量标准要求。实验原理如下(25℃):
含量的方法。现采用该法测量某市售酱油是否符合NaCl含量标准要求。实验原理如下(25℃):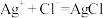 (白色沉淀)
(白色沉淀) 
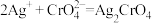 (砖红色沉淀)
(砖红色沉淀) 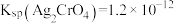
准确移取酱油样品5.00mL稀释至100.00mL,从其中取出10.00mL置于锥形瓶中,再向其中加入适量的
 溶液(指示剂),以0.1000mol/L的硝酸银标准溶液滴定,重复实验三次。
溶液(指示剂),以0.1000mol/L的硝酸银标准溶液滴定,重复实验三次。
①滴定终点的判断依据为
②滴定结束时,滴定管中液面如图所示,则读数为
③滴定过程中,下列操作会导致结果偏大的是
A.滴定过程中,锥形瓶内有部分液体溅出
B.滴定过程中,部分标准液滴到锥形瓶外
C.滴定前读数时平视,滴定后读数时俯视
D.滴定前读数时尖嘴处有气泡,滴定后读数时尖嘴处无气泡
④若三次消耗硝酸银标准溶液的平均体积为12.50mL,则稀释后的酱油中NaCl的浓度为
更新时间:2021-03-05 11:24:52
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】Ag、 是两种重要的化工产品。某小组以含
是两种重要的化工产品。某小组以含 的废定影液为原料制备Ag和
的废定影液为原料制备Ag和 的流程如下。
的流程如下。
(1)现用15 mol⋅L 浓硝酸和水以体积比1∶1的比例配制100 mL的硝酸,简述其操作是
浓硝酸和水以体积比1∶1的比例配制100 mL的硝酸,简述其操作是____________ 。
(2)“焙烧”过程中发生反应的化学方程式为____________ 。
(3)“酸溶”中制备 的离子方程式为
的离子方程式为____________ 。
(4)粗银提取纯Ag分两步进行:第一步,用物理方法即______ 除去大量Fe粉;第二步,将含少量Fe粉的银溶于盐酸,经______ (填实验操作名称)、水洗、干燥得到纯银。
(5)“沉银1”发生的反应: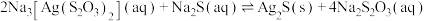 ,该反应的平衡常数
,该反应的平衡常数 为
为______ (结果保留两位有效数字)。
已知: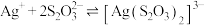 的平衡常数
的平衡常数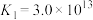 ,
,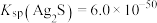 。
。
(6)利用重结晶法从“沉银1”的滤液中提取大苏打,测定大苏打纯度。称取W g产品溶于水配制成250 mL溶液,准确量取25.00 mL溶液于锥形瓶中,滴加几滴淀粉溶液,用c mol⋅L
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液V mL。已知滴定反应:
溶液V mL。已知滴定反应: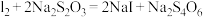 ,该产品中
,该产品中 的质量分数为
的质量分数为______ (用含c、V、W的式子表示)。三次平行实验发现,测得的产品纯度均大于实际值(实验操作均正确),其原因可能是______ 。
(7)银晶胞为面心立方最密堆积晶胞,如图所示。该晶胞中原子空间利用率为______(填标号)。(提示:原子空间利用率=原子总体积与晶胞体积之比)
 是两种重要的化工产品。某小组以含
是两种重要的化工产品。某小组以含 的废定影液为原料制备Ag和
的废定影液为原料制备Ag和 的流程如下。
的流程如下。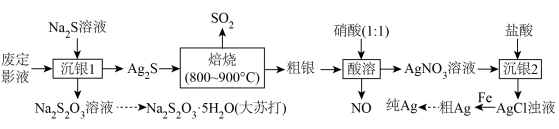
(1)现用15 mol⋅L
 浓硝酸和水以体积比1∶1的比例配制100 mL的硝酸,简述其操作是
浓硝酸和水以体积比1∶1的比例配制100 mL的硝酸,简述其操作是(2)“焙烧”过程中发生反应的化学方程式为
(3)“酸溶”中制备
 的离子方程式为
的离子方程式为(4)粗银提取纯Ag分两步进行:第一步,用物理方法即
(5)“沉银1”发生的反应:
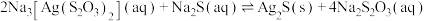 ,该反应的平衡常数
,该反应的平衡常数 为
为已知:
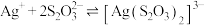 的平衡常数
的平衡常数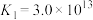 ,
,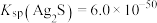 。
。(6)利用重结晶法从“沉银1”的滤液中提取大苏打,测定大苏打纯度。称取W g产品溶于水配制成250 mL溶液,准确量取25.00 mL溶液于锥形瓶中,滴加几滴淀粉溶液,用c mol⋅L

 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液V mL。已知滴定反应:
溶液V mL。已知滴定反应: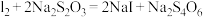 ,该产品中
,该产品中 的质量分数为
的质量分数为(7)银晶胞为面心立方最密堆积晶胞,如图所示。该晶胞中原子空间利用率为______(填标号)。(提示:原子空间利用率=原子总体积与晶胞体积之比)
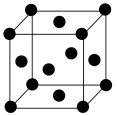
A.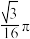 | B.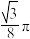 | C. | D.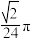 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】亚氯酸钠(NaClO2)是一种高效漂白剂,主要用于棉纺、亚麻、纸浆的漂白及杀菌灭藻、鱼药制造。某科研小组欲制备少量亚氯酸钠并利用“间接碘量法”测定其纯度。
(一)亚氯酸钠的制备
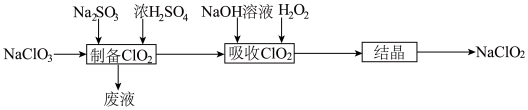
查阅资料:①NaClO2饱和溶液在温度低于38°C时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl;
② +4I-+4H+=2H2O+2I2+Cl- I2+2
+4I-+4H+=2H2O+2I2+Cl- I2+2 =
= +2I-
+2I-
(1)科研小组利用上述流程制备亚氯酸钠,“制备ClO2”时发生反应的化学方程式为_______ 。
(2)“结晶”需要控制的温度范围是___________ 。
(二)亚氯酸钠纯度的测定
I.取制备的亚氯酸钠固体3.75g配制成100mL溶液;
II.取上述溶液25.00mL于锥形瓶中,加入足量KI溶液和稀H2SO4,再滴加几滴试剂X;
III.用1.50mol∙L-1Na2S2O3标准溶液滴定至终点,记录消耗的Na2S2O3标准溶液的体积;
IV.重复II、III操作3次。
(3)试剂X应选择___________ (填名称),滴定终点的现象为___________ 。
(4)三次滴定数据记录如下:
亚氯酸钠的纯度(质量百分含量)为___________ 。
(5)若滴定前滴定管内无气泡,滴定后尖嘴部分出现气泡,会导致测定结果___________ (填“偏低”“偏高”或“无影响”,下同),若滴定终点时仰视读数会导致测定结果___________ 。
(一)亚氯酸钠的制备

查阅资料:①NaClO2饱和溶液在温度低于38°C时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl;
②
 +4I-+4H+=2H2O+2I2+Cl- I2+2
+4I-+4H+=2H2O+2I2+Cl- I2+2 =
= +2I-
+2I-(1)科研小组利用上述流程制备亚氯酸钠,“制备ClO2”时发生反应的化学方程式为
(2)“结晶”需要控制的温度范围是
(二)亚氯酸钠纯度的测定
I.取制备的亚氯酸钠固体3.75g配制成100mL溶液;
II.取上述溶液25.00mL于锥形瓶中,加入足量KI溶液和稀H2SO4,再滴加几滴试剂X;
III.用1.50mol∙L-1Na2S2O3标准溶液滴定至终点,记录消耗的Na2S2O3标准溶液的体积;
IV.重复II、III操作3次。
(3)试剂X应选择
(4)三次滴定数据记录如下:
| 滴定次序 | 1 | 2 | 3 |
| V(Na2S2O3溶液)/mL | 20.03 | 20.01 | 19.96 |
(5)若滴定前滴定管内无气泡,滴定后尖嘴部分出现气泡,会导致测定结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,要进行必要的处理。
两种离子在溶液中存在如下平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
现对某工业废水进行检测并做沉降处理,请回答下列问题:
(一)取样该工业废水,检测其中铬的含量。
步骤Ⅰ:取25.00 mL废水,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3
2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3 2NaI+Na2S4O6)
2NaI+Na2S4O6)
步骤Ⅳ:将上述反应后溶液进行pH调节、过滤等处理,回收沉淀,滤液倒入下水道。
(1)步骤Ⅰ加入稀硫酸酸化的目的是_____________________________ ;
(2)步骤Ⅱ判断滴定达到终点的现象是___________________________ ;
(3)以下操作会造成废水中铬含量测定值偏高的是_________________ ;
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.清洗后未用标准液润洗碱式滴定管
(4)25.00mL废水经酸化后,含有Cr2O72-的物质的量为___________ mol.
(二)还原沉淀法除Cr2O72-和CrO42-
该方法的工艺流程为:
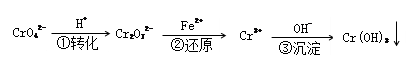
(5)能说明第①步反应达到平衡状态的是_____________ ;(填字母代号)
a. Cr2O72-和CrO42-的浓度相同
b. 2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(6)第②步中,还原1molCr2O72-离子,需要________ mol的FeSO4·7H2O。
(7)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至___________ 。
两种离子在溶液中存在如下平衡:2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O现对某工业废水进行检测并做沉降处理,请回答下列问题:
(一)取样该工业废水,检测其中铬的含量。
步骤Ⅰ:取25.00 mL废水,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H+
 2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3
2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3 2NaI+Na2S4O6)
2NaI+Na2S4O6)滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
第一次 | 1.02 | 19.03 |
第二次 | 2.00 | 19.99 |
第三次 | 0. 20 | 18.20 |
(1)步骤Ⅰ加入稀硫酸酸化的目的是
(2)步骤Ⅱ判断滴定达到终点的现象是
(3)以下操作会造成废水中铬含量测定值偏高的是
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.清洗后未用标准液润洗碱式滴定管
(4)25.00mL废水经酸化后,含有Cr2O72-的物质的量为
(二)还原沉淀法除Cr2O72-和CrO42-
该方法的工艺流程为:

(5)能说明第①步反应达到平衡状态的是
a. Cr2O72-和CrO42-的浓度相同
b. 2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(6)第②步中,还原1molCr2O72-离子,需要
(7)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
(1)用50mL0.50 的盐酸与50mL0.55
的盐酸与50mL0.55 的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。
的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。
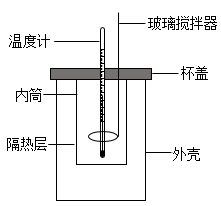
①若将杯盖改为薄铁板,求得的反应热 将
将___________ (填“偏大”、“偏小”或“无影响”)。
②实验时玻璃搅拌器的运动方向是___________ 。
a.上下运动b.左右运动c.顺时针运动d.逆时针运动
③若通过测定计算出产生的热量为1.42kJ,请写出该反应的热化学方程式:___________ 。
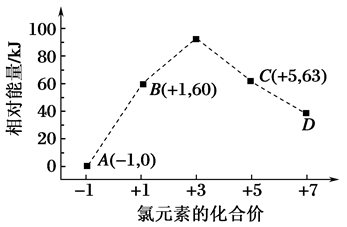
(2)已知: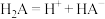 、
、 ,常温下,0.1
,常温下,0.1 NaHA溶液的pH=2,则0.1
NaHA溶液的pH=2,则0.1
 溶液中
溶液中 的大小范围是
的大小范围是___________ ;NaHA溶液中各离子浓度由大到小关系为___________ 。
(3)一定条件下,在水溶液中所含离子 、
、 、
、 、
、 、
、 各1mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),则反应
各1mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),则反应 的
的
___________  。
。
(1)用50mL0.50
 的盐酸与50mL0.55
的盐酸与50mL0.55 的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。
的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。
①若将杯盖改为薄铁板,求得的反应热
 将
将②实验时玻璃搅拌器的运动方向是
a.上下运动b.左右运动c.顺时针运动d.逆时针运动
③若通过测定计算出产生的热量为1.42kJ,请写出该反应的热化学方程式:
(2)已知:
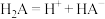 、
、 ,常温下,0.1
,常温下,0.1 NaHA溶液的pH=2,则0.1
NaHA溶液的pH=2,则0.1
 溶液中
溶液中 的大小范围是
的大小范围是(3)一定条件下,在水溶液中所含离子
 、
、 、
、 、
、 、
、 各1mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),则反应
各1mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),则反应 的
的
 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)根据氯化铁溶液回答下列问题:
①向FeCl3溶液中加入少量NaHCO3。产生的现象为___ 。用离子方程式表示其原因___ 。
②不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是___ 。
③在配制FeCl3溶液时,为防止溶液变浑浊,应加入___ 。
(2)利用反应Cu+H2O2+H2SO4=CuSO4+2H2O设计一个原电池,回答下列问题:
①负极材料为___ ;正极反应式为___ 。
②反应过程中SO 向
向____ 极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了___ 克。
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
①物质的量浓度均为0.1mol•L-1的四种溶液:pH由小到大排列的顺序是__ (用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___ (填字母)
A.c(H+) B. C.c(H+)•c(OH-) D.
C.c(H+)•c(OH-) D. E.
E.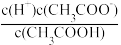
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____ 。
④25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=____ (填准确数值)。
⑤标准状况下,将1.12LCO2通入100mL1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+____ 。
①向FeCl3溶液中加入少量NaHCO3。产生的现象为
②不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是
③在配制FeCl3溶液时,为防止溶液变浑浊,应加入
(2)利用反应Cu+H2O2+H2SO4=CuSO4+2H2O设计一个原电池,回答下列问题:
①负极材料为
②反应过程中SO
 向
向③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1mol•L-1的四种溶液:pH由小到大排列的顺序是
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是
A.c(H+) B.
 C.c(H+)•c(OH-) D.
C.c(H+)•c(OH-) D. E.
E.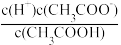
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
④25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=
⑤标准状况下,将1.12LCO2通入100mL1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】白醋的功效有多种,如能够健脾开胃、抗菌和除菌等,经常少量饮醋对人体有益。其有效成分主要为醋酸CH3COOH。
(1)配制并测定醋酸中CH3COOH的浓度。
25℃下,将少量冰醋酸加入适量蒸馏水中稀释,用0.1000 mol/L NaOH溶液滴定20.00 mL稀释的醋酸溶液。
①该实验应选用___________ 作指示剂。判断酸碱中和滴定反应到达滴定终点时的现象是___________ 。
②四次滴定消耗NaOH溶液的体积如下表:
则该醋酸中CH3COOH的浓度为___________ mol/L。
(2)误差分析。从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显少于其他三次,其原因可能是___________。
(3)探究浓度对醋酸电离平衡的影响。
①提出假设 稀释醋酸溶液,CH3COOH的电离平衡发生移动。
理论推测:以稀释10倍时浓度熵与电离平衡常数的相对大小来定量判断平衡移动的方向,其推测过程为___________ 。
②设计方案并完成实验 用0.1000 mol·L−1 CH3COOH溶液,按下表进行实验,测定pH,记录数据。
根据表中信息,补充数据:x =___________ 。
③实验分析 由实验Ⅰ和Ⅱ可知,稀释CH3COOH溶液,电离平衡___________ (填“正”或“逆”)向移动;结合表中数据,给出判断理由:___________ 。
实验结论 假设成立。
(1)配制并测定醋酸中CH3COOH的浓度。
25℃下,将少量冰醋酸加入适量蒸馏水中稀释,用0.1000 mol/L NaOH溶液滴定20.00 mL稀释的醋酸溶液。
①该实验应选用
②四次滴定消耗NaOH溶液的体积如下表:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗NaOH溶液的体积/mL | 19.95 | 18.40 | 20.05 | 20.00 |
(2)误差分析。从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显少于其他三次,其原因可能是___________。
| A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积 |
| B.滴定前碱式滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液 |
| C.盛装醋酸溶液的滴定管用蒸馏水洗过,未用醋酸溶液润洗 |
| D.锥形瓶预先用醋酸溶液润洗过 |
①提出假设 稀释醋酸溶液,CH3COOH的电离平衡发生移动。
理论推测:以稀释10倍时浓度熵与电离平衡常数的相对大小来定量判断平衡移动的方向,其推测过程为
②设计方案并完成实验 用0.1000 mol·L−1 CH3COOH溶液,按下表进行实验,测定pH,记录数据。
| 序号 | V(醋酸溶液)/mL | V(H2O)/mL | pH |
| Ⅰ | 10.00 | 0 | 2.88 |
| Ⅱ | 1.00 | x | 3.38 |
③实验分析 由实验Ⅰ和Ⅱ可知,稀释CH3COOH溶液,电离平衡
实验结论 假设成立。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:
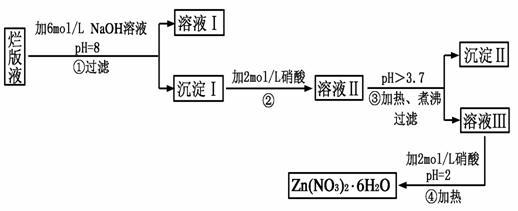
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是______ (填化学式),若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______ 。
(2)在操作①中保持pH=8的目的是______ 。
(3)沉淀Ⅰ的主要成分是______ 。
(4)操作③中加热、煮沸的目的是______ ;此步骤操作的理论依据是______ 。
(5)操作④保持pH=2的目的是______ ;此步骤操作中所用的主要仪器是______ 。

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是
(2)在操作①中保持pH=8的目的是
(3)沉淀Ⅰ的主要成分是
(4)操作③中加热、煮沸的目的是
(5)操作④保持pH=2的目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】磁选后的炼铁高钛炉渣,主要成分有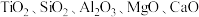 以及少量的
以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
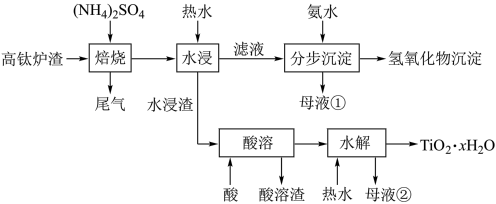
该工艺条件下,有关金属离子开始沉淀和沉淀完全的 见下表
见下表
回答下列问题:
(1)“水浸”后“滤液”的 约为2.0,在“分步沉淀”时用氨水逐步调节
约为2.0,在“分步沉淀”时用氨水逐步调节 至11.6,依次析出的金属离子是
至11.6,依次析出的金属离子是_______ 。
(2)“母液①”中 浓度为
浓度为_______  。
。
(3)“水浸渣”在 “酸溶”,最适合的酸是
“酸溶”,最适合的酸是_______ ,“酸溶渣”的成分是_______ 。
(4)“酸溶”后,将溶液适当稀释并加热, 水解析出
水解析出 沉淀,该反应的离子方程式是
沉淀,该反应的离子方程式是_______ 。
(5)将“母液①”和“母液②”混合,吸收尾气,经处理得_______ ,循环利用。
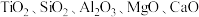 以及少量的
以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的
 见下表
见下表| 金属离子 |  |  |  |  |
开始沉淀的 | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全(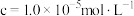 )的 )的 | 3.2 | 4.7 | 11.1 | 13.8 |
回答下列问题:
(1)“水浸”后“滤液”的
 约为2.0,在“分步沉淀”时用氨水逐步调节
约为2.0,在“分步沉淀”时用氨水逐步调节 至11.6,依次析出的金属离子是
至11.6,依次析出的金属离子是(2)“母液①”中
 浓度为
浓度为 。
。(3)“水浸渣”在
 “酸溶”,最适合的酸是
“酸溶”,最适合的酸是(4)“酸溶”后,将溶液适当稀释并加热,
 水解析出
水解析出 沉淀,该反应的离子方程式是
沉淀,该反应的离子方程式是(5)将“母液①”和“母液②”混合,吸收尾气,经处理得
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】利用天然气合成氨的工艺流程示意如图:

依据流程,回答下列问题:
(1)天然气脱硫时的化学方程式为_______ 。
(2)n mol CH4经一次转化后,产生CO 0.9n mol,产生H2_______ mol(用含n的代数式表示)。
(3)K2CO3溶液和CO2反应在加压条件下进行,加压的理论依据是_______ 。
A.相似相溶原理 B.勒夏特列原理 C.酸碱中和原理
(4)K2CO3溶液中离子浓度由大到小的顺序为_______ 。
(5)K2CO3不可与铵态氮肥混合施用,结合平衡移动原理说明原因:_______ 。
(6)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(溶液)循环,请在流程中找出第三处循环____ (循环方向、循环物质)。
(7)关于合成氨,下列说法正确的是_______ 。
A.到达平衡时,N2和H2的质量比不变
B.平均分子量不变时,反应处于平衡状态
C.气体密度不变,说明反应处于平衡状态
D.NH3分解的速率最大时,平衡向左移动
(8)合成氨反应需要在500℃条件下进行,原因为_______ 。

依据流程,回答下列问题:
(1)天然气脱硫时的化学方程式为
(2)n mol CH4经一次转化后,产生CO 0.9n mol,产生H2
(3)K2CO3溶液和CO2反应在加压条件下进行,加压的理论依据是
A.相似相溶原理 B.勒夏特列原理 C.酸碱中和原理
(4)K2CO3溶液中离子浓度由大到小的顺序为
(5)K2CO3不可与铵态氮肥混合施用,结合平衡移动原理说明原因:
(6)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(溶液)循环,请在流程中找出第三处循环
(7)关于合成氨,下列说法正确的是
A.到达平衡时,N2和H2的质量比不变
B.平均分子量不变时,反应处于平衡状态
C.气体密度不变,说明反应处于平衡状态
D.NH3分解的速率最大时,平衡向左移动
(8)合成氨反应需要在500℃条件下进行,原因为
您最近一年使用:0次



