离子液体是一种由离子组成的液体,在低温下也能以液态存在,是一种很有应用价值的溶剂。研究显示最常见的离子液体主要由如图所示正离子和负离子组成,图中正离子有令人惊奇的稳定性。下列说法不正确的是
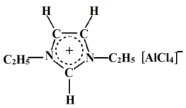

| A.该化合物中不存在配位键和氢键 |
| B.图中负离子的空间结构为正四面体形 |
| C.图中正离子中碳原子的杂化方式为sp2、sp3 |
| D.由于离子液体的粒子全都是带电荷的离子,所以离子液体有难挥发性 |
20-21高二上·山东淄博·期末 查看更多[2]
更新时间:2021-03-06 22:06:20
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列说法正确的是
A. 分子的空间构型与它的VSEPR模型一致 分子的空间构型与它的VSEPR模型一致 |
B. 分子和 分子和 分子之间可以形成氢键 分子之间可以形成氢键 |
C. 中的键角 中的键角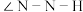 小于 小于 中的键角 中的键角 |
D. 和 和 的分子结构相似,均为非极性分子 的分子结构相似,均为非极性分子 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】铑的配合物离子 [Rh(CO)2I2]- 可催化甲醇羰基化,反应过程如图所示。下列叙述不正确的是
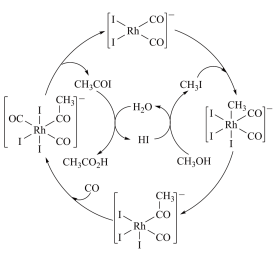
| A.催化循环中Rh的配位数有3种 |
| B.[Rh(CO)2I2]- 中Rh的化合价为+1价 |
| C.H2O和CH3I的VSEPR模型名称不同 |
| D.甲醇羰基化反应为:CH3OH + CO=CH3CO2H |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】硫及硫的化合物在生产、生活中有广泛应用。S8和SF6的分子结构如图所示,下列有关叙述正确的是
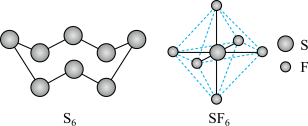

| A.SF6分子呈正八面体形且键角为120° |
| B.SF6的熔点高于SF4的熔点 |
| C.S8分子和SF6分子都是极性分子 |
| D.S8和SF6中S原子的杂化类型均为sp3杂化 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】氯吡苯脲是一种常用的膨大剂,其结构简式如图所示,下列有关说法正确的是

| A.氯元素基态原子核外电子的未成对电子数为1 |
| B.氯吡苯脲晶体中,氮原子的杂化轨道类型只有sp2 |
| C.所有原子可能在同一平面上 |
D.基态氮原子的价层电子轨道表示式: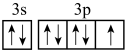 |
您最近一年使用:0次

 与两个正五边形的环戊二烯负离子(
与两个正五边形的环戊二烯负离子(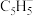 )形成的夹心型分子(如图所示)。下列关于二茂铁晶体的说法正确的是
)形成的夹心型分子(如图所示)。下列关于二茂铁晶体的说法正确的是