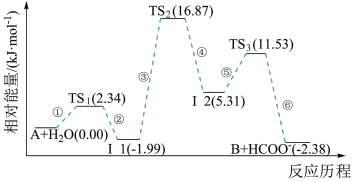
一定温度下, ,反应过程对应的能量变化如图,下列说法正确的是
,反应过程对应的能量变化如图,下列说法正确的是
 ,反应过程对应的能量变化如图,下列说法正确的是
,反应过程对应的能量变化如图,下列说法正确的是
A. 的 的 |
B. 是正反应的活化能,是活化络合物的平均能量与反应物的平均能量的差值 是正反应的活化能,是活化络合物的平均能量与反应物的平均能量的差值 |
| C.温度升高,活化分子数增多,活化分子百分数不变,有效碰撞次数增多,反应速率增大 |
D.加入催化剂可以减小 ,反应速率加快, ,反应速率加快, 减小 减小 |
20-21高二上·浙江·期末 查看更多[7]
江西省乐平中学2022-2023学年高二上学期11月期中考试化学试题河南省商丘市宁陵县高级中学2023-2024学年高二上学期第一次考试化学试题河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题(已下线)第二章 化学反应速率与化学平衡(A卷·知识通关练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)(已下线)2.1.3 活化能(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第2章 化学反应速率和化学平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)浙江省金华市金华十校2020-2021学年高二上学期调研考试化学试题
更新时间:2021-03-06 21:03:03
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】在气体反应体系中,能使反应物中活化分子数和活化分子百分数同时增加的方法是
①增大反应物浓度 ②增大压强 ③升高温度 ④加入催化剂
①增大反应物浓度 ②增大压强 ③升高温度 ④加入催化剂
| A.①③ | B.②③ | C.③④ | D.②④ |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其总反应为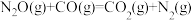
 ,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是
,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是

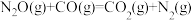
 ,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是
,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是
A. |
| B.N2O为氧化剂 |
| C.由图乙知该反应正反应的活化能小于逆反应的活化能 |
D.为了实现转化,需不断向反应器中补充Pt2O+和Pt2O |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】下列关于催化剂的说法正确的是( )
| A.任何化学反应都需要催化剂 | B.化学反应中的催化剂一般并不唯一 |
| C.催化剂对化学反应历程无影响 | D.催化剂的化学性质在反应前后会发生改变 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】 和
和 反应生成的羰基硫(COS)用于粮食熏蒸,能防止某些昆虫、线虫和真菌的危害。
反应生成的羰基硫(COS)用于粮食熏蒸,能防止某些昆虫、线虫和真菌的危害。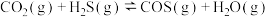 。在不同温度下达到化学平衡时,
。在不同温度下达到化学平衡时, 的转化率如图所示,下列说法正确的是
的转化率如图所示,下列说法正确的是
 和
和 反应生成的羰基硫(COS)用于粮食熏蒸,能防止某些昆虫、线虫和真菌的危害。
反应生成的羰基硫(COS)用于粮食熏蒸,能防止某些昆虫、线虫和真菌的危害。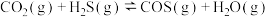 。在不同温度下达到化学平衡时,
。在不同温度下达到化学平衡时, 的转化率如图所示,下列说法正确的是
的转化率如图所示,下列说法正确的是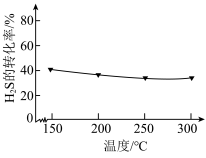
A.通入 后,正反应速率逐渐增大 后,正反应速率逐渐增大 |
B. |
C.及时分离出 可加快该反应到达平衡状态 可加快该反应到达平衡状态 |
| D.选择合适的催化剂既能提高反应速率,也能提高COS的平衡产率 |
您最近一年使用:0次