在气体反应体系中,能使反应物中活化分子数和活化分子百分数同时增加的方法是
①增大反应物浓度 ②增大压强 ③升高温度 ④加入催化剂
①增大反应物浓度 ②增大压强 ③升高温度 ④加入催化剂
| A.①③ | B.②③ | C.③④ | D.②④ |
更新时间:2023-09-02 10:15:57
|
相似题推荐
单选题
|
较易
(0.85)
解题方法
【推荐1】对于有气体参加的反应,一定能使化学反应速率加快的因素是
①扩大容器的容积 ②使用催化剂 ③增加反应物的物质的量 ④升高温度 ⑤缩小容积 ⑥充入稀有气体增大容器内的压强
①扩大容器的容积 ②使用催化剂 ③增加反应物的物质的量 ④升高温度 ⑤缩小容积 ⑥充入稀有气体增大容器内的压强
| A.②③ | B.②③④⑥ | C.②④⑤ | D.②④ |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】我国科研人员提出了由 和
和 转化为高附加值产品
转化为高附加值产品 的催化反应历程,该历程示意图如下所示。
的催化反应历程,该历程示意图如下所示。
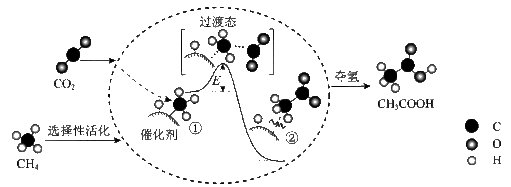
下列说法不正确的是
 和
和 转化为高附加值产品
转化为高附加值产品 的催化反应历程,该历程示意图如下所示。
的催化反应历程,该历程示意图如下所示。
下列说法不正确的是
A.生成 总反应的原子利用率为 总反应的原子利用率为 |
| B.降低温度,降低反应物分子中活化分子的百分数,减少有效碰撞的次数 |
| C.增大反应体系的压强,可以增加反应物分子中活化分子的百分数 |
| D.该反应的催化剂能改变反应历程,降低反应的活化能,增加活化分子的数目 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】对于可逆反应:C(s)+H2O(g)  CO(g)+H2(g) −Q,能加快正反应速率的是
CO(g)+H2(g) −Q,能加快正反应速率的是
 CO(g)+H2(g) −Q,能加快正反应速率的是
CO(g)+H2(g) −Q,能加快正反应速率的是| A.升高温度 | B.减小压强 | C.增加碳的量 | D.移走 H2 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】二氧化碳加氢合成乙烯是综合利用CO2的热点研究领域。其原理为2CO2(g)+6H2(g) C2H4(g)+4H2O(g),在反应进程中采取下列措施,可以降低反应速率的是
C2H4(g)+4H2O(g),在反应进程中采取下列措施,可以降低反应速率的是
 C2H4(g)+4H2O(g),在反应进程中采取下列措施,可以降低反应速率的是
C2H4(g)+4H2O(g),在反应进程中采取下列措施,可以降低反应速率的是| A.降温 | B.加入催化剂 | C.缩小反应器体积 | D.体积不变,加入CO2 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐3】某校化学社同学研究影响0.1 mol/LNa2S2O3溶液与0.1 mol/LH2SO4溶液反应速率的因素,设计实验如下:
下列说法不正确的是
| 序号 | Na2S2O3溶液体积/mL | H2SO4溶液体积/mL | 加入水的体积/mL | 混合前各溶液和水的温度/℃ | 混合后开始出现浑浊的时间 |
| ① | 2 | 2 | 0 | 20 | |
| ② | 1 | 2 | V1 | 20 | |
| ③ | 1 | 2 | V2 | 40 | |
| ④ | 2 | 2 | 0 | 40 |
| A.①和②研究的是浓度对反应速率的影响 |
| B.②和③研究的是温度对反应速率的影响 |
| C.V1=V2=1 |
| D.出现浑浊时间最短的是第③组实验 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】下列有关化学反应速率的说法中,正确的是
| A.实验室制取氢气时,将稀硫酸换为98%的浓硫酸,可加快反应速率 |
| B.在金属钠与足量水反应中,增加水的量能加快反应速率 |
| C.稀硫酸与氢氧化钠溶液反应时,增大压强可以加快反应速率 |
| D.无论是吸热还是放热反应,加热都能加快化学反应速率 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列措施对增大反应速率明显有效的是
| A.Na与无水乙醇反应时增大无水乙醇的用量 |
| B.Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸 |
| C.在K2SO4与BaCl2两溶液反应时,增大压强 |
| D.将炭块磨成炭粉用于燃烧 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐1】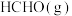 与
与 在催化剂
在催化剂 (简写为
(简写为 )表面催化生成
)表面催化生成 和
和 的历程示意图如下。下列说法正确的是
的历程示意图如下。下列说法正确的是
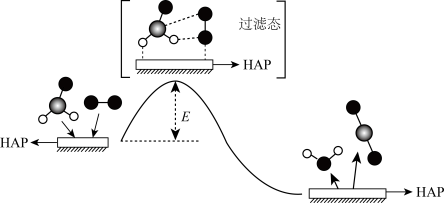
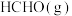 与
与 在催化剂
在催化剂 (简写为
(简写为 )表面催化生成
)表面催化生成 和
和 的历程示意图如下。下列说法正确的是
的历程示意图如下。下列说法正确的是
A.该反应的 |
| B.正反应的活化能大于逆反应的活化能 |
| C.羟基磷灰石(HAP)的作用是降低反应的活化能 |
| D.反应过程中有极性共价键和非极性共价键的断裂和形成 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列关于有效碰撞理论与影响速率因素之间关系正确的是
| A.增大反应物浓度,可以提高活化分子百分数,从而提高反应速率 |
| B.通过压缩体积增大压强,可以提高单位体积内活化分子数,从而提高反应速率 |
| C.升高温度,可以提高活化分子的能量,会减慢反应速率 |
| D.加入催化剂可以降低活化能,活化分子百分比虽然没变,但可以加快反应速率 |
您最近一年使用:0次

 是制备硫酸的重要反应。下列叙述错误的是
是制备硫酸的重要反应。下列叙述错误的是 不改变该反应的逆反应速率
不改变该反应的逆反应速率 ,化学反应速率减慢,平衡逆向移动
,化学反应速率减慢,平衡逆向移动

