已知化合物A与H2O在一定条件下反应生成化合物B与HCOO−,其反应历程如图所示,其中TS表示过渡态,Ⅰ表示中间体。下列说法正确的是
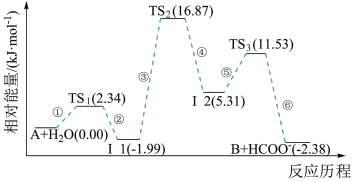
| A.化合物A与H2O之间的碰撞均为有效碰撞 |
| B.平衡状态时,升温使反应逆向移动 |
| C.该历程中的最大活化能E正=16.87kJ·mol-1 |
| D.使用更高效的催化剂可降低反应所需的活化能和反应热 |
21-22高三上·山东泰安·阶段练习 查看更多[48]
重庆十八中两江实验中学校2022-2023学年高二上学期第一次月考化学试题河北省衡水市枣强中学2023-2024学年高二下学期第一次调研考试化学试题福建师范大学附属中学2023-2024学年高二上学期期中考试化学试题福建省建瓯市芝华中学2023-2024学年高二上学期期中考试化学试题陕西省兴平市南郊高级中学2023-2024学年高二上学期第一次质量检测化学试题河北省石家庄市辛集市2023-2024学年高二上学期2月期末考试化学试题陕西省安康市安康中学2023-2024学年高二上学期10月月考化学试题贵州省贵阳市三新改革联盟校2023-2024学年高二上学期10月月考化学试题吉林省长春市新解放学校2022-2023学年高二上学期11月月考化学试题四川省成都市天府新区太平中学2022-2023学年高二上学期期中考试化学试题江苏省苏北三市2022-2023学年高二上学期阶段调研测试化学试题江苏省南通市通州区金沙中学2021-2022学年高二上学期第一次调研考试化学试题河南省南阳市2022-2023学年高二下学期期末考试化学试题福建省龙岩市连城县2022-2023学年高二上学期11月期中考试化学试题新疆昌吉州行知学校2022-2023学年高二上学期期末考试化学试题(已下线)化学反应速率与化学平衡——进阶学习浙江省杭州外国语学校2022-2023学年高二上学期期中考试 化学试题山东省蓬莱第二中学2021-2022学年高三上学期第一次月考化学试题福建省建瓯市芝华中学2022-2023学年高二上学期期中考试化学试题浙江省金华市横店高中2022-2023学年高二上学期10月份检测化学试题陕西省咸阳市实验中学2021-2022学年高二上学期第二次月考化学试题广东省江门市新会第一中学2022-2023学年高二上学期期中考试化学试题广东省广州市真光中学2022-2023学年高二上学期期中考试化学试题福建省龙岩市一级校联盟(九校)联考2022-2023学年高二上学期半期考化学试题江苏省连云港市赣榆智贤中学2022-2023学年高二上学期第一次学情检测化学试题浙江省精诚联盟2022-2023学年高二上学期10月联考化学试题(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)第二章 综合拔高练湖南省娄底涟源市第一中学2022届高三下学期四月月考化学试题安徽省安庆桐城市第八中学2021-2022学年高二上学期第一次月考化学试题河南省温县第一高级中学2021-2022学年高二上学期1月月考化学试题江西省宜春市铜鼓中学2021-2022学年高二下学期开学考化学试题(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-测试辽宁省辽河油田第一高级中学2021-2022学年高二(甲部)上学期11月考化学试题2021年山东高考化学试题变式题11-20四川省成都市树德中学2021-2022学年高二上学期11月阶段性测试(期中)化学试题 吉林省榆树市第一高级中学校2021-2022学年高二上学期10月月考化学试题江西省九校2021-2022学年高二上学期期中联考化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期中考试化学试卷河北饶阳中学2021-2022学年高二上学期第一阶段考试化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期第一次月考化学试题江西省九江市第三中学2021-2022学年高二上学期第一次月考化学试卷四川省广安友谊中学2021-2022学年上学期高二10月月考化学试题黑龙江省实验中学2021-2022学年高二上学期第一次月考化学试题河北省大名县第一中学2021-2022学年高二上学期第一次月考化学试题湖南省邵阳市文德高级中学2021-2022学年高二上学期第一次月考化学试题江西省南昌市南昌大学附属中学 2021-2022学年高二上学期第一次月考化学试卷山东省泰安肥城市2021-2022学年高三上学期第一次摸底考试化学试题
更新时间:2022-12-05 20:23:02
|
相似题推荐
【推荐1】 与
与 在
在 作用下发生反应的能量变化及反应历程如图所示。下列说法中,
作用下发生反应的能量变化及反应历程如图所示。下列说法中,不正确 的是
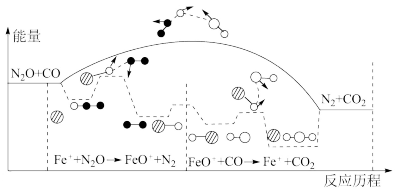
 与
与 在
在 作用下发生反应的能量变化及反应历程如图所示。下列说法中,
作用下发生反应的能量变化及反应历程如图所示。下列说法中,
A.该反应的 |
B. 使反应的活化能减小 使反应的活化能减小 |
| C.催化剂通过参与反应改变了反应历程 |
D.上述过程在 作用下,提高了 作用下,提高了 与 与 的平衡转化率 的平衡转化率 |
您最近半年使用:0次
单选题
|
较易
(0.85)
【推荐2】其他条件不变,增大反应物的浓度能增大反应速率的原因是
| A.单位体积内分子数增多 | B.单位体积内活化分子数增多 |
| C.活化分子百分数增大 | D.分子碰撞的次数增多 |
您最近半年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】CO和O在钉催化剂的表面有“线式”和“桥式”两种反应方式,其中“线式”反应在催化剂表面形成化学键的过程如图所示,下列说法正确的是


A. 和CO都能与碱反应生成盐和水 和CO都能与碱反应生成盐和水 | B.该过程中,CO先断键成C和O |
| C.状态Ⅰ→状态Ⅲ是放热过程 | D.钉催化剂降低了该反应的焓变 |
您最近半年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】“生态马路”运用“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述正确的是
| A.使用光催化剂不改变反应速率 |
| B.使用光催化剂能提高NO的转化率 |
| C.升高温度能加快反应速率 |
| D.改变压强对反应速率无影响 |
您最近半年使用:0次
单选题
|
较易
(0.85)
【推荐1】在某2L恒容密闭容器中充入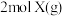 和
和 ,发生反应:
,发生反应: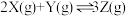 。反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。
。反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。
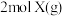 和
和 ,发生反应:
,发生反应: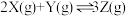 。反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。
。反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。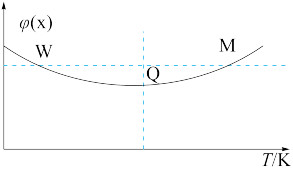
| A.该反应为放热反应 |
| B.升高温度,平衡右移,正反应速率减小,逆反应速率增大 |
| C.Q点时Z的体积分数最大 |
| D.W、M两点Y的正反应速率W点小于M点 |
您最近半年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+ O2(g)
O2(g)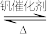 SO3(g),起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图所示。下列有关说法不正确的是
SO3(g),起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图所示。下列有关说法不正确的是

 O2(g)
O2(g)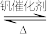 SO3(g),起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图所示。下列有关说法不正确的是
SO3(g),起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图所示。下列有关说法不正确的是
| A.该反应△H<0 |
| B.p1=0.5MPa;p3=5MPa |
| C.在5.0MPa、550℃时的α=97.5% |
| D.500℃时,p1时比p2对应的转化率高,反应速率快 |
您最近半年使用:0次
单选题
|
较易
(0.85)
【推荐3】化学是以实验为基础的学科。下列实验操作、现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将装有NO2气体的玻璃球放入热水中 | 红棕色加深 | 玻璃球中存在反应: 2NO2(g)  N2O4(g) ΔH<0 N2O4(g) ΔH<0 |
| B | 将干白葡萄酒滴入酸性高锰酸钾溶液中 | 溶液紫色褪去 | 干白葡萄酒中含有SO2 |
| C | 测定等浓度的Na2CO3溶液和NaClO溶液的pH | 前者的pH比后者的大 | 元素的非金属性C<Cl |
| D | 向NaCl与NaI的混合稀溶液中滴入少量稀AgNO3溶液 | 有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次

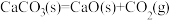 的
的 >0
>0

