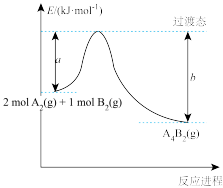
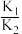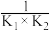下列说法中不正确 的是
| A.使用催化剂可以同时增大活化分子百分数和单位体积内活化分子数 |
B.反应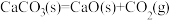 的 的 >0 >0 |
| C.平衡常数K值越大,则可逆反应进行越完全,反应物的转化率越大 |
| D.活化分子发生的碰撞均为有效碰撞 |
更新时间:2021-12-14 20:12:53
|
相似题推荐
单选题
|
较易
(0.85)
解题方法
【推荐1】下列说法正确的是
| A.活化分子碰撞即发生化学反应 |
| B.升高温度会加快反应速率,原因是增加了活化分子的碰撞次数 |
| C.某一反应的活化分子百分数是个定值 |
| D.活化分子的碰撞不一定是有效碰撞 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列关于碰撞理论的说法不正确的是( )
| A.具有足够能量,能发生有效碰撞的分子是活化分子 |
| B.有效碰撞要求发生碰撞的分子具有足够的能量和合适的取向 |
| C.其他条件不变时,升温可使活化分子百分数增加,增大化学反应速率 |
| D.其他条件不变时,增大压强可使活化分子百分数增加,增大化学反应速率 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐1】如图,反应 可以通过两种不同的进程发生:
可以通过两种不同的进程发生: 直接发生,半衰期与初始浓度无关。在294K时,半衰期为1000min,在340K时,A浓度降至原始浓度的1/1024所需的时间为0.10min。
直接发生,半衰期与初始浓度无关。在294K时,半衰期为1000min,在340K时,A浓度降至原始浓度的1/1024所需的时间为0.10min。
(b)反应通过两步进行。
则下面的说法中,错误的是
 可以通过两种不同的进程发生:
可以通过两种不同的进程发生:
 直接发生,半衰期与初始浓度无关。在294K时,半衰期为1000min,在340K时,A浓度降至原始浓度的1/1024所需的时间为0.10min。
直接发生,半衰期与初始浓度无关。在294K时,半衰期为1000min,在340K时,A浓度降至原始浓度的1/1024所需的时间为0.10min。(b)反应通过两步进行。
则下面的说法中,错误的是
| A.A*是反应的催化剂 |
| B.C比A更稳定 |
| C.(b)的反应方式活化能降低,从而能提高反应速率 |
| D.(a)的反应方式中反应速率与A的浓度成正比 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】下列说法错误的是
| A.在任何条件下,纯水都呈中性 |
| B.FeS、Mg(OH)2属于难溶电解质 |
| C.催化剂能改变反应所需的活化能 |
| D.在25℃时,由CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-802.31kJ∙mol-1,可知CH4的燃烧热为-802.31kJ∙mol-1 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】铁及其化合物与生产、生活关系密切,已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。若在2L密闭容器中加入0.02mol FeO(s),并通入xmol CO,t℃时反应达到平衡.此时FeO(s)转化率为50%,则x的值为( )
Fe(s)+CO2(g)的平衡常数K=0.25。若在2L密闭容器中加入0.02mol FeO(s),并通入xmol CO,t℃时反应达到平衡.此时FeO(s)转化率为50%,则x的值为( )
 Fe(s)+CO2(g)的平衡常数K=0.25。若在2L密闭容器中加入0.02mol FeO(s),并通入xmol CO,t℃时反应达到平衡.此时FeO(s)转化率为50%,则x的值为( )
Fe(s)+CO2(g)的平衡常数K=0.25。若在2L密闭容器中加入0.02mol FeO(s),并通入xmol CO,t℃时反应达到平衡.此时FeO(s)转化率为50%,则x的值为( )A.0.1 | B.0.05 | C.0.04  | D.0.02 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】高温时在催化剂作用下,某可逆反应达到平衡,平衡常数 ,恒容时,温度升高,
,恒容时,温度升高, 浓度减小。下列说法正确的是
浓度减小。下列说法正确的是
 ,恒容时,温度升高,
,恒容时,温度升高, 浓度减小。下列说法正确的是
浓度减小。下列说法正确的是| A.CO2是反应物 | B.恒温恒容下,增大压强, 浓度一定减小 浓度一定减小 |
| C.升高温度,逆反应速率减小 | D.该反应的反应热为负值 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】在下列变化中,体系的熵变小于0的是
| A.红墨水加到清水使整杯水变红 | B.冰融化 |
| C.铁器在潮湿的空气中生锈 | D.蔗糖在水中溶解 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】下列有关化学反应方向及其判据的说法中错误的是
| A.1molH2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)] |
| B.NH4NO3溶于水吸热,说明其溶于水不是自发过程 |
C.CaCO3(s)  CaO(s)+CO2(g) △H>0能否自发进行与温度有关 CaO(s)+CO2(g) △H>0能否自发进行与温度有关 |
| D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的 △H>0 |
您最近一年使用:0次

 A4B2(g)
A4B2(g)