(1)有两个反应:a.H2(g)+Cl2(g) 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g) 2HCl(g)。这两个反应的能量转化方式主要是
2HCl(g)。这两个反应的能量转化方式主要是___ 能转化为____ 能,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量___ (填“相等”或“不相等”)。
(2)利用反应4HCl+O2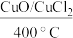 2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
请回答下列有关问题:
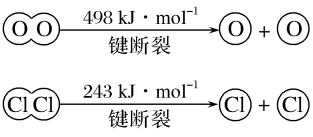
①4molHCl被氧化时,放出___ kJ的热量。
②断开1molH—O键与断开1molH—Cl键所需能量相差___ kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”)___ 。
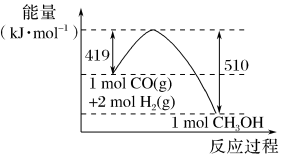
(3)根据图示的能量转化关系判断,生成16gCH3OH(l)____ (填“吸收”或“放出”)___ kJ能量。
 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g) 2HCl(g)。这两个反应的能量转化方式主要是
2HCl(g)。这两个反应的能量转化方式主要是(2)利用反应4HCl+O2
 2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
请回答下列有关问题:
①4molHCl被氧化时,放出
②断开1molH—O键与断开1molH—Cl键所需能量相差
(3)根据图示的能量转化关系判断,生成16gCH3OH(l)

更新时间:2021-04-10 22:01:36
|
相似题推荐
【推荐1】氮氧化物( NOx)、CO2和SO2等气体会造成环境问题。对燃煤废气进行化学方法处理,可实现绿色环保、节能减排、废物利用等目的。
(1)已知氢气与甲醇的燃烧热分别为285.8kJ·mol-1、726.5 kJ·mol-1,则CO2与H2反应产生液态甲醇与液态水的热化学方程式为___________________________________
(2)已知在一定温度下将6molCO2和8mol H2充入容器为2L的密闭容器中发生如下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1 ,则
①该反应自发进行的条件是_______________ (填“低温”“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是_____________ (填字母)
a.混合气体的平均相对分子质量保持不变 b.CO2和H 2的物质的量之比保持不变
c.CO2和H 2的转化率相等 d.3v正(H2)=v逆(CH3OH)
e.1mol CO2生成的同时有3mol H—H键断裂
③H2的物质的量随时间变化曲线如图实线所示,仅改变某一条件再进行实验,测得H2物质的量随时间变化曲线如图虚线所示。与实线相比,虚线改变的条件可能是__________________

(3)如图是某甲醇燃料电池工作的示意图。质子交换膜(只有质子能够通过)左右两侧的溶液均为1L 2mol·L -1H2SO4溶液。电极a上发生的电极反应式为_____________________ ,当电池中有1mol e -发生转移时左右两侧溶液的质量之差为____ g(假设反应物耗尽,忽略气体的溶解)。

(1)已知氢气与甲醇的燃烧热分别为285.8kJ·mol-1、726.5 kJ·mol-1,则CO2与H2反应产生液态甲醇与液态水的热化学方程式为
(2)已知在一定温度下将6molCO2和8mol H2充入容器为2L的密闭容器中发生如下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1 ,则
①该反应自发进行的条件是
②下列叙述能说明此反应达到平衡状态的是
a.混合气体的平均相对分子质量保持不变 b.CO2和H 2的物质的量之比保持不变
c.CO2和H 2的转化率相等 d.3v正(H2)=v逆(CH3OH)
e.1mol CO2生成的同时有3mol H—H键断裂
③H2的物质的量随时间变化曲线如图实线所示,仅改变某一条件再进行实验,测得H2物质的量随时间变化曲线如图虚线所示。与实线相比,虚线改变的条件可能是

(3)如图是某甲醇燃料电池工作的示意图。质子交换膜(只有质子能够通过)左右两侧的溶液均为1L 2mol·L -1H2SO4溶液。电极a上发生的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】铁是重要的金属元素,用途极广。
(1)某高效净水剂可由Fe(OH)SO4聚合得到。工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为_______ 。
(2)已知:①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ/mol
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ/mol
高炉炼铁过程中发生的主要反应为: Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
 Fe(s)+CO2(g) ΔH = a kJ/mol,则a =
Fe(s)+CO2(g) ΔH = a kJ/mol,则a =_______ kJ/mol。
已知该反应在不同温度下的平衡常数如下表:
在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,此时v正 _______ v逆(填“等于”、“大于”或“小于”)。经过l0 min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v (CO2)= _______ 。欲提高上述反应中CO的平衡转化率,可采取的措施是_______ ;
A.提高反应温度 B.移出部分CO2 C.加入合适的催化剂 D.减小容器的容积
(1)某高效净水剂可由Fe(OH)SO4聚合得到。工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为
(2)已知:①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ/mol
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ/mol
高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
 Fe(s)+CO2(g) ΔH = a kJ/mol,则a =
Fe(s)+CO2(g) ΔH = a kJ/mol,则a =已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
A.提高反应温度 B.移出部分CO2 C.加入合适的催化剂 D.减小容器的容积
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】汽车发动机工作时会产生包括CO、NOx等多种污染气体,如何处理这些气体,对保护大气环境意义重大,回答下列问题:
(1)已知:2NO2(g) 2NO(g)+O2(g) ΔH1=+115.2kJ·mol-1
2NO(g)+O2(g) ΔH1=+115.2kJ·mol-1
2O3(g) 3O2(g) ΔH2=-286.6kJ·mol-1
3O2(g) ΔH2=-286.6kJ·mol-1
写出臭氧与NO作用产生NO2和O2的热化学方程式___ 。
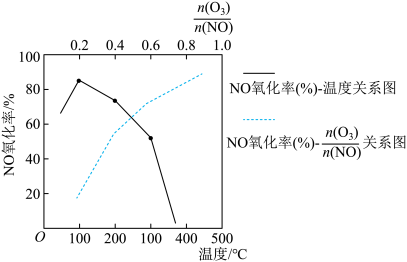
恒容密闭体系中NO氧化率随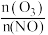 值的变化以及随温度的变化曲线如图所示。NO氧化率随
值的变化以及随温度的变化曲线如图所示。NO氧化率随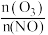 值增大而增大的主要原因是
值增大而增大的主要原因是___ 。
(2)实验测得反应2NO(g)+O2(g) 2NO2(g)ΔH<0的即时反应速率满足以下关系式:v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响。
2NO2(g)ΔH<0的即时反应速率满足以下关系式:v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响。
①温度为T1时,在1L的恒容密闭容器中,投入0.6molNO和0.3molO2,达到平衡时O2为0.2mol;温度为T2该反应达到平衡时,存在k正=k逆,则T1___ T2(填“大于”、“小于”或“等于”)。
②研究发现该反应按如下步骤进行:
第一步:NO+NO N2O2快速平衡
N2O2快速平衡
第二步:N2O2+O2 2NO2慢反应
2NO2慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v1正=k1正×c2(NO);v1逆=k1逆×c(N2O2)。下列叙述正确的是___ 。
A.同一温度下,平衡时第一步反应的k1正/k1逆越大反应正向程度越大
B.第二步反应速率低,因而转化率也低
C.第二步的活化能比第一步的活化能低
D.整个反应的速率由第二步反应速率决定
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g) 4CO2(g)+N2(g)ΔH<0
4CO2(g)+N2(g)ΔH<0
某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生上述反应,随着反应的进行,容器内的压强变化如表所示:
回答下列问题:
①在此温度下,该反应达到平衡时,容器里气体的总物质的量为___ ,反应的平衡常数Kp=___ kPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,Kp为以分压表示的平衡常数,计算结果精确到小数点后2位);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡___ (填“右移”或“左移”或“不移动”);
②若将温度降低,再次平衡后,与原平衡相比体系压强(p总)___ (填“增大”、“减小”或“不变”)。
(1)已知:2NO2(g)
 2NO(g)+O2(g) ΔH1=+115.2kJ·mol-1
2NO(g)+O2(g) ΔH1=+115.2kJ·mol-12O3(g)
 3O2(g) ΔH2=-286.6kJ·mol-1
3O2(g) ΔH2=-286.6kJ·mol-1写出臭氧与NO作用产生NO2和O2的热化学方程式
恒容密闭体系中NO氧化率随
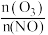 值的变化以及随温度的变化曲线如图所示。NO氧化率随
值的变化以及随温度的变化曲线如图所示。NO氧化率随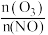 值增大而增大的主要原因是
值增大而增大的主要原因是
(2)实验测得反应2NO(g)+O2(g)
 2NO2(g)ΔH<0的即时反应速率满足以下关系式:v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响。
2NO2(g)ΔH<0的即时反应速率满足以下关系式:v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响。①温度为T1时,在1L的恒容密闭容器中,投入0.6molNO和0.3molO2,达到平衡时O2为0.2mol;温度为T2该反应达到平衡时,存在k正=k逆,则T1
②研究发现该反应按如下步骤进行:
第一步:NO+NO
 N2O2快速平衡
N2O2快速平衡第二步:N2O2+O2
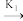 2NO2慢反应
2NO2慢反应其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v1正=k1正×c2(NO);v1逆=k1逆×c(N2O2)。下列叙述正确的是
A.同一温度下,平衡时第一步反应的k1正/k1逆越大反应正向程度越大
B.第二步反应速率低,因而转化率也低
C.第二步的活化能比第一步的活化能低
D.整个反应的速率由第二步反应速率决定
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g)
 4CO2(g)+N2(g)ΔH<0
4CO2(g)+N2(g)ΔH<0某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生上述反应,随着反应的进行,容器内的压强变化如表所示:
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| 压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
①在此温度下,该反应达到平衡时,容器里气体的总物质的量为
②若将温度降低,再次平衡后,与原平衡相比体系压强(p总)
您最近一年使用:0次
【推荐1】(1)已知:N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905 kJ·mol-1
2H2(g)十O2(g)=2HO(g):△H=--483.6 kJ·mol-1
则N2(g)+3H2(g)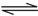 2NH3(g)的△H=
2NH3(g)的△H=___________ 。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3)______________ ;
②达到平衡时NH3的体积分数为______________________ 。

(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是__________________ 。
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905 kJ·mol-1
2H2(g)十O2(g)=2HO(g):△H=--483.6 kJ·mol-1
则N2(g)+3H2(g)
 2NH3(g)的△H=
2NH3(g)的△H=(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3)
②达到平衡时NH3的体积分数为

(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇水气时发烟生成(HSiO)2O等,写出该反应的化学方程式___ 。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=48kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH=___ kJ·mol-1。
(3)对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
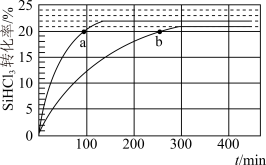
①343K时反应的平衡转化率α=___ %。
②比较a、b处反应速率大小:va___ vb(填“大于”“小于”或“等于”)。
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇水气时发烟生成(HSiO)2O等,写出该反应的化学方程式
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=48kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH=
(3)对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。

①343K时反应的平衡转化率α=
②比较a、b处反应速率大小:va
您最近一年使用:0次
【推荐3】CO2是导致温室效应的主要物质。CO2加氢合成甲醇不仅解决了CO2的排放问题,还提供了化工基础原料。回答下列问题:
(1)已知CO2加氢合成甲醇涉及的反应有:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-49.2kJ/mol
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2kJ/mol
则反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) △H3=___ kJ/mol
(2)在恒容密闭容器中发生反应CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
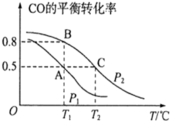
①A、B、C三点的平衡常数KA,KB,KC的大小关系是____ 。
②下列叙述能说明上述反应能达到化学平衡状态的是____ (填代号)。
a.2v正(H2)=v逆(CH3OH)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不变
d.H2(g)与CH3OH(g) 的物质的量之比保持不变
③在容积为2L的密闭容器内充入0.3molCO与0.6molH2在催化剂作用下发生反应生成甲醇。A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA____ tC(填“大于”“小于”或“等于");若P2压强恒定为p,则T2℃平衡常数Kp=____ (Kp用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
(3)我国规定生活用水中铅排放的最大允许浓度为0.01mg/L。在某含铅废水中加入Na2S,当S2-浓度达到6.8×10-8mol/L时,水体中Pb2+浓度为____ mol/L[已知:Ksp(PbS)=3.4×10-28],此时是否符合排放标准?___________ (填“是”或“否”)。
(1)已知CO2加氢合成甲醇涉及的反应有:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-49.2kJ/mol
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2kJ/mol
则反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) △H3=
(2)在恒容密闭容器中发生反应CO(g)+2H2(g)
 CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
①A、B、C三点的平衡常数KA,KB,KC的大小关系是
②下列叙述能说明上述反应能达到化学平衡状态的是
a.2v正(H2)=v逆(CH3OH)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不变
d.H2(g)与CH3OH(g) 的物质的量之比保持不变
③在容积为2L的密闭容器内充入0.3molCO与0.6molH2在催化剂作用下发生反应生成甲醇。A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA
(3)我国规定生活用水中铅排放的最大允许浓度为0.01mg/L。在某含铅废水中加入Na2S,当S2-浓度达到6.8×10-8mol/L时,水体中Pb2+浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的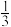 Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:
Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:_______ 。当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是________________ 。

(2)电化学法也可制备纳米级Fe3O4,用面积为4cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50mA。生成Fe3O4的电极反应为__________ 。
(3)已知:H2O(1)=H2(g)+ O2(g)△H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。
O2(g)△H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。

过程I.____________________________________________________ 。
过程II:3FeO(s)+H2O(1)===H2(g)+Fe3O4(s) △H=+128.9kJ·mol-1。
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的
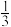 Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:
Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:
(2)电化学法也可制备纳米级Fe3O4,用面积为4cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50mA。生成Fe3O4的电极反应为
(3)已知:H2O(1)=H2(g)+
 O2(g)△H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。
O2(g)△H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。
过程I.
过程II:3FeO(s)+H2O(1)===H2(g)+Fe3O4(s) △H=+128.9kJ·mol-1。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】金属锰在冶金工业中用来制造特种钢,常作为脱硫剂和去氧剂,其化合物广泛应用于电池、机械制造业等领域。
(1)以软锰矿(主要为MnO2)为原料通过热还原法得到金属锰涉及的两个反应:
①3MnO2(s)=Mn3O4(s)+ O2(g) △H1= akJ•mol-1
②3Mn3O4(s)+ 8Al(s) =4Al2O3(s) + 9Mn(s) △H2= bkJ•mol-1
已知Al的燃烧热为 △H3=ckJ•mol-1,则MnO2与Al发生铝热反应的热化学方程式为___________ 。
(2)科研人员将制得的锰粉碎后加入SnCl2溶液中使其浸出(假定杂质不反应,溶液 体积不变),发生反应Mn(s)+ Sn2+(aq) Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
请回答下列问题:
①为加快反应速率可以采取的措施有__________ ;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是____________________ 。
②下列能说明反应已达平衡的有____________________ (填编号)。
A.溶液的颜色不发生变化 B.溶液中c(Mn2+)=c( Sn2+)
C.体系中固体的质量不变 D.Mn2+与Sn2+浓度的比值保持不变
③室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=________________ ,Mn2+的产率为____________ 。

④若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则 再次平衡时c(Mn2+) =____________ (不考虑离子水解的影响)。
(3)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为_____________________ ,阳极附近溶液的pH____________ (选填“增大”、“减小”或“不变”)。
(1)以软锰矿(主要为MnO2)为原料通过热还原法得到金属锰涉及的两个反应:
①3MnO2(s)=Mn3O4(s)+ O2(g) △H1= akJ•mol-1
②3Mn3O4(s)+ 8Al(s) =4Al2O3(s) + 9Mn(s) △H2= bkJ•mol-1
已知Al的燃烧热为 △H3=ckJ•mol-1,则MnO2与Al发生铝热反应的热化学方程式为
(2)科研人员将制得的锰粉碎后加入SnCl2溶液中使其浸出(假定杂质不反应,溶液 体积不变),发生反应Mn(s)+ Sn2+(aq)
 Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)请回答下列问题:
①为加快反应速率可以采取的措施有
②下列能说明反应已达平衡的有
A.溶液的颜色不发生变化 B.溶液中c(Mn2+)=c( Sn2+)
C.体系中固体的质量不变 D.Mn2+与Sn2+浓度的比值保持不变
③室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=

④若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则 再次平衡时c(Mn2+) =
(3)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】甲醇是一种绿色能源,是机动车燃油的最佳替代品。请回答下列有关问题:
(1)用CO可以合成甲醇。已知:
ⅰ.CH3OH(g)+ O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJ•mol-1;
O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJ•mol-1;
ⅱ.CO(g)+ O2(g)=CO2(g) △H=-283.0 kJ•mol-1;
O2(g)=CO2(g) △H=-283.0 kJ•mol-1;
ⅲ.H2(g)+ O2(g)=H2O(g) △H=-285.8 kJ•mol-1;
O2(g)=H2O(g) △H=-285.8 kJ•mol-1;
则 CO(g)+2H2(g) CH3OH(g) △H=
CH3OH(g) △H=________ kJ·mol-1。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
ⅳ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-53.7 kJ•mol-1平衡常数 K1;
CH3OH(g)+H2O(g) △H=-53.7 kJ•mol-1平衡常数 K1;
ⅴ.CO2(g)+H2(g) CO(g)+H2O(g)△H=+41.2 kJ•mol-1平衡常数K2。
CO(g)+H2O(g)△H=+41.2 kJ•mol-1平衡常数K2。
下列四组实验,若控制CO2和H2初始投料比均为1∶2.2,经过相同反应时间测得如下实验数据:
①CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=___________ (用含K1、K2的表达式表示)。
②有利于提高CO2转化为CH3OH平衡转化率的措施有_________ 。
a.使用Cu/ZnO纳米棒衬料
b.使用Cu/ZnO纳米片材料
c.降低反应温度
d.保持投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
③由表格中的数据可知,相同温度下不同的催化剂对CO2的转化率不同,造成该结果的原因是_________________________________________ 。
(3)甲醇燃料电池是目前技术最成熟,应用最广泛的一种燃料电池,其工作原理如下图所示:
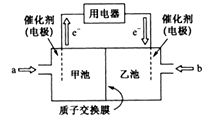
①a气体的名称是_________ 。
②甲池所在电极为原电池的______ 极,其电极反应式为__________________________ 。
③电解液中,H+的移动方向为_____________ 。
(1)用CO可以合成甲醇。已知:
ⅰ.CH3OH(g)+
 O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJ•mol-1;
O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJ•mol-1;ⅱ.CO(g)+
 O2(g)=CO2(g) △H=-283.0 kJ•mol-1;
O2(g)=CO2(g) △H=-283.0 kJ•mol-1;ⅲ.H2(g)+
 O2(g)=H2O(g) △H=-285.8 kJ•mol-1;
O2(g)=H2O(g) △H=-285.8 kJ•mol-1;则 CO(g)+2H2(g)
 CH3OH(g) △H=
CH3OH(g) △H=(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
ⅳ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-53.7 kJ•mol-1平衡常数 K1;
CH3OH(g)+H2O(g) △H=-53.7 kJ•mol-1平衡常数 K1;ⅴ.CO2(g)+H2(g)
 CO(g)+H2O(g)△H=+41.2 kJ•mol-1平衡常数K2。
CO(g)+H2O(g)△H=+41.2 kJ•mol-1平衡常数K2。下列四组实验,若控制CO2和H2初始投料比均为1∶2.2,经过相同反应时间测得如下实验数据:
温度(K) | 催化剂 | CO2转化率(%) |
543 | Cu/ZnO纳米棒材料 | 12.3 |
543 | Cu/ZnO纳米片材料 | 10.9 |
553 | Cu/ZnO纳米棒材料 | 15.3 |
553 | Cu/ZnO纳米片材料 | 12.0 |
①CO(g)+2H2(g)
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=②有利于提高CO2转化为CH3OH平衡转化率的措施有
a.使用Cu/ZnO纳米棒衬料
b.使用Cu/ZnO纳米片材料
c.降低反应温度
d.保持投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
③由表格中的数据可知,相同温度下不同的催化剂对CO2的转化率不同,造成该结果的原因是
(3)甲醇燃料电池是目前技术最成熟,应用最广泛的一种燃料电池,其工作原理如下图所示:

①a气体的名称是
②甲池所在电极为原电池的
③电解液中,H+的移动方向为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】能量转化是化学变化的重要特征,按要求回答下列问题:
(1)已知: 键的键能为
键的键能为 ,
, 键的键能为
键的键能为 ,
, 键的键能为
键的键能为 则反应
则反应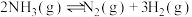 中,理论上消耗
中,理论上消耗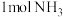
___________ (填“吸收”或“放出”)___________ kJ热量。
(2)把a、b、c、d四种金属片浸入稀硫酸中,用导线两两相连可以组成各种原电池。若a、b相连,a为正极:c、d相连,c为负极:a﹑c相连,c上有气泡逸出:b、d相连,b质量减小,则四种金属的活动性由强到弱顺序为:___________ 。
(3)中国科学院长春应用化学研究所曾在甲烷( )燃料电池技术方面获得重大突破。甲烷燃料电池工作的原理如图所示,甲烷燃料电池采用铂作电板催化剂,电池中的质子交换膜只允许质子(
)燃料电池技术方面获得重大突破。甲烷燃料电池工作的原理如图所示,甲烷燃料电池采用铂作电板催化剂,电池中的质子交换膜只允许质子( )和水分子通过。其工作原理的示意图如下,请回答下列问题:
)和水分子通过。其工作原理的示意图如下,请回答下列问题:
① 的电子式为
的电子式为___________ ,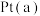 电极反应式为
电极反应式为___________
②电解质溶液中的 向
向___________ (填“a”或“b”)极移动,电子流出的电极是___________ (填“a”或“b”)极。
③该电池工作时消耗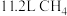 (标准状况下),假设电池的能量转化率为80%,则电路中通过
(标准状况下),假设电池的能量转化率为80%,则电路中通过___________ mol电子。
(1)已知:
 键的键能为
键的键能为 ,
, 键的键能为
键的键能为 ,
, 键的键能为
键的键能为 则反应
则反应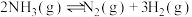 中,理论上消耗
中,理论上消耗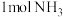
(2)把a、b、c、d四种金属片浸入稀硫酸中,用导线两两相连可以组成各种原电池。若a、b相连,a为正极:c、d相连,c为负极:a﹑c相连,c上有气泡逸出:b、d相连,b质量减小,则四种金属的活动性由强到弱顺序为:
(3)中国科学院长春应用化学研究所曾在甲烷(
 )燃料电池技术方面获得重大突破。甲烷燃料电池工作的原理如图所示,甲烷燃料电池采用铂作电板催化剂,电池中的质子交换膜只允许质子(
)燃料电池技术方面获得重大突破。甲烷燃料电池工作的原理如图所示,甲烷燃料电池采用铂作电板催化剂,电池中的质子交换膜只允许质子( )和水分子通过。其工作原理的示意图如下,请回答下列问题:
)和水分子通过。其工作原理的示意图如下,请回答下列问题:
①
 的电子式为
的电子式为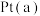 电极反应式为
电极反应式为②电解质溶液中的
 向
向③该电池工作时消耗
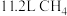 (标准状况下),假设电池的能量转化率为80%,则电路中通过
(标准状况下),假设电池的能量转化率为80%,则电路中通过
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】按要求回答下列问题:
(1)下列物质中属于强电解质的是______ (填标号,下同),非电解质是______ ,能导电的是______ 。
① ②
② ③氨水④液态
③氨水④液态 ⑤乙醇⑥
⑤乙醇⑥ ⑦
⑦ ⑧
⑧
(2)若 时,醋酸的电离常数
时,醋酸的电离常数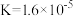 ,则该温度下
,则该温度下 醋酸溶液中
醋酸溶液中 约为
约为______  。
。
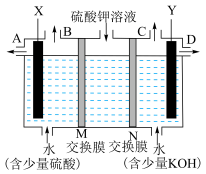
(3)用如图装置电解硫酸钾溶液,可获得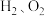 、硫酸和氢氧化钾溶液。电解过程中
、硫酸和氢氧化钾溶液。电解过程中 电极与电源的极
电极与电源的极______ 相连, 电极周围溶液
电极周围溶液 值
值______ (填“增大”、“减小”或“不变”),M、 交换膜中是阳离子交换膜的是
交换膜中是阳离子交换膜的是______ (填“M”或“N”)。
(4)现有反应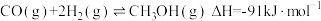 已知该反应中相关的化学键键能数据如下:
已知该反应中相关的化学键键能数据如下:
则气态 中
中 的键能为
的键能为______ 
(1)下列物质中属于强电解质的是
①
 ②
② ③氨水④液态
③氨水④液态 ⑤乙醇⑥
⑤乙醇⑥ ⑦
⑦ ⑧
⑧
(2)若
 时,醋酸的电离常数
时,醋酸的电离常数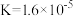 ,则该温度下
,则该温度下 醋酸溶液中
醋酸溶液中 约为
约为 。
。(3)用如图装置电解硫酸钾溶液,可获得
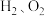 、硫酸和氢氧化钾溶液。电解过程中
、硫酸和氢氧化钾溶液。电解过程中 电极与电源的极
电极与电源的极 电极周围溶液
电极周围溶液 值
值 交换膜中是阳离子交换膜的是
交换膜中是阳离子交换膜的是
(4)现有反应
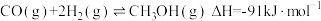 已知该反应中相关的化学键键能数据如下:
已知该反应中相关的化学键键能数据如下:| 化学键 | H—H | C—O | H—O | C—H |
 | 436 | 343 | 465 | 413 |
 中
中 的键能为
的键能为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】完成下列问题。
(1)已知:H-H键的键能为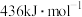 ,H-N键的键能为
,H-N键的键能为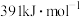 ,根据化学方程式:
,根据化学方程式: 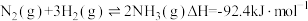
①请计算出 键的键能为
键的键能为_______ 。
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入 和
和 ,充分反应后,恢复原温度时放出的热量
,充分反应后,恢复原温度时放出的热量_______ 92.4kJ(填大于或小于或等于)。
(2)已知反应:
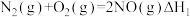
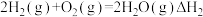
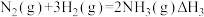
利用上述三个反应,计算 的反应焓变为
的反应焓变为_______ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(3)反应①: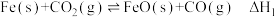 ,平衡常数为
,平衡常数为 ;
;
反应②: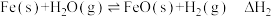 ,平衡常数为
,平衡常数为 ;
;
在不同温度时 、
、 的值如下表:
的值如下表:
反应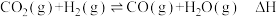 ,则其平衡常数
,则其平衡常数
_______ (用 和
和 表示),且由上述计算可知,反应
表示),且由上述计算可知,反应 是
是_______ 反应(填“吸热”或“放热”)。
(4)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 气体,发生反应
气体,发生反应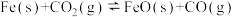 ,
, 的浓度与时间的关系如图所示。
的浓度与时间的关系如图所示。

该条件下反应的平衡常数为_______ ;若铁粉足量, 的起始浓度为
的起始浓度为 ,则平衡时
,则平衡时 的浓度为
的浓度为_______  ,若此时再往容器中(体积不变)加入1mol/L
,若此时再往容器中(体积不变)加入1mol/L  和1mol/L CO,则平衡
和1mol/L CO,则平衡_______ (填“正向移动”,“逆向移动”或者“不移动”)
(1)已知:H-H键的键能为
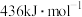 ,H-N键的键能为
,H-N键的键能为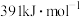 ,根据化学方程式:
,根据化学方程式: 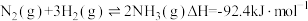
①请计算出
 键的键能为
键的键能为②若向处于上述热化学方程式相同温度和体积一定的容器中,通入
 和
和 ,充分反应后,恢复原温度时放出的热量
,充分反应后,恢复原温度时放出的热量(2)已知反应:
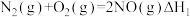
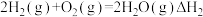
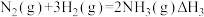
利用上述三个反应,计算
 的反应焓变为
的反应焓变为 、
、 、
、 的式子表示)。
的式子表示)。(3)反应①:
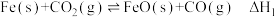 ,平衡常数为
,平衡常数为 ;
;反应②:
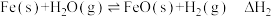 ,平衡常数为
,平衡常数为 ;
;在不同温度时
 、
、 的值如下表:
的值如下表:| 700℃ | 900℃ | |
 | 1.47 | 2.15 |
 | 2.38 | 1.67 |
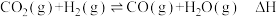 ,则其平衡常数
,则其平衡常数
 和
和 表示),且由上述计算可知,反应
表示),且由上述计算可知,反应 是
是(4)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的
 气体,发生反应
气体,发生反应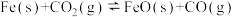 ,
, 的浓度与时间的关系如图所示。
的浓度与时间的关系如图所示。
该条件下反应的平衡常数为
 的起始浓度为
的起始浓度为 ,则平衡时
,则平衡时 的浓度为
的浓度为 ,若此时再往容器中(体积不变)加入1mol/L
,若此时再往容器中(体积不变)加入1mol/L  和1mol/L CO,则平衡
和1mol/L CO,则平衡
您最近一年使用:0次



