(1)碳可以形成CO、CO2、H2CO3等多种无机化合物。
①国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,CO2原子晶体的晶胞如图所示,下列关于CO2的原子晶体说法正确的是_______ (填字母)。

A.CO2原子晶体的熔点比SiO2晶体低
B.1molCO2原子晶体和1molCO2分子晶体均有2mol共价键
C.在一定条件下,CO2原子晶体转化为CO2分子晶体属于化学变化
②在反应CO转化成CO2的过程中,下列说法正确的是_______ (填字母)。
A.每个分子中孤对电子数不变 B.分子极性变化 C.原子间成键方式改变
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子结构式为_______ ,写出一种与氨硼烷互为等电子体的分子_______ (填化学式)。
(3)硼酸(B(OH)3)本身不能电离出H+,因在水中能生成[B(OH)4]-而体现弱酸性,请写出硼酸溶于水呈酸性的离子方程式_______ 。
(4)Na3OCl是一种良好的离子半导体,Na3OCl晶体属于立方晶系,晶胞结构如图所示,Na3OCl晶胞中,Cl位于各顶点位置,则Na位于_______ 位置(填“顶点”,“体心”或“面心”)。晶胞有两种基本要素,其中一种是原子坐标参数,表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),B为(0.5,0.5,0),则C点的原子坐标参数为_______ 。
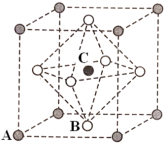

①国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,CO2原子晶体的晶胞如图所示,下列关于CO2的原子晶体说法正确的是

A.CO2原子晶体的熔点比SiO2晶体低
B.1molCO2原子晶体和1molCO2分子晶体均有2mol共价键
C.在一定条件下,CO2原子晶体转化为CO2分子晶体属于化学变化
②在反应CO转化成CO2的过程中,下列说法正确的是
A.每个分子中孤对电子数不变 B.分子极性变化 C.原子间成键方式改变
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子结构式为
(3)硼酸(B(OH)3)本身不能电离出H+,因在水中能生成[B(OH)4]-而体现弱酸性,请写出硼酸溶于水呈酸性的离子方程式
(4)Na3OCl是一种良好的离子半导体,Na3OCl晶体属于立方晶系,晶胞结构如图所示,Na3OCl晶胞中,Cl位于各顶点位置,则Na位于


更新时间:2021-04-30 07:17:09
|
相似题推荐
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】X、Y、Z、W、M、R是原子半径依次增大的前四周期元素,X只有1个s轨道且含有单电子;Y电负性最大;Z和M同主族且Z的p轨道半充满,W和Y同主族;R的d轨道上有两个单电子且价电子数为10.回答下列问题:
(1)基态R原子价电子排布式为___________ ,同周期中未成对电子数与R相同的元素有___________ 种。
(2) 中心原子的杂化方式为
中心原子的杂化方式为___________ , 中心原子的杂化方式为
中心原子的杂化方式为___________ ,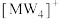 的空间结构为
的空间结构为___________ 。
(3)键角:
___________  (填“>”或“<”,下同),沸点:
(填“>”或“<”,下同),沸点:
___________  。
。
(4)Y的气态氢化物水溶液中存在___________ 种氢键。
(5)向含1mol八面体的配合物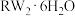 中加足量
中加足量 溶液,无白色沉淀产生,则该配合物内界的化学式为
溶液,无白色沉淀产生,则该配合物内界的化学式为___________ 。
(1)基态R原子价电子排布式为
(2)
 中心原子的杂化方式为
中心原子的杂化方式为 中心原子的杂化方式为
中心原子的杂化方式为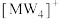 的空间结构为
的空间结构为(3)键角:

 (填“>”或“<”,下同),沸点:
(填“>”或“<”,下同),沸点:
 。
。(4)Y的气态氢化物水溶液中存在
(5)向含1mol八面体的配合物
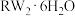 中加足量
中加足量 溶液,无白色沉淀产生,则该配合物内界的化学式为
溶液,无白色沉淀产生,则该配合物内界的化学式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】六方晶胞是一种常见晶胞,镁、钛和镍的常见晶胞属于六方晶胞。
(1)①Ni位于元素周期表中的分区是_______ ;
②写出Ti的基态原子价电子排布式_______ ;
③Na、Mg、Al的第一电离能如下表:
请解释其变化规律的原因_______ 。
(2)已知MgCl2和TiCl4的熔沸点(℃)如下表:
请解释MgCl2和TiCl4熔沸点差异的原因:_______ 。TiCl4的熔沸点明显偏低的另一个原因是该分子空间构型是_______ ,分子高度对称,没有极性,分子间作用力很弱。
(3)如图为Ni和As形成的某种晶体的六方晶胞图,该化合物的化学式为_______ ;已知晶胞参数分别为apm、apm、bpm和 ,则该晶胞的密度为
,则该晶胞的密度为_______ g·cm-3(设阿伏加德罗常数的值为NA)。

(1)①Ni位于元素周期表中的分区是
②写出Ti的基态原子价电子排布式
③Na、Mg、Al的第一电离能如下表:
| 元素 | Na | Mg | Al |
| I1/(kJ·mol-1) | 496 | 738 | 577 |
请解释其变化规律的原因
(2)已知MgCl2和TiCl4的熔沸点(℃)如下表:
| 物质 | MgCl2 | TiCl4 |
| 熔点 | 712 | -241 |
| 沸点 | 1412 | 136.4 |
请解释MgCl2和TiCl4熔沸点差异的原因:
(3)如图为Ni和As形成的某种晶体的六方晶胞图,该化合物的化学式为
 ,则该晶胞的密度为
,则该晶胞的密度为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】C、N和Si能形成多种高硬度材料,如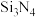 、
、 、SiC
、SiC
(1) 和
和 中硬度较高的是
中硬度较高的是______ ,理由是______ 。
(2) 和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为
和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______ ,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______ 。
(3) 和N能形成一种五元环状有机物咪唑
和N能形成一种五元环状有机物咪唑 简写为
简写为 ,其结构为
,其结构为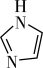
 化合物
化合物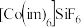 的结构示意图如图2:
的结构示意图如图2:
①阳离子 和
和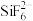 之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:
之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______ 。 例如水中氢键的表示式为
例如水中氢键的表示式为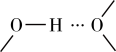

②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”
键” ,则im分子中存在的“离域
,则im分子中存在的“离域 键”是
键”是______ 。
(4)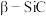 为立方晶系晶体,该晶胞中原子的坐标参数为
为立方晶系晶体,该晶胞中原子的坐标参数为
C: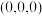 ;
;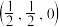 ;
;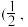 0,
0, ,
, ;
;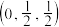 ;
;
Si: ;
;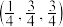 ;
;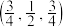 ;
;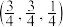
则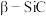 立方晶胞中含有
立方晶胞中含有______ 个Si原子、______ 个C原子。
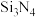 、
、 、SiC
、SiC
(1)
 和
和 中硬度较高的是
中硬度较高的是(2)
 和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为
和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为(3)
 和N能形成一种五元环状有机物咪唑
和N能形成一种五元环状有机物咪唑 简写为
简写为 ,其结构为
,其结构为
 化合物
化合物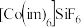 的结构示意图如图2:
的结构示意图如图2:①阳离子
 和
和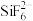 之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:
之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式: 例如水中氢键的表示式为
例如水中氢键的表示式为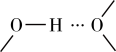

②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域
 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”
键” ,则im分子中存在的“离域
,则im分子中存在的“离域 键”是
键”是(4)
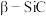 为立方晶系晶体,该晶胞中原子的坐标参数为
为立方晶系晶体,该晶胞中原子的坐标参数为C:
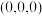 ;
;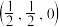 ;
;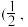 0,
0, ,
, ;
;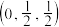 ;
;
Si:
 ;
;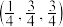 ;
;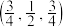 ;
;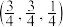
则
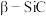 立方晶胞中含有
立方晶胞中含有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】C、N和Si能形成多种高硬度材料,如SiN4、C3N4、SiC
(1)Si3N4和C3N4中硬度较高的是________ ,理由是_____________ 。
(2)C和N能形成一种类石墨结构材料,其合成过程如下图所示。该类石墨结构材料化合物的化学式为_______ ,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有________ 。

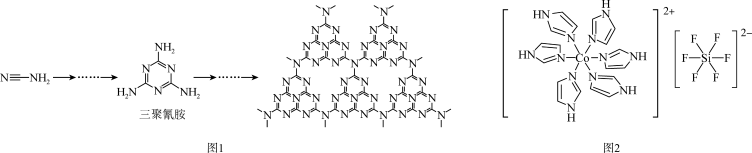
(3)C和N能形成一种五元环状有机物咪唑(简写为im),其结构为 。化合物[Co(im)6]SiF6的结构示意图如下:
。化合物[Co(im)6]SiF6的结构示意图如下:

①阳离子[Co(im)6]2+和SiF62—之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:_______ 。(例如水中氢键的表示式为 )
)
②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键” π34,则im分子中存在的“离域π键”是______ 。
(4) -SiC为立方晶系晶体,该晶胞中原子的坐标参数为
-SiC为立方晶系晶体,该晶胞中原子的坐标参数为
C:(0,0,0); ;
; ;
; ;……
;……
Si: ;
; ;
; ;
;
则 -SiC立方晶胞中含有
-SiC立方晶胞中含有_____ 个Si原子、________ 个C原子。
(1)Si3N4和C3N4中硬度较高的是
(2)C和N能形成一种类石墨结构材料,其合成过程如下图所示。该类石墨结构材料化合物的化学式为

(3)C和N能形成一种五元环状有机物咪唑(简写为im),其结构为
 。化合物[Co(im)6]SiF6的结构示意图如下:
。化合物[Co(im)6]SiF6的结构示意图如下:
①阳离子[Co(im)6]2+和SiF62—之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:
 )
)②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键” π34,则im分子中存在的“离域π键”是
(4)
 -SiC为立方晶系晶体,该晶胞中原子的坐标参数为
-SiC为立方晶系晶体,该晶胞中原子的坐标参数为C:(0,0,0);
 ;
; ;
; ;……
;……Si:
 ;
; ;
; ;
;
则
 -SiC立方晶胞中含有
-SiC立方晶胞中含有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】据科技日报道南开大学科研团队借助镍和苯基硼酸共催化剂,实现丙烯醇绿色合成。丙烯醇及其化合物可合成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的丙烯醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的电子排布式为________ 。
(2)1molCH2=CH-CH2OH中σ键和π键的个数比为_____ ,丙烯醇分子中碳原子的杂化类型为_____ 。
(3)丙醛(CH3CH2CHO的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是_______ 。
(4)羰基镍[Ni(CO)4]用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是___________ 。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]-和[Ni(CN)4]2-等。[Ni(NH3)6]2+中心离子的配位数是______ ,与SCN-互为等电子体的分子为_______ 。
(6)“NiO”晶胞如图所示。

①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为______ 。
②已知:氧化镍晶胞密度为dg/cm3,NA代表阿伏伽德罗常数的值,则Ni2+半径为______ nm(用代数式表示)。【Ni的相对原子质量为59】
(1)基态镍原子的电子排布式为
(2)1molCH2=CH-CH2OH中σ键和π键的个数比为
(3)丙醛(CH3CH2CHO的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是
(4)羰基镍[Ni(CO)4]用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]-和[Ni(CN)4]2-等。[Ni(NH3)6]2+中心离子的配位数是
(6)“NiO”晶胞如图所示。

①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为
②已知:氧化镍晶胞密度为dg/cm3,NA代表阿伏伽德罗常数的值,则Ni2+半径为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】(1)氨易溶于水的原因是_______ ;_______ (写出两点即可)。
(2)化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越_______ (填“强”或“弱”)。以下各种含氧酸①H3RO4、②(HO)RO3、③H4RO4、④(HO)2RO2的酸性由强到弱的顺序排列为_______ (填序号)。
(3)为了减缓温室效应,科学家设计反应CO2+4H2=CH4+2H2O以减少空气中CO2的排放量。若有1 mol CH4生成,则有_______ mol σ键和_______ mol π键断裂。
(4)已知氮元素是植物生长所需的元素,常见氮肥有铵盐(NH )、尿素
)、尿素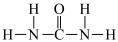 等
等
①尿素分子中四种元素的电负性由大到小顺序是_______ 。
②NH 中H-N-H键角比NH3中H-N-H键角大,原因为
中H-N-H键角比NH3中H-N-H键角大,原因为_______ 。
(5)①与H2O分子互为等电子体的阴离子为_______
②[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_______ 。
(6)根据对角线规则,铍(Be)与铝性质相似。对铍及其化合物的推断肯定不正确的是_______
a.常温下铍会在浓硫酸中钝化 b.氯化铍是共价化合物
c.氧化铍坚硬难熔 d.氢氧化铍是强碱
(2)化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越
(3)为了减缓温室效应,科学家设计反应CO2+4H2=CH4+2H2O以减少空气中CO2的排放量。若有1 mol CH4生成,则有
(4)已知氮元素是植物生长所需的元素,常见氮肥有铵盐(NH
 )、尿素
)、尿素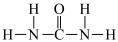 等
等①尿素分子中四种元素的电负性由大到小顺序是
②NH
 中H-N-H键角比NH3中H-N-H键角大,原因为
中H-N-H键角比NH3中H-N-H键角大,原因为(5)①与H2O分子互为等电子体的阴离子为
②[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
(6)根据对角线规则,铍(Be)与铝性质相似。对铍及其化合物的推断肯定不正确的是
a.常温下铍会在浓硫酸中钝化 b.氯化铍是共价化合物
c.氧化铍坚硬难熔 d.氢氧化铍是强碱
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)X、Y、Z、W形成的有机物YW(ZX2)2中Y、Z的杂化轨道类型分别____ 。
(2)Y、R的最高价氧化物的沸点较高的是___ (填化学式)。
(3)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,写出形成深蓝色离子符号____ 。
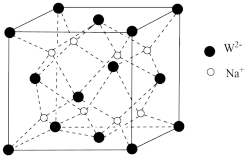
(4)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为____ (填化学式)。Na+的配位数为___ 。已知该晶胞的密度为ρg·cm3,阿伏加德罗常数为NA,则两个最近的W离子间距离为cm。(用含ρ、NA的计算式表示,只写表达式)

(1)X、Y、Z、W形成的有机物YW(ZX2)2中Y、Z的杂化轨道类型分别
(2)Y、R的最高价氧化物的沸点较高的是
(3)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,写出形成深蓝色离子符号
(4)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、二氧化碳、青霉素、硝酸钾、乙醇、氨等“分子”改变过人类的世界。
(1)铁原子在基态时,外围电子排布式为____________ 。
(2)CO2的电子式为____________ ,1 mol CO2分子中含有σ键的物质的量为____________ 。
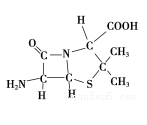
(3)6-氨基青霉烷酸的结构如图所示:
①其中C、N、O原子半径的大小关系为____________ ,电负性的大小关系为____________ ;
②其中采用sp3杂化的原子有C、____________ 。
(4)硝酸钾中NO3-的空间构型为____________ ,写出与NO3-互为等电子体的一种由前二周期元素原子构成的非极性分子化学式____________ 。
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是____________ 。
(6)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,若两个最近的Fe原子间的距离为a cm,则该晶体的密度计算式为____________ g/cm3(用NA表示阿伏伽德罗常数)。
(1)铁原子在基态时,外围电子排布式为
(2)CO2的电子式为
(3)6-氨基青霉烷酸的结构如图所示:
①其中C、N、O原子半径的大小关系为
②其中采用sp3杂化的原子有C、
(4)硝酸钾中NO3-的空间构型为
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是
(6)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,若两个最近的Fe原子间的距离为a cm,则该晶体的密度计算式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】黄铜矿是一种重要的化工原料,主要成分是CuFeS2,另外还有少量的氧化铝、二氧化硅及水分,通过化学工艺可获得许多化工产品。
(1)铜元素位于元素周期表中_________ (填写周期、族);基态Fe原子的价层电子轨道表达式为_____ ;
(2)硫位于第VIA 族,该族元素氢化物沸点由低到高的顺序及原因是_________ (必要化学用语及文字简答)。
(3)基态氮原子的第一电离能大于氧原子的第一电离能的原因是__________ 。
(4)由铝和氯元素组成的化合物熔点190℃、在熔融态不导电;该化合物易升华,其蒸气密度是相同条件下氢气的133.5倍。请写出其蒸气分子的结构式______________ (如有配位键,请 用“→”表 示 )。(5)黄铜矿在空气中高温灼烧可以得到固体混合物和废气,固体混合物中有X和Y两化合物。固体化合物X的晶胞模型如图甲所示:
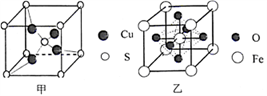
①化合物X的化学式:___________ ;
②废气中SO2经催化氧化生成SO3,SO3分子中硫原子杂化方式为___________ ;SO3分子空间构型是___________ 。
(6)黄铜矿高温灼烧得到的另一固体化合物Y的晶胞模型如图乙,已知丫晶体密度为ρg/cm3,则Y 晶体中晶胞边长是_____ cm。
(1)铜元素位于元素周期表中
(2)硫位于第VIA 族,该族元素氢化物沸点由低到高的顺序及原因是
(3)基态氮原子的第一电离能大于氧原子的第一电离能的原因是
(4)由铝和氯元素组成的化合物熔点190℃、在熔融态不导电;该化合物易升华,其蒸气密度是相同条件下氢气的133.5倍。请写出其蒸气分子的结构式

①化合物X的化学式:
②废气中SO2经催化氧化生成SO3,SO3分子中硫原子杂化方式为
(6)黄铜矿高温灼烧得到的另一固体化合物Y的晶胞模型如图乙,已知丫晶体密度为ρg/cm3,则Y 晶体中晶胞边长是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)请写出元素o的基态原子电子排布式_______ 。
(2)d的氢化物的分子构型为_____ ;k在空气中燃烧产物的中心原子的杂化形式为____ ,该分子是______ (填“极性”或“非极性”)分子。
(3)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是_____ (填具体物质),试从结构角度加以解释______
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知i的原子半径为d,NA代表阿伏加 德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为______ 。
②该晶体的密度为______ (用字母表示)。

试回答下列问题:
(1)请写出元素o的基态原子电子排布式
(2)d的氢化物的分子构型为
(3)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知i的原子半径为d,NA代表阿伏加 德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为
②该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】(1)Fe(CO)5中铁的化合价为0,写出铁原子的简化的基态电子排布式______ ,Fe在周期表中第______ 周期______ 族,属于_______ 区。
(2)已知Fe(CO)5常温下呈液态,熔点为﹣20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体为________ (填晶体类型)。
(3)金属铁单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。

体心立方晶胞和面心立方晶胞中实际含有的铁原子个数之比为________ ;Fe原子配位数之比为____ 。若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞密度之比为_______ 。
(4)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如图所示(黑点代表铜原子,空心圆代表Y原子)。
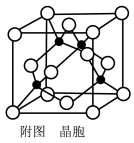
①该晶体的化学式为________ 。(用元素符号表示)
②已知该晶体的密度为ρ g/cm3,阿伏加 德罗常数为NA,则该晶胞边长为______ nm(只写计算式)。
(2)已知Fe(CO)5常温下呈液态,熔点为﹣20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体为
(3)金属铁单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。

体心立方晶胞和面心立方晶胞中实际含有的铁原子个数之比为
(4)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如图所示(黑点代表铜原子,空心圆代表Y原子)。

①该晶体的化学式为
②已知该晶体的密度为ρ g/cm3,阿伏加 德罗常数为NA,则该晶胞边长为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐3】A、B、C、D、E、F六种元素均是短周期元素,且原子序数依次增大。B、F原子的最外层电子数均为其电子层数的两倍,D、F元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙均能反应(相对分子质量甲<乙)转化关系如图(反应条件略去),元素E形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:
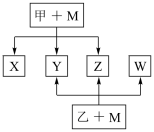
(1)写出M与甲的浓溶液加热时反应的化学方程式___________
(2)X、Y、Z、W属于同一类物质,这类化合物通常熔沸点较___________ (填“高”或“低”); X、Y、W都能与Z反应,则Z的结构式为___________
(3)将X、W与D2按1∶1∶n的物质的量之比通入Z中,充分反应后无气体剩余或生成,则n=___________ ,写出反应的化学方程式___________
(4)化合物ED2与元素B形成的某种单质能在高温下能发生置换反应,若反应中有1mol电子发生了转移,则参加反应的化合物ED2的质量为___________ g。
(5)元素B的另一种单质能导电,具有平面层状结构,同一层中的原子构成许许多多的正六边形,则12g该单质中含有___________ NA个正六边形。

(1)写出M与甲的浓溶液加热时反应的化学方程式
(2)X、Y、Z、W属于同一类物质,这类化合物通常熔沸点较
(3)将X、W与D2按1∶1∶n的物质的量之比通入Z中,充分反应后无气体剩余或生成,则n=
(4)化合物ED2与元素B形成的某种单质能在高温下能发生置换反应,若反应中有1mol电子发生了转移,则参加反应的化合物ED2的质量为
(5)元素B的另一种单质能导电,具有平面层状结构,同一层中的原子构成许许多多的正六边形,则12g该单质中含有
您最近一年使用:0次



