C、N和Si能形成多种高硬度材料,如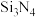 、
、 、SiC
、SiC
(1)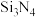 和
和 中硬度较高的是
中硬度较高的是______ ,理由是______ 。
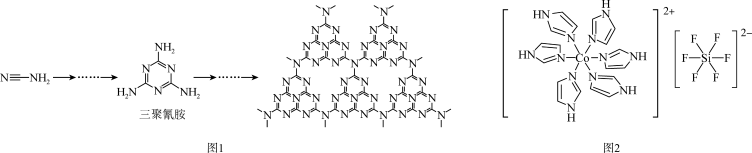
(2) 和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为
和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______ ,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______ 。
(3) 和N能形成一种五元环状有机物咪唑
和N能形成一种五元环状有机物咪唑 简写为
简写为 ,其结构为
,其结构为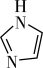
 化合物
化合物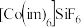 的结构示意图如图2:
的结构示意图如图2:
①阳离子 和
和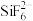 之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:
之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______ 。 例如水中氢键的表示式为
例如水中氢键的表示式为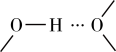

②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”
键” ,则im分子中存在的“离域
,则im分子中存在的“离域 键”是
键”是______ 。
(4)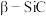 为立方晶系晶体,该晶胞中原子的坐标参数为
为立方晶系晶体,该晶胞中原子的坐标参数为
C: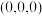 ;
;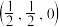 ;
;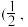 0,
0, ,
, ;
;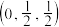 ;
;
Si: ;
;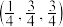 ;
;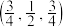 ;
;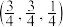
则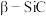 立方晶胞中含有
立方晶胞中含有______ 个Si原子、______ 个C原子。
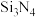 、
、 、SiC
、SiC
(1)
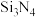 和
和 中硬度较高的是
中硬度较高的是(2)
 和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为
和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为(3)
 和N能形成一种五元环状有机物咪唑
和N能形成一种五元环状有机物咪唑 简写为
简写为 ,其结构为
,其结构为
 化合物
化合物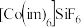 的结构示意图如图2:
的结构示意图如图2:①阳离子
 和
和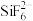 之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:
之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式: 例如水中氢键的表示式为
例如水中氢键的表示式为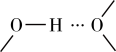

②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域
 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”
键” ,则im分子中存在的“离域
,则im分子中存在的“离域 键”是
键”是(4)
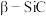 为立方晶系晶体,该晶胞中原子的坐标参数为
为立方晶系晶体,该晶胞中原子的坐标参数为C:
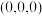 ;
;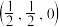 ;
;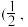 0,
0, ,
, ;
;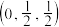 ;
;
Si:
 ;
;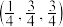 ;
;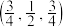 ;
;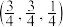
则
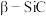 立方晶胞中含有
立方晶胞中含有
更新时间:2020-01-13 16:22:25
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】(10分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的外围电子排布式为____________ 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式__ 、__ 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③ 、④HCHO,其中碳原子采取sp2杂化的分子有
、④HCHO,其中碳原子采取sp2杂化的分子有___
(填物质序号),HCHO分子的立体结构为___ 形。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为__________ 。

(5)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如上右图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。_________
(1)基态镍原子的外围电子排布式为
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③
 、④HCHO,其中碳原子采取sp2杂化的分子有
、④HCHO,其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为

(5)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如上右图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】我国科学家在铁基超导研究方面取得了一系列的重大突破,标志着我国在凝聚态物理领域已经成为一个强国。LiZnAs 是研究铁基超导材料的重要前体。
(1)LiZnAs 中三种元素的电负性从小到大的顺序为_____ 。
(2)AsF3分子的空间构型为_____ ,As 原子的杂化轨道类型为_____ 。
(3)CO 分子内因配位键的存在,使 C 原子上的电子云密度较高而易与血红蛋白结合, 导致 CO 有剧毒。1mol[Zn(CN)4]2-离子内含有的共价键的数目为_____ ,配原子为_____ 。
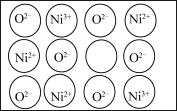
(4)镍的氧化物常用作电极材料的基质。纯粹的 NiO 晶体的结构与 NaCl 的晶体结构相同,为获得更好的导电能力,将纯粹的 NiO 晶体在空气中加热,使部分 Ni2+被氧化成 Ni3+后, 每个晶胞内 O2-的数目和位置均未发生变化,镍离子的位置虽然没变,但其数目减少,造成晶体内产生阳离子空位(如图所示)。化学式为 NiO 的某镍氧化物晶体,阳离子的平均配位数为__________ ,阴离子的平均配位数与纯粹的 NiO 晶体相比____________ (填“增大”“减小”或“不变””,写出能体现镍元素化合价的该晶体的化学式________ 示例:Fe3O4写作 Fe2+Fe23+O4)。
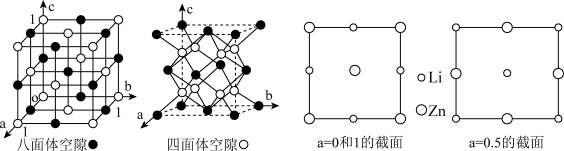
(5)所有的晶体均可看作由某些微粒按一定的方式堆积,另外的某些微粒填充在上述堆 积所形成的空隙中。在面心立方紧密堆积的晶胞中存在两种类型的空隙:八面体空隙和四面体空隙(如下左图所示)。在 LiZnAs 立方晶胞中,Zn 以面心立方形式堆积,Li 和 As 分别填充在 Zn 原子围成的八面体空隙和四面体空隙中,在 a=0,0.5 和 1 三个截面上 Zn 和 Li 按下图所示分布:请在下图 As 原子所在的截面上用“Δ”补画出 As 原子的位置,______________ 并说明 a=__________ 。
(1)LiZnAs 中三种元素的电负性从小到大的顺序为
(2)AsF3分子的空间构型为
(3)CO 分子内因配位键的存在,使 C 原子上的电子云密度较高而易与血红蛋白结合, 导致 CO 有剧毒。1mol[Zn(CN)4]2-离子内含有的共价键的数目为
(4)镍的氧化物常用作电极材料的基质。纯粹的 NiO 晶体的结构与 NaCl 的晶体结构相同,为获得更好的导电能力,将纯粹的 NiO 晶体在空气中加热,使部分 Ni2+被氧化成 Ni3+后, 每个晶胞内 O2-的数目和位置均未发生变化,镍离子的位置虽然没变,但其数目减少,造成晶体内产生阳离子空位(如图所示)。化学式为 NiO 的某镍氧化物晶体,阳离子的平均配位数为

(5)所有的晶体均可看作由某些微粒按一定的方式堆积,另外的某些微粒填充在上述堆 积所形成的空隙中。在面心立方紧密堆积的晶胞中存在两种类型的空隙:八面体空隙和四面体空隙(如下左图所示)。在 LiZnAs 立方晶胞中,Zn 以面心立方形式堆积,Li 和 As 分别填充在 Zn 原子围成的八面体空隙和四面体空隙中,在 a=0,0.5 和 1 三个截面上 Zn 和 Li 按下图所示分布:请在下图 As 原子所在的截面上用“Δ”补画出 As 原子的位置,


您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)基态碳原子核外电子有__ 种空间运动状态,其价电子排布图为__ .
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为__ ,其碳原子杂化轨道类型为_____ 杂化.
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?。 ______________
(4)碳的一种同素异形体﹣﹣C60,又名足球烯,是一种高度对称的球碳分子.立方烷(分子式:C8H8结构是立方体: 是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间八面体空隙中.则该复合型分子晶体的组成用二者的分子式可表示为
是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间八面体空隙中.则该复合型分子晶体的组成用二者的分子式可表示为__ 。

(5)碳的另一种同素异形体——石墨,其晶体结构如图所示,则石墨晶胞含碳原子个数为__ 个.已知石墨的密度为ρg·cm﹣3,C﹣C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为__ cm.
(6)金刚石和石墨的物理性质差异很大,其中:熔点较高的是___________ ,试从结构分析___________ ;硬度大的是___________ ,其结构原因是___________ 。
(1)基态碳原子核外电子有
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
(4)碳的一种同素异形体﹣﹣C60,又名足球烯,是一种高度对称的球碳分子.立方烷(分子式:C8H8结构是立方体:
 是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间八面体空隙中.则该复合型分子晶体的组成用二者的分子式可表示为
是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间八面体空隙中.则该复合型分子晶体的组成用二者的分子式可表示为
(5)碳的另一种同素异形体——石墨,其晶体结构如图所示,则石墨晶胞含碳原子个数为
(6)金刚石和石墨的物理性质差异很大,其中:熔点较高的是
您最近一年使用:0次
【推荐1】芯片作为科技产业,以及信息化、数字化的基础,一直倍受关注。芯片制造会经过六个最为关键的步骤;沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。
(1)“沉积”是将导体、绝缘体或半导体材料薄膜沉积到纯硅晶圆上。GaN、GaAs是制造芯片的新型半导体材料。___________ 。
②GaN、GaP、GaAs熔融状态均不导电,据此判断它们是___________ 化合物。它们的晶体结构与金刚石相似,试分析GaN、GaP、GaAs熔点由大到小的顺序为___________ 。
③GaAs的晶体结构如图甲(白色球为Ga原子)所示,1molGaAs中配位键的数目为___________ 。
(2)“光刻胶涂覆”中用到一种701紫外正型光刻胶,结构如图乙所示,其S原子的杂化方式为___________ 。

(3)“光刻”时,紫外负型光刻胶常含有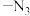 (叠氮基),在紫外光下可以形成阴离子
(叠氮基),在紫外光下可以形成阴离子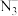 ,
,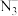 的等电子体有
的等电子体有___________ (填化学式,写出一种即可),其空间构型为___________ 。
(4)“刻蚀”过程可能用到刻蚀剂HF, 及清洗剂
及清洗剂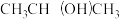 ,三种物质中属于第二周期的元素电负性由大到小的顺序为
,三种物质中属于第二周期的元素电负性由大到小的顺序为___________ 。氢氟酸是弱酸,在水溶液中存在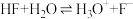 ,
,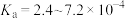 ,但当HF的浓度大于5mol/L时,氢氟酸是一种相当强的酸,请解释原因:
,但当HF的浓度大于5mol/L时,氢氟酸是一种相当强的酸,请解释原因:___________ 。
(5)LiF晶体结构属于氯化钠型,LiF晶体的密度约为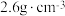 ,LiF晶胞体积V=
,LiF晶胞体积V=___________ cm-3。(列出计算式,设阿伏加德罗常数的值为 )
)
(1)“沉积”是将导体、绝缘体或半导体材料薄膜沉积到纯硅晶圆上。GaN、GaAs是制造芯片的新型半导体材料。

②GaN、GaP、GaAs熔融状态均不导电,据此判断它们是
③GaAs的晶体结构如图甲(白色球为Ga原子)所示,1molGaAs中配位键的数目为
(2)“光刻胶涂覆”中用到一种701紫外正型光刻胶,结构如图乙所示,其S原子的杂化方式为

(3)“光刻”时,紫外负型光刻胶常含有
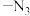 (叠氮基),在紫外光下可以形成阴离子
(叠氮基),在紫外光下可以形成阴离子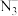 ,
,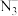 的等电子体有
的等电子体有(4)“刻蚀”过程可能用到刻蚀剂HF,
 及清洗剂
及清洗剂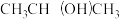 ,三种物质中属于第二周期的元素电负性由大到小的顺序为
,三种物质中属于第二周期的元素电负性由大到小的顺序为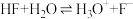 ,
,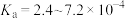 ,但当HF的浓度大于5mol/L时,氢氟酸是一种相当强的酸,请解释原因:
,但当HF的浓度大于5mol/L时,氢氟酸是一种相当强的酸,请解释原因:(5)LiF晶体结构属于氯化钠型,LiF晶体的密度约为
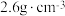 ,LiF晶胞体积V=
,LiF晶胞体积V= )
)
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】合理利用二氧化碳,是减少温室气体的一种科学方法,利用甲醇( )和
)和 可以合成硬的二甲酯:
可以合成硬的二甲酯: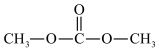 ,回答下面问题:
,回答下面问题:
 个
个 键,碳酸二甲酯固体属于
键,碳酸二甲酯固体属于(2)与
 元素处于同一周期,原子半径和第一电离能都比
元素处于同一周期,原子半径和第一电离能都比 原子大的主族元素
原子大的主族元素 ,其基态原子的价电子排布式为
,其基态原子的价电子排布式为(3)室温下,浓度相同的
 、
、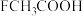 、
、 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为 )的沸点介于水和甲硫醇(
)的沸点介于水和甲硫醇(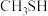 )之间,其原因是
)之间,其原因是(4)将Mn掺杂到GaAs的晶能(甲图)中生成合成碳酸二甲酯的催化剂(乙图),如图所示:
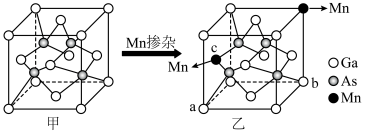
②乙图所示晶胞中Mn、Ga、As的原子个数比为
③已知
 晶胞模型如图所示:
晶胞模型如图所示: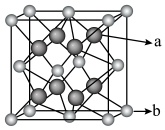
 的摩尔质量为
的摩尔质量为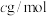 ,晶胞参数为
,晶胞参数为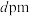 ,阿伏伽德罗常数用
,阿伏伽德罗常数用 表示,写出
表示,写出 晶胞的密度
晶胞的密度
 (用含
(用含 ,
, ,
, 的表达式表示)。
的表达式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜。请回答下列问题。
(1)Fe2+的电子排布式是____________________________ 。
(2)液态SO2可发生自偶电离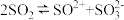 ,SO2属于
,SO2属于_____________ (选填“极性分子”或“非极性分子”), 的空间构型是
的空间构型是___________________ 。
(3)范德华力可分为色散力、诱导力和取向力三类,其中取向力只存在于极性分子和极性分子之间,则H2S的水溶液中存在的取向力有_______ 种。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____________ 。乙硫醇的沸点比乙醇的沸点低,原因是___________ 。
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是______________ ,其密度为_____________ g/cm3(阿伏加 德罗常数的值用NA表示)。

(1)Fe2+的电子排布式是
(2)液态SO2可发生自偶电离
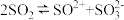 ,SO2属于
,SO2属于 的空间构型是
的空间构型是(3)范德华力可分为色散力、诱导力和取向力三类,其中取向力只存在于极性分子和极性分子之间,则H2S的水溶液中存在的取向力有
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时成对电子数是其未成对电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构。回答下列问题:
(1) Z和X形成的某分子可用作火箭燃料,该分子中Z原子的杂化类型为______ 。
(2)人们已经合成了由Y和Z两种元素形成的晶体,该晶体具有比金刚石更大的硬度,且原子间均以单键结合,Z的配位数是_________ ,该晶体硬度大于金刚石的原因是_____________ 。
(3)Z和X形成的简单分子A还能与很多化合物通过配位键发生相互作用。例如:科学家潜心研究的一种可作储氢材料的化合物 B是A与第二周期另一种元素的氢化物相互作用的产物,B是乙烷的等电子体,化合物B的结构式为________ (必须标明配位键)。
(4)最高价氧化物水化物酸性比Z的比Y的强,原因是__________ ;
(5) Y60用做比金属及其合金更为有效的新型吸氢材料,其分子结构中每一个Y原子皆为SP2杂化,含多个σ键和π键,36gY60最多可以吸收标准状况下的氢气_________ L。
(6)元素W的一种氯化物晶体的晶胞结构如图所示,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为_________________________________________

(1) Z和X形成的某分子可用作火箭燃料,该分子中Z原子的杂化类型为
(2)人们已经合成了由Y和Z两种元素形成的晶体,该晶体具有比金刚石更大的硬度,且原子间均以单键结合,Z的配位数是
(3)Z和X形成的简单分子A还能与很多化合物通过配位键发生相互作用。例如:科学家潜心研究的一种可作储氢材料的化合物 B是A与第二周期另一种元素的氢化物相互作用的产物,B是乙烷的等电子体,化合物B的结构式为
(4)最高价氧化物水化物酸性比Z的比Y的强,原因是
(5) Y60用做比金属及其合金更为有效的新型吸氢材料,其分子结构中每一个Y原子皆为SP2杂化,含多个σ键和π键,36gY60最多可以吸收标准状况下的氢气
(6)元素W的一种氯化物晶体的晶胞结构如图所示,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、A1、Fe及其对应氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(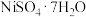 ):
):
回答下列问题:
(1)“碱浸”中NaOH作用之一是洗去油脂,其另一作用是___________ 。
(2)为回收金属,可将过量二氧化碳通入“滤液①”,最终生成沉淀。写出该反应的离子方程式:___________ 。
(3)“转化”中可用于替代 的物质是
的物质是___________ 。
(4)如果“转化”后的溶液中 浓度为
浓度为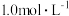 ,则“调pH”应控制pH范围是
,则“调pH”应控制pH范围是___________ 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式:___________ 。
(6)基态Ni原子核外电子排布式为___________ 。F、K和Ni三种元素组成的一种化合物的晶胞如图所示。下列说法错误的是___________ (填标号)。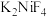
C. 的配位数为6D.该晶体属于分子晶体
的配位数为6D.该晶体属于分子晶体
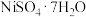 ):
):
| 金属离子 |  | 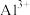 |  |  |
开始沉淀时( )的pH )的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时( )的pH )的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中NaOH作用之一是洗去油脂,其另一作用是
(2)为回收金属,可将过量二氧化碳通入“滤液①”,最终生成沉淀。写出该反应的离子方程式:
(3)“转化”中可用于替代
 的物质是
的物质是(4)如果“转化”后的溶液中
 浓度为
浓度为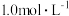 ,则“调pH”应控制pH范围是
,则“调pH”应控制pH范围是(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式:
(6)基态Ni原子核外电子排布式为

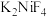
C.
 的配位数为6D.该晶体属于分子晶体
的配位数为6D.该晶体属于分子晶体
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】铼(Re)用于制造高效能火箭引擎。从辉钼矿氧化焙烧后的烟道灰(主要成分有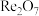 、
、 、
、 、CuO、
、CuO、 )中提取铼粉的一种工艺流程如图所示。
)中提取铼粉的一种工艺流程如图所示。
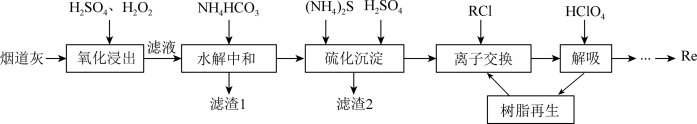
已知:
回答下列问题:
(1)“氧化浸出”时, 被氧化为
被氧化为 ,
, 被氧化的离子方程式为
被氧化的离子方程式为___________ 。
(2)“水解中和”时,加 调节溶液pH=6。
调节溶液pH=6。
① 溶液中
溶液中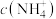
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②除钼的化合物外,滤渣1中还有___________ (填化学式)。
③计算此时溶液中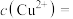
___________  。
。
(3)“硫化沉淀”时,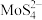 与
与 反应生成难溶的
反应生成难溶的 ,离子方程式为
,离子方程式为___________ 。
(4)“离子交换”“解吸”“树脂再生”一系列步骤中物质转化关系如图所示。
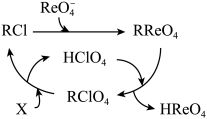
①树脂再生时需加入的试剂X为___________ (填化学式)。
②“解吸”所用 中的阴离子的空间构型为
中的阴离子的空间构型为___________ 。
(5)铼的某种氧化物的晶胞如图所示,该物质的化学式为___________ 。铼原子填在氧原子围成的___________ (填“四面体”、“立方体”或“八面体”)空隙中。

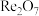 、
、 、
、 、CuO、
、CuO、 )中提取铼粉的一种工艺流程如图所示。
)中提取铼粉的一种工艺流程如图所示。
已知:
 |  |  | |
| 开始沉淀pH | 2.5 | 7.0 | 5.7 |
| 完全沉淀pH | 3.2 | 9.0 | 6.7 |
(1)“氧化浸出”时,
 被氧化为
被氧化为 ,
, 被氧化的离子方程式为
被氧化的离子方程式为(2)“水解中和”时,加
 调节溶液pH=6。
调节溶液pH=6。①
 溶液中
溶液中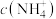
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②除钼的化合物外,滤渣1中还有
③计算此时溶液中
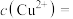
 。
。(3)“硫化沉淀”时,
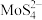 与
与 反应生成难溶的
反应生成难溶的 ,离子方程式为
,离子方程式为(4)“离子交换”“解吸”“树脂再生”一系列步骤中物质转化关系如图所示。

①树脂再生时需加入的试剂X为
②“解吸”所用
 中的阴离子的空间构型为
中的阴离子的空间构型为(5)铼的某种氧化物的晶胞如图所示,该物质的化学式为

您最近一年使用:0次



