海带、紫菜等藻类植物含有丰富的碘元素。某化学实验小组同学从海带中提取碘并计算海带中的碘元素含量,进行以下实验:
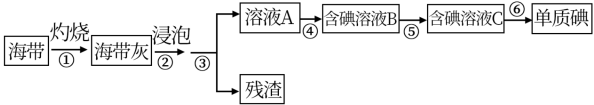
已知:步骤⑥是用反萃取法从碘的四氯化碳溶液中提取碘。
回答下列问题:
(1)在进行步骤①之前,他们称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入___________ 中灼烧至海带完全成灰烬。乙同学认为甲的操作不合理,其理由是___________ 。
(2)海带提碘的一系列操作中需要过滤的步骤是___________ 。
(3)步骤④中,甲同学向溶液A中先滴加几滴淀粉溶液,发现未明显变化,再加入氯水后溶液颜色变蓝,此反应的离子方程式是___________ ;乙同学认为使用稀硫酸和 溶液能更有利于提取碘,其理由
溶液能更有利于提取碘,其理由___________ 。
(4)步骤⑤中用分液漏斗得到碘的四氯化碳溶液,其操作顺序是___________ (填写字母)。
a.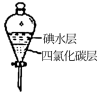 b.
b.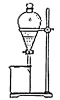
c. d.
d.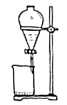
请设计一种简单的实验方法,检验提取碘后的水溶液中还含有单质碘:___________ 。
(5)将得到的单质碘,干燥、称量,其质量为n g:则海带中碘元素的含量为___________ 。

已知:步骤⑥是用反萃取法从碘的四氯化碳溶液中提取碘。
回答下列问题:
(1)在进行步骤①之前,他们称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入
(2)海带提碘的一系列操作中需要过滤的步骤是
(3)步骤④中,甲同学向溶液A中先滴加几滴淀粉溶液,发现未明显变化,再加入氯水后溶液颜色变蓝,此反应的离子方程式是
 溶液能更有利于提取碘,其理由
溶液能更有利于提取碘,其理由(4)步骤⑤中用分液漏斗得到碘的四氯化碳溶液,其操作顺序是
a.
 b.
b.
c.
 d.
d.
请设计一种简单的实验方法,检验提取碘后的水溶液中还含有单质碘:
(5)将得到的单质碘,干燥、称量,其质量为n g:则海带中碘元素的含量为
20-21高一下·山东枣庄·期中 查看更多[5]
山东省枣庄市2020-2021学年高一下学期期中考试化学试题(已下线)期末综合检测卷01【综合检测】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)陕西省西安市雁塔区第二中学、渭北中学2021-2022学年高二下学期期中联考化学试题(已下线)第2章能力提升测评-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)山东省菏泽市单县第二中学2022-2023学年高一下学期3月段考化学试题
更新时间:2021/05/06 10:22:00
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6,人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸。维生素C易被空气中的氧气氧化。在新鲜的水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg/L左右。交中学生的化学竞赛团队曾对某品牌橙汁的Vc含量做了测定,方法与过程大致如下:
①洗涤仪器,检查滴定管是否漏液。润洗后装好标准碘溶液待用。
②向锥形瓶中加入20.00mL待测橙汁(橙黄色),滴入2滴指示剂______。
③用0.007500mol/L的标准碘溶液滴定橙汁。滴定过程中,一手控制滴定管的_________,一手摇晃锥形瓶,眼睛观察___________________________。
反应方程式为:I2+C6H8O6→C6H6O6+2HI
④滴定终点的现象是____________。
⑤消耗标准碘溶液15mL。
(1)根据碘单质特有的性质,本实验应选用_____ 为指示剂。
(2)滴定过程中,一手控制滴定管的___ ,一手摇晃锥形瓶,眼睛观察_______ 。
(3)滴定终点的现象是________ 。
(4)量取20.00mL待测橙汁的实验仪器____ (填“是”或“不是”)量筒。根据实验仪器不同精确度的要求,消耗标准碘溶液15mL中的“15”应修改为_____ mL。
(5)此橙汁中维生素C的含量是___ mg/L。从分析数据看,此橙汁__ 纯天然橙汁(填“是”或“不是”)。
(6)制造商可能采取的做法是________________ 。
①洗涤仪器,检查滴定管是否漏液。润洗后装好标准碘溶液待用。
②向锥形瓶中加入20.00mL待测橙汁(橙黄色),滴入2滴指示剂______。
③用0.007500mol/L的标准碘溶液滴定橙汁。滴定过程中,一手控制滴定管的_________,一手摇晃锥形瓶,眼睛观察___________________________。
反应方程式为:I2+C6H8O6→C6H6O6+2HI
④滴定终点的现象是____________。
⑤消耗标准碘溶液15mL。
(1)根据碘单质特有的性质,本实验应选用
(2)滴定过程中,一手控制滴定管的
(3)滴定终点的现象是
(4)量取20.00mL待测橙汁的实验仪器
(5)此橙汁中维生素C的含量是
(6)制造商可能采取的做法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
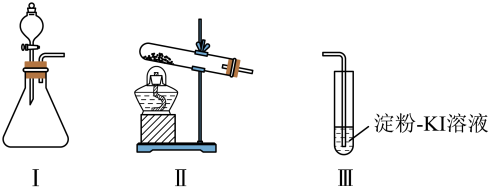
供选试剂: 30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
小组同学设计甲、乙、丙三组实验,记录如下:
(1)请完善甲组实验实验操作,向Ⅰ的锥形瓶中加入MnO2固体,向I的___________ (填仪器名称)中加入 30% H2O2溶液,连接Ⅰ、Ⅲ,打开活塞。
(2)丙实验中O2与KI溶液反应的离子方程式是___________ 。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________ (酸性、 碱性、中性或者其他环境)。
(4)由甲、乙、丙三实验推测,甲实验可能是Ⅰ中的白雾使溶液变蓝。学生将Ⅰ中产生的气体直接通入下列溶液___________(填序号),证明了白雾中含有H2O2。
Ⅱ.为探讨化学反应速率的影响因素,某同学设计的实验方案如下表。(已知I2+2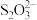 =
=  +2I-,其中Na2S2O3溶液均足量,淀粉遇碘单质变蓝色。)
+2I-,其中Na2S2O3溶液均足量,淀粉遇碘单质变蓝色。)
(5)①该实验进行的目的是___________ 。
②实验①中用Na2S2O3表示反应速率v(Na2S2O3)=___________ 。

供选试剂: 30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
小组同学设计甲、乙、丙三组实验,记录如下:
| 操作 | 现象 | |
| 甲 | 向I的锥形瓶中加入MnO2固体,向I的___________(填仪器名称)中加入 30% H2O2溶液,连接Ⅰ、Ⅲ,打开活塞 | Ⅰ中产生无色气体并伴随大量白雾; Ⅲ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ, 点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
| 丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0. lmol/LH2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是
(4)由甲、乙、丙三实验推测,甲实验可能是Ⅰ中的白雾使溶液变蓝。学生将Ⅰ中产生的气体直接通入下列溶液___________(填序号),证明了白雾中含有H2O2。
| A.酸性KMnO4 | B.FeCl3 | C.氢硫酸 | D.酚酞 |
Ⅱ.为探讨化学反应速率的影响因素,某同学设计的实验方案如下表。(已知I2+2
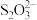 =
=  +2I-,其中Na2S2O3溶液均足量,淀粉遇碘单质变蓝色。)
+2I-,其中Na2S2O3溶液均足量,淀粉遇碘单质变蓝色。)| 实验 序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 0.1mol/L碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | 40 |
| ② | 7.0 | 2.0 | 4.0 | 3.0 | t1 |
| ③ | 5.0 | 2.0 | 4.0 | Vx | t2 |
②实验①中用Na2S2O3表示反应速率v(Na2S2O3)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
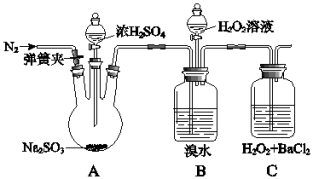
(1)A中发生反应的化学方程式是___________ 。
(2)B中棕色褪色的离子方程式是___________ 。
(3)①甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2.C中产生白色沉淀的离子反应方程式是___________ 。
②乙同学认为不能得出此结论,认为在滴加浓硫酸之前应打开弹簧夹,通入N2,待排净装置内空气后,关闭弹簧夹。
③丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是___________ 。
④将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是___________ 。

| 实验操作 | 实验现象 |
| i.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中棕色褪色,C中有白色沉淀 |
| ii.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| iii.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(2)B中棕色褪色的离子方程式是
(3)①甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2.C中产生白色沉淀的离子反应方程式是
②乙同学认为不能得出此结论,认为在滴加浓硫酸之前应打开弹簧夹,通入N2,待排净装置内空气后,关闭弹簧夹。
③丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是
④将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】如图所示是分离混合物时常用的仪器,回答下列问题:
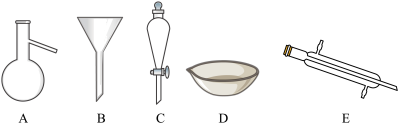
(1)写出仪器C、E的名称分别是___ 、___ 。
(2)下列有机溶剂中不可能作为水溶液萃取剂的是___ (填字母)。
A.汽油 B.CCl4 C.酒精 D.苯

(1)写出仪器C、E的名称分别是
(2)下列有机溶剂中不可能作为水溶液萃取剂的是
A.汽油 B.CCl4 C.酒精 D.苯
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】工业上用异丙苯氧化法合成苯酚,其生产流程如下图:
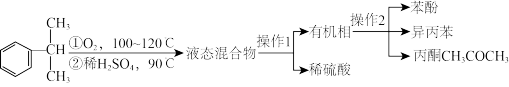
有关物质的性质如下表:
(1)检验有机相中是否含有水的方法是____________ 。
(2)“操作2”的名称是____________ 。
(3)①丙酮中常含有苯酚和异丙苯中的一种或者两种有机物杂质,某同学做了如下检验。检验丙酮中一定存在有机杂质的方法是_________
A.酸性KMnO4溶液,加热 B.乙醇,溶解 C.NaOH溶液(酚酞),加热
②有机物A是丙酮的一种同分异构体,请写出A与银氨溶液反应的化学方程式:_____
(4)某同学对该厂废水进行定量分析。取20.00mL废水于锥形瓶中,水浴加热,用0.1000mol/L酸性KMnO4溶液滴定(假定只有苯酚与酸性KMnO4溶液反应)。达到滴定终点时,消耗KMnO4溶液的体积为10.00mL。有关反应方程式为:5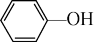 +28KMnO4+42H2SO4
+28KMnO4+42H2SO4 28MnSO4+14K2SO4+30CO2↑+57H2O
28MnSO4+14K2SO4+30CO2↑+57H2O
①滴定终点的现象为________
②该废水中苯酚的含量为________ mg/mL(保留二位有效数字)
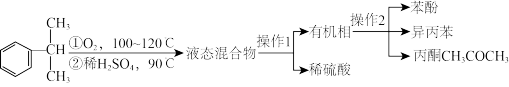
有关物质的性质如下表:
物质 | 沸点 | 溶解性 | 主要化学性质 |
异丙苯 | 152.4℃ | 不溶于水,易溶于酒精。 | 可被强氧化剂氧化 |
苯酚 | 181.8℃ | 微溶于冷水,易溶于热水和酒精等有机溶剂。 | 易被氧化 |
丙酮 | 56.2℃ | 易溶于水和有机溶剂 | 不易被氧化 |
(2)“操作2”的名称是
(3)①丙酮中常含有苯酚和异丙苯中的一种或者两种有机物杂质,某同学做了如下检验。检验丙酮中一定存在有机杂质的方法是
A.酸性KMnO4溶液,加热 B.乙醇,溶解 C.NaOH溶液(酚酞),加热
②有机物A是丙酮的一种同分异构体,请写出A与银氨溶液反应的化学方程式:
(4)某同学对该厂废水进行定量分析。取20.00mL废水于锥形瓶中,水浴加热,用0.1000mol/L酸性KMnO4溶液滴定(假定只有苯酚与酸性KMnO4溶液反应)。达到滴定终点时,消耗KMnO4溶液的体积为10.00mL。有关反应方程式为:5
 +28KMnO4+42H2SO4
+28KMnO4+42H2SO4 28MnSO4+14K2SO4+30CO2↑+57H2O
28MnSO4+14K2SO4+30CO2↑+57H2O①滴定终点的现象为
②该废水中苯酚的含量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
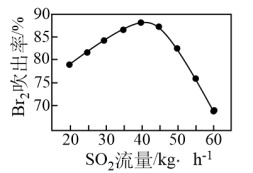
【推荐3】已知海水中溴元素主要以Br-形式存在,工业上从海水中提取溴的流程如下:

(1)写出“氧化”反应的离子方程式:_______ 。
(2)将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,吸收后的空气进行循环利用。
①写出吸收反应的离子方程式:_______ 。
②吹出时,Br2吹出率与吸收塔中SO2流量的关系如图所示。SO2流量过大,Br2吹出率反而下降的原因是_______ 。
(3)对于较低浓度的溴水,可采用萃取的方法提取Br2。四氯化碳可作为Br2的萃取剂,其原因除四氯化碳不与溴反应外,还有_______ 。
(4)除了四氯化碳,还可以选择下列_______ 试剂
A. 苯 B.酒精 C.氢氧化钠溶液

(1)写出“氧化”反应的离子方程式:
(2)将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,吸收后的空气进行循环利用。
①写出吸收反应的离子方程式:
②吹出时,Br2吹出率与吸收塔中SO2流量的关系如图所示。SO2流量过大,Br2吹出率反而下降的原因是

(3)对于较低浓度的溴水,可采用萃取的方法提取Br2。四氯化碳可作为Br2的萃取剂,其原因除四氯化碳不与溴反应外,还有
(4)除了四氯化碳,还可以选择下列
A. 苯 B.酒精 C.氢氧化钠溶液
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】海水是巨大的资源宝库,从海水中提取I2的流程如图:
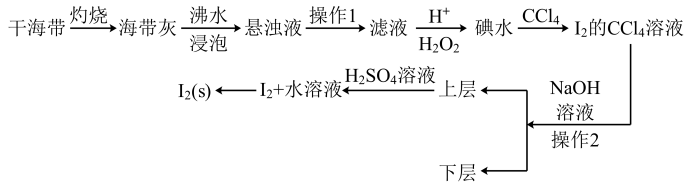
请回答下列问题:
(1)灼烧的目的是______ 。
(2)操作1的名称为_______
(3)滤液中加入H+、H2O2后发生反应的离子方程式为_________
(4)操作2所使用的玻璃仪器为______
(5)若加入NaOH溶液后生成的氧化产物与还原产物的物质的量之比为1:5,则该反应的化学方程式为________

请回答下列问题:
(1)灼烧的目的是
(2)操作1的名称为
(3)滤液中加入H+、H2O2后发生反应的离子方程式为
(4)操作2所使用的玻璃仪器为
(5)若加入NaOH溶液后生成的氧化产物与还原产物的物质的量之比为1:5,则该反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程:
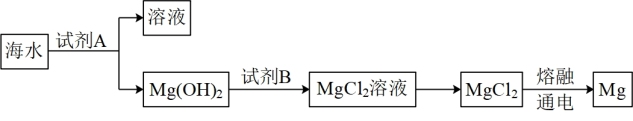
①从悬浊液中将Mg(OH)2分离出来的操作名称为_____________ 。
②Mg(OH)2转化为MgCl2的离子方程式是_____________ 。
③由无水MgCl2制取Mg的化学方程式是_____________ 。
(2)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
①灼烧所用仪器是下列中的哪一种_____________ (填字母序号)。
a. 蒸发皿 b. 坩埚 c. 烧杯
②向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2,请写出该反应的离子方程式:__________________________ 。
③上述反应结束后,可加入萃取剂,采用萃取一分液的方法从碘水中提取碘。下列试剂中可以用于萃取碘单质的是_____________ (填字母序号)。
(1)下图是从海水中提取镁的简单流程:

①从悬浊液中将Mg(OH)2分离出来的操作名称为
②Mg(OH)2转化为MgCl2的离子方程式是
③由无水MgCl2制取Mg的化学方程式是
(2)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧所用仪器是下列中的哪一种
a. 蒸发皿 b. 坩埚 c. 烧杯
②向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2,请写出该反应的离子方程式:
③上述反应结束后,可加入萃取剂,采用萃取一分液的方法从碘水中提取碘。下列试剂中可以用于萃取碘单质的是
a. 乙酸 b. 四氯化碳 c. 硝酸 d. 苯
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
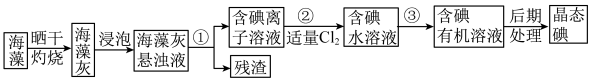
(1)实验室灼烧海藻,需要下列仪器中的____ (填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.三脚架 f.酒精灯
(2)提取碘的过程中,可选择的有机试剂是____ (填字母)。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、醋酸
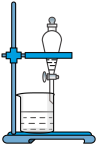
(3)小组用CCl4萃取碘水中的碘,在下图的分液漏斗中,下层液体呈__ 色;他们打开分液漏斗下端旋塞,却未见液体流下,原因可能是__________ 。
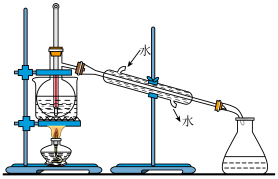
(4)从含碘的有机溶剂中提取碘,还要经过蒸馏,指出下列蒸馏装置中有2处错误,请用文字描述该错误:___ 、___ 。

(1)实验室灼烧海藻,需要下列仪器中的
a.试管 b.烧杯 c.坩埚 d.泥三角 e.三脚架 f.酒精灯
(2)提取碘的过程中,可选择的有机试剂是
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、醋酸
(3)小组用CCl4萃取碘水中的碘,在下图的分液漏斗中,下层液体呈
(4)从含碘的有机溶剂中提取碘,还要经过蒸馏,指出下列蒸馏装置中有2处错误,请用文字描述该错误:
您最近一年使用:0次



