氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的电子轨道排布式是_______ 。
(2)C、N、O三种元素第一电离能从小到大的顺序是_______ 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是_______ 。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1;若该反应中有2 mol N-H键断裂,则形成的π键有_______ mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在_______ (填标号)。
a.离子键 b.共价键 c.范德华力 d.配位键
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是_______ (填标号)。
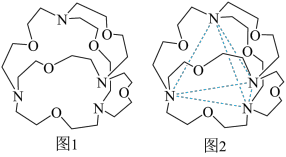
a.CF4 b.NH c.H2O d.CH4
c.H2O d.CH4
(5)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),该分子中所有原子电负性由大到小顺序是_______ 。
(1)基态氮原子的电子轨道排布式是
(2)C、N、O三种元素第一电离能从小到大的顺序是
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1;若该反应中有2 mol N-H键断裂,则形成的π键有
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在
a.离子键 b.共价键 c.范德华力 d.配位键
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是

a.CF4 b.NH
 c.H2O d.CH4
c.H2O d.CH4(5)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),该分子中所有原子电负性由大到小顺序是
更新时间:2021-05-14 15:34:54
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】(1)根据原子结构、元素周期表和元素周期律的知识回答下列问题:
①X是1~36号元素原子核外电子排布中未成对电子数最多的元素,X元素的名称是___ ,在元素周期表中的位置是___ ,位于周期表___ 区。。
②C、N、O、F四种元素第一电离能由大到小的顺序为___ 。
(2)早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
①基态铜原子的电子排布式为___ 。
②CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是___ ;Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___ 个铜原子。
①X是1~36号元素原子核外电子排布中未成对电子数最多的元素,X元素的名称是
②C、N、O、F四种元素第一电离能由大到小的顺序为
(2)早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
①基态铜原子的电子排布式为
②CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】海洋是元素的摇篮,海水中含有的大量元素在生产、生活、科学研究等多方面具有重要作用。回答下列问题。
(1)写出基态溴原子的价电子排布式_______ ,氟、氯、溴、氧四种元素中,电负性由大到小的顺序为_____ (填元素符号) 。
(2) Mg、Al的氟化物晶格能分别是2957 kJ•mol-1、5492 kJ•mol-1,二者相差很大的原因是______ 。
(3) X射线衍射测定等发现,I3AsF6中存在I 离子。I
离子。I 离子的几何构型为
离子的几何构型为_____ ,中心原子的杂化类型为_____ 。
(4) C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上。

①1mol吡啶分子中含有σ键数目是___________ NA。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因___________ 。
③分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为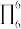 )。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为
)。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为___________ 。
(5) CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示:
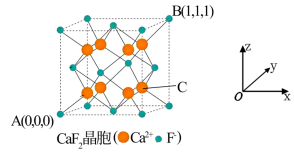
①“ 原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为(________ ,_______ , )
)
②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA,则其密度为____ g•cm-3 (列出计算式即可) 。
(1)写出基态溴原子的价电子排布式
(2) Mg、Al的氟化物晶格能分别是2957 kJ•mol-1、5492 kJ•mol-1,二者相差很大的原因是
(3) X射线衍射测定等发现,I3AsF6中存在I
 离子。I
离子。I 离子的几何构型为
离子的几何构型为(4) C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上。

①1mol吡啶分子中含有σ键数目是
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因
③分子中的大π键可以用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为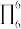 )。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为
)。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为(5) CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示:

①“ 原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为(
 )
)②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA,则其密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】氮及其化合物在生产、生活和科技等方面有着重要的应用。请回答下列问题。
(1)氮原子的原子结构示意图为______ 。
(2)氮气的电子式为______ ,在氮气分子中,氮原子之间存在着______ 个σ键和______ 个π键。
(3)磷、氮、氧是周期表中相邻的三种元素,比较:(均填“大于”“小于”或“等于”)
①氮原子的第一电离能______ 磷原子的第一电离能;
②N2分子中N—N键的键长______ 白磷分子中P—P键的键长。
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述原因是______ 。
(1)氮原子的原子结构示意图为
(2)氮气的电子式为
(3)磷、氮、氧是周期表中相邻的三种元素,比较:(均填“大于”“小于”或“等于”)
①氮原子的第一电离能
②N2分子中N—N键的键长
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述原因是
您最近一年使用:0次
【推荐1】根据信息回答下列问题:
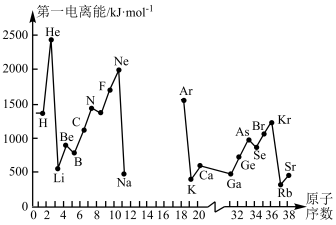
A.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
B.不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:

(1)认真分析信息A图中同周期元素第一电离能的变化规律,推断第三周期Na~Ar这几种元素中,Al的第一电离能的大小范围为______ <Al<________ (填元素符号)。
(2)从信息A图中分析可知,同一主族元素原子的第一电离能I1的变化规律是______________ :
(3)信息A图中第一电离能最小的元素在周期表中的位置是_______ 周期__________ 族。
(4)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有_______ 性,其中Be(OH)2显示这种性质的离子方程式是____________ 。
(5)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围_________ 。
(6)请归纳元素的电负性和金属性、非金属性的关系是__________ 。
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物___________ ,说出理由并写出判断的方法_________ 。
A.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。

B.不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:

(1)认真分析信息A图中同周期元素第一电离能的变化规律,推断第三周期Na~Ar这几种元素中,Al的第一电离能的大小范围为
(2)从信息A图中分析可知,同一主族元素原子的第一电离能I1的变化规律是
(3)信息A图中第一电离能最小的元素在周期表中的位置是
(4)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有
(5)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围
(6)请归纳元素的电负性和金属性、非金属性的关系是
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物
您最近一年使用:0次
【推荐2】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素基态原子的价电子排布式为nsnnpn+1;C元素为周期表中最活泼的非金属元素;D元素原子核外有三个电子层,最外层电子数是核外电子总数的 ;E元素形成的正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层只有一个电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素形成的正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层只有一个电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能__ (填“<”“>”或“=")B元素的第一电离能;A、B、C三种元素的电负性由小到大的顺序为__ (用元素符号表示)。
(2)D元素基态原子的价电子排布式为__ 。
(3)C元素基态原子的轨道表示式为__ ;E3+的离子符号为__ 。
(4)F元素位于元素周期表的__ 区,其基态原子的电子排布式为__ 。
(5)G元素可能的性质是__ (填序号)。
A.其单质可作为半导体材料 B.其电负性大于磷
C.其原子半径大于储 D.其第一电离能小于硒
(6)活泼性D__ (填“>”或“<”,下同)Al;I1(D)_ I1(Al),其原因是__ 。
 ;E元素形成的正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层只有一个电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素形成的正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层只有一个电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。(1)A元素的第一电离能
(2)D元素基态原子的价电子排布式为
(3)C元素基态原子的轨道表示式为
(4)F元素位于元素周期表的
(5)G元素可能的性质是
A.其单质可作为半导体材料 B.其电负性大于磷
C.其原子半径大于储 D.其第一电离能小于硒
(6)活泼性D
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】某笼形络合物 晶胞结构中,镍离子与
晶胞结构中,镍离子与 连接形成平面层,两个平面层通过
连接形成平面层,两个平面层通过 分子连接,所有N原子均参与形成配位键,苯分子填充于空隙正中心,其晶胞结构如图(H原子未画出)。回答下列问题:
分子连接,所有N原子均参与形成配位键,苯分子填充于空隙正中心,其晶胞结构如图(H原子未画出)。回答下列问题:

(1)C、N、H电负性大小顺序___________ ;晶胞中N原子的杂化方式为___________ 。
(2)晶胞中镍离子的价电子轨道表示式为___________ ,与镍同周期的元素中,基态原子的未成对电子数与镍相同的有___________ 种。
(3)已知苯环中 键长为npm,则晶胞中A号C原子的分数坐标
键长为npm,则晶胞中A号C原子的分数坐标___________ ;晶胞M中含有 键数目为
键数目为___________ 个。
(4)镍离子的配位数为___________ ,晶胞的密度为___________  (用代数式表示)。
(用代数式表示)。
 晶胞结构中,镍离子与
晶胞结构中,镍离子与 连接形成平面层,两个平面层通过
连接形成平面层,两个平面层通过 分子连接,所有N原子均参与形成配位键,苯分子填充于空隙正中心,其晶胞结构如图(H原子未画出)。回答下列问题:
分子连接,所有N原子均参与形成配位键,苯分子填充于空隙正中心,其晶胞结构如图(H原子未画出)。回答下列问题:
(1)C、N、H电负性大小顺序
(2)晶胞中镍离子的价电子轨道表示式为
(3)已知苯环中
 键长为npm,则晶胞中A号C原子的分数坐标
键长为npm,则晶胞中A号C原子的分数坐标 键数目为
键数目为(4)镍离子的配位数为
 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】N、Cu及其相关化合物用途非常广泛。回答下列问题:
(1)基态铜原子的价电子排布式为__________________ 。
(2)NH3分子的立体构型为_________ ,中心原子的杂化类型是_________ 。
(3)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是_________ ,电负性最小的是_________ 。(填元素符号)
(4)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为_________ (填“离子晶体”或“分子晶体”,下同),CuCl为_________ 。
(5)氮与铜形成的一种化合物的晶胞结构如图所示。

与每个Cu原子紧邻的Cu原子有_________ 个,阿伏加 德罗常数的数值为NA,该晶体的密度为_________ (列出计算式)g·cm-3
(1)基态铜原子的价电子排布式为
(2)NH3分子的立体构型为
(3)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是
(4)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为
(5)氮与铜形成的一种化合物的晶胞结构如图所示。

与每个Cu原子紧邻的Cu原子有
您最近一年使用:0次
【推荐2】我国具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题:
(1)Cu+的核外电子排布式为_________ 。
(2)新型农药松脂酸铜具有低残留的特点,图是松脂酸铜的结构简式。加“*”碳原子的杂化方式为______ 。

(3)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型为____ ,比较第一电离能:N__ (填“>”或“<”)O。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醇的沸点明显高于乙醛,其主要原因为___________ 。
(5)某铜矿石的晶胞结构如图所示,写出其化学式____ 。

(1)Cu+的核外电子排布式为
(2)新型农药松脂酸铜具有低残留的特点,图是松脂酸铜的结构简式。加“*”碳原子的杂化方式为

(3)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型为
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醇的沸点明显高于乙醛,其主要原因为
(5)某铜矿石的晶胞结构如图所示,写出其化学式

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)某元素原子的价电子构型为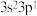 ,该元素的符号为
,该元素的符号为_______ 。
(2)某元素+3价离子的3d轨道半充满,该元素的符号为_______ 。
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,A和B形成的化合物的化学式为_______ 。
(4)下列关于物质熔点的排列顺序不正确的是_______。
三种常见元素原子的结构信息如表所示,试回答下列问题。
(5)C元素位于元素周期表中_______ 区,C元素原子的价电子排布式为_______ 。
(6)A的简单氢化物分子结合一个 形成阳离子后,其键角
形成阳离子后,其键角_______ (填“变大”“变小”或“不变”)。
(7)下列分子结构图中“●”表示某种元素的原子,①中“●”表示A元素的原子,②③中“●”表示的原子其元素与A元素同周期,④中“●”表示的原子其元素与B元素同主族且与A元素同周期,“○”均表示氢原子,小黑点“·”均表示没有参与形成共价键的电子,短线均表示共价键。

上述四种物质中②的分子式为_______ ,四种物质中中心原子采取 杂化的是
杂化的是_______ (填序号)。
(1)某元素原子的价电子构型为
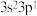 ,该元素的符号为
,该元素的符号为(2)某元素+3价离子的3d轨道半充满,该元素的符号为
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,A和B形成的化合物的化学式为
(4)下列关于物质熔点的排列顺序不正确的是_______。
| A.钢铁>纯铁>钠 | B. |
| C.NaCl>NaBr>KBr | D.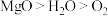 |
三种常见元素原子的结构信息如表所示,试回答下列问题。
| 元素 | A | B | C |
| 结构信息 | 原子核外有2个电子层,最外层有3个未成对电子 | 原子核外M层有1个成对的p电子 | 原子核外M层充满电子,N层有1个未成对的s电子 |
(6)A的简单氢化物分子结合一个
 形成阳离子后,其键角
形成阳离子后,其键角(7)下列分子结构图中“●”表示某种元素的原子,①中“●”表示A元素的原子,②③中“●”表示的原子其元素与A元素同周期,④中“●”表示的原子其元素与B元素同主族且与A元素同周期,“○”均表示氢原子,小黑点“·”均表示没有参与形成共价键的电子,短线均表示共价键。

上述四种物质中②的分子式为
 杂化的是
杂化的是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】由于锂离子电池成本的日益上涨以及锂资源的不断消耗,钾离子电池成为近几年的研究热点。回答下列问题:
(1)某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的负极电极材料。
①已知锑(Sb)为第五周期元素,与氮同族,基态Sb原子中占据能量最高能级的原子轨道电子云轮廓图为___________ 形。
②已知 和KCl的熔点分别是73.4℃和770℃,请分析两种物质熔点差异的原因:
和KCl的熔点分别是73.4℃和770℃,请分析两种物质熔点差异的原因:___________ 。
(2)过渡金属氧化物在钾离子电池正极材料中得到广泛应用,例如碳包覆的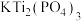 纳米材料,该金属盐中不存在的微粒间作用力有
纳米材料,该金属盐中不存在的微粒间作用力有___________ (填标号)。
a. 键 b.离子键 c.金属键 d.氢键
键 b.离子键 c.金属键 d.氢键
(3)该锑钾(Sb-K)合金的晶胞结构如图甲,图乙表示晶胞的一部分,设 为阿伏加德罗常数的值,1号原子的坐标为(0,0,0),3号原子的坐标为(1,1,l)。
为阿伏加德罗常数的值,1号原子的坐标为(0,0,0),3号原子的坐标为(1,1,l)。
①与Sb最邻近的K原子数为___________ 。
②图甲中Sb原子与K原子的个数比为___________ 。
③2号原子的坐标为___________ 。
④若该晶胞的晶胞参数为a pm,则该晶体的密度为___________  。
。
(1)某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的负极电极材料。
①已知锑(Sb)为第五周期元素,与氮同族,基态Sb原子中占据能量最高能级的原子轨道电子云轮廓图为
②已知
 和KCl的熔点分别是73.4℃和770℃,请分析两种物质熔点差异的原因:
和KCl的熔点分别是73.4℃和770℃,请分析两种物质熔点差异的原因:(2)过渡金属氧化物在钾离子电池正极材料中得到广泛应用,例如碳包覆的
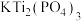 纳米材料,该金属盐中不存在的微粒间作用力有
纳米材料,该金属盐中不存在的微粒间作用力有a.
 键 b.离子键 c.金属键 d.氢键
键 b.离子键 c.金属键 d.氢键(3)该锑钾(Sb-K)合金的晶胞结构如图甲,图乙表示晶胞的一部分,设
 为阿伏加德罗常数的值,1号原子的坐标为(0,0,0),3号原子的坐标为(1,1,l)。
为阿伏加德罗常数的值,1号原子的坐标为(0,0,0),3号原子的坐标为(1,1,l)。
①与Sb最邻近的K原子数为
②图甲中Sb原子与K原子的个数比为
③2号原子的坐标为
④若该晶胞的晶胞参数为a pm,则该晶体的密度为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】水是地球上最常见的物质之一,是所有生命生存的重要资源。
(1) 键和
键和 键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为
键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为________ ;水溶液中存在H3O+离子,写出该微粒的结构式________ (标出配位键)。
(2)科学家发现在特殊条件下,水能表现出许多种有趣的结构和性质
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下:

使水结成“热冰”采用“弱电场”的条件,说明水分子是______ 分子。下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用力类型完全相同的是______ 。
A.固态氨 B.食盐 C.干冰 D.金刚石
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。产生的阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式__________ ;该阳离子还能与水作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式____________________ 。
(3)水的性质中的一些特殊现象对于生命的存在意义非凡,请解释水的分解温度远高于其沸点的原因______________________ ;试从结构的角度分析固态水(冰)的密度小于液态水的密度的原因是___________________________ 。
(4)甲烷的气体水合物晶体称为可燃冰,存在于海底和冰川底部,是巨大的潜在能源。在可燃冰晶体中,甲烷分子装在水分子构成的笼内,假设可燃冰晶体中的水笼里装的都是甲烷,理想的可燃冰晶胞组成为8CH4·46H2O,X-射线衍射分析表明,可燃冰晶体属于立方晶体,晶胞参数a=1200pm。则该晶体的密度为________ g/cm3(计算结果保留两位有效数字)
(1)
 键和
键和 键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为
键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为(2)科学家发现在特殊条件下,水能表现出许多种有趣的结构和性质
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下:

使水结成“热冰”采用“弱电场”的条件,说明水分子是
A.固态氨 B.食盐 C.干冰 D.金刚石
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。产生的阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式
(3)水的性质中的一些特殊现象对于生命的存在意义非凡,请解释水的分解温度远高于其沸点的原因
(4)甲烷的气体水合物晶体称为可燃冰,存在于海底和冰川底部,是巨大的潜在能源。在可燃冰晶体中,甲烷分子装在水分子构成的笼内,假设可燃冰晶体中的水笼里装的都是甲烷,理想的可燃冰晶胞组成为8CH4·46H2O,X-射线衍射分析表明,可燃冰晶体属于立方晶体,晶胞参数a=1200pm。则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:

请回答下列问题:
(1)B和N相比,电负性较大的是___ ,BN中B元素的化合价为___ ;
(2)在BF3分子中,F—B—F的键角是___ ;BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为___ ;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___ ,层间作用力为___ ,六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为___ ,其结构与石墨相似却不导电,原因是___ 。
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有___ 个氮原子、___ 个硼原子,立方氮化硼的密度是___ g·cm-3(只要求列算式,不必计算出数值,阿伏加 德罗常数为NA)。

请回答下列问题:
(1)B和N相比,电负性较大的是
(2)在BF3分子中,F—B—F的键角是
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有
您最近一年使用:0次



