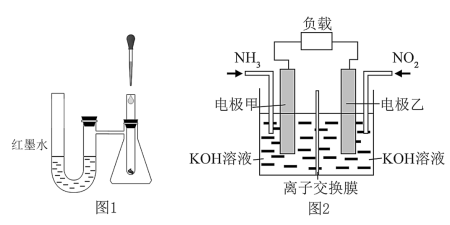
(1)为了探究化学反应的热效应,某兴趣小组采用如图1所示装置进行实验:将稀盐酸滴入装入铁粉的试管中,U形管内的现象为_____ ,发生的反应是_____ (填“放热”或“吸热”)反应,以下选项中与其能量变化相同的是_______ (填字母)。
A.盐酸与碳酸氢钠的反应B.CaCO3的分解反应
C.食物的缓慢氧化D.Ba(OH)2•8H2O和NH4Cl的反应
E.H2和Cl2的反应
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为_____ 。
A.铝片、铝片B.铜片、铜片C.铝片、铜片D.铜片、铝片
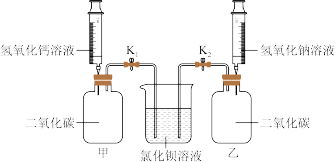
(3)雾霾中含有氮的氧化物,利用反应NO2+NH3→N2+H2O(未配平)制作如图2所示的电池,用以消除氮氧化物的污染。电极甲是_____ 极,电池工作时,OH-定向移向______ 电极(填“甲”或“乙”),写出负极电极反应式:_____ ,若一段时间内测得外电路中有1.2mol电子通过,则负极比正极产生的气体多____ L(标准状况下)。
A.盐酸与碳酸氢钠的反应B.CaCO3的分解反应
C.食物的缓慢氧化D.Ba(OH)2•8H2O和NH4Cl的反应
E.H2和Cl2的反应

(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为
A.铝片、铝片B.铜片、铜片C.铝片、铜片D.铜片、铝片
(3)雾霾中含有氮的氧化物,利用反应NO2+NH3→N2+H2O(未配平)制作如图2所示的电池,用以消除氮氧化物的污染。电极甲是
更新时间:2021/06/04 23:28:53
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】碱是一类重要的物质,氢氧化钠和氢氧化钙是常见的碱。
(1)我国古代劳动人民在生产、生活中就已经充分利用氢氧化钙。氢氧化钙的俗名是_______ ,请写出氢氧化钙的一种用途_______ 。
(2)为验证氢氧化钙和氢氧化钠的性质,进行如下图所示实验(装置气密性良好)。
步骤:分别向充满二氧化碳的甲、乙两个容器中注入等体积的氢氧化钙饱和溶液、氢氧化钠饱和溶液;稍后打开弹簧夹K1、K2。
现象与结论:实验过程中甲、乙均有氯化钡溶液进入,进入乙中的液体量较多。从氢氧化钙和氢氧化钠性质的角度分析,产生上述现象的原因_______ 。乙中产生的白色沉淀的化学式是_______ 。
(3)在某15mL氢氧化钠溶液中滴入稀盐酸,稀盐酸的体积与溶液温度的变化关系如下图所示。

I.由上图可知,氢氧化钠溶液与盐酸反应会_______ (选填“放出”或“吸收”)热量;滴入稀盐酸的体积为_______ (选填“a”“b”“c”或“d”)mL时两者恰好完全反应。
II.设计实验,证明上述实验产生的热量来自酸碱中和反应,而不是溶液稀释所导致的。请写出实验方案。_______
(1)我国古代劳动人民在生产、生活中就已经充分利用氢氧化钙。氢氧化钙的俗名是
(2)为验证氢氧化钙和氢氧化钠的性质,进行如下图所示实验(装置气密性良好)。

步骤:分别向充满二氧化碳的甲、乙两个容器中注入等体积的氢氧化钙饱和溶液、氢氧化钠饱和溶液;稍后打开弹簧夹K1、K2。
现象与结论:实验过程中甲、乙均有氯化钡溶液进入,进入乙中的液体量较多。从氢氧化钙和氢氧化钠性质的角度分析,产生上述现象的原因
(3)在某15mL氢氧化钠溶液中滴入稀盐酸,稀盐酸的体积与溶液温度的变化关系如下图所示。

I.由上图可知,氢氧化钠溶液与盐酸反应会
II.设计实验,证明上述实验产生的热量来自酸碱中和反应,而不是溶液稀释所导致的。请写出实验方案。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】作为一种绿色消毒剂, 在公共卫生事业中发挥了重要的作用。已知反应:
在公共卫生事业中发挥了重要的作用。已知反应: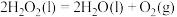 的能量变化如图。回答问题:
的能量变化如图。回答问题:

(1)该反应是_______ 反应(填“放热”或“吸热”)。
(2) 的电子式为
的电子式为____ , 对大多数致病菌和病毒具有消杀功能是因为其具有
对大多数致病菌和病毒具有消杀功能是因为其具有_____ 性。用3%医用 对传染病房喷洒消毒时,地板上有气泡冒出,该气体是
对传染病房喷洒消毒时,地板上有气泡冒出,该气体是_____ 。
(3)纯 可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,
可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下, 剧烈分解:
剧烈分解: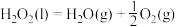 ,产生大量气体,驱动火箭升空。已知上图中
,产生大量气体,驱动火箭升空。已知上图中 的数值为196kJ,则每消耗34g
的数值为196kJ,则每消耗34g ,理论上放出热量
,理论上放出热量_______ 98kJ(填“大于”、“小于”或“等于”)。
(4)向 稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起
稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起_______ 作用。某组实验数据如下:
0-30min 反应的平均速率v=
反应的平均速率v=_______  。
。
(5)用10% 和
和 的
的 混合溶液将铜粉溶解,反应的离子方程式为
混合溶液将铜粉溶解,反应的离子方程式为_______ 。测得不同温度下铜的平均溶解速率如下表:
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是_______ 。
 在公共卫生事业中发挥了重要的作用。已知反应:
在公共卫生事业中发挥了重要的作用。已知反应: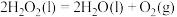 的能量变化如图。回答问题:
的能量变化如图。回答问题:
(1)该反应是
(2)
 的电子式为
的电子式为 对大多数致病菌和病毒具有消杀功能是因为其具有
对大多数致病菌和病毒具有消杀功能是因为其具有 对传染病房喷洒消毒时,地板上有气泡冒出,该气体是
对传染病房喷洒消毒时,地板上有气泡冒出,该气体是(3)纯
 可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,
可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下, 剧烈分解:
剧烈分解: ,产生大量气体,驱动火箭升空。已知上图中
,产生大量气体,驱动火箭升空。已知上图中 的数值为196kJ,则每消耗34g
的数值为196kJ,则每消耗34g ,理论上放出热量
,理论上放出热量(4)向
 稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起
稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
c( )/mol·L-1 )/mol·L-1 | 0.70 | 0.49 | 0.35 | 0.25 | 0.17 | 0.12 |
 反应的平均速率v=
反应的平均速率v= 。
。(5)用10%
 和
和 的
的 混合溶液将铜粉溶解,反应的离子方程式为
混合溶液将铜粉溶解,反应的离子方程式为| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜的平均溶解速率( ) ) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】为了探究化学反应中的能量转化,某实验小组进行了以下研究:
Ⅰ.甲醛(HCHO)在化工、医药、农药等方面有广泛的应用,可用甲醇脱氢法制备。反应方程式为:CH3OH(l) HCHO(g)+H2(g)。
HCHO(g)+H2(g)。
(1)发生反应时的过程如图所示,从热效应角度判断,可知该反应为_______ 反应。
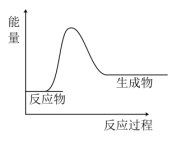
(2)下列方法中能减慢反应速率的是_______ (填字母)。
a.使用催化剂 b.升高温度 c.降低反应物浓度 d.降低压强
(3)使用催化剂_______ (填“能”或“不能”)使反应物的转化率达到100%。
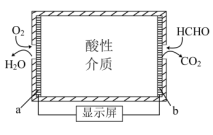
Ⅱ.甲醛超标会危害人体健康,需对甲醛含量检测及处理。
(4)某甲醛气体探测仪利用燃料电池工作原理,其结构如图所示。电极a上发生的反应类型为_______ (填“氧化”或“还原”)反应,电极b上的发生反应方程式为_______ 。
Ⅲ.在2L密闭容器内,800℃时CO与H2反应生成CH3OH,n(H2)随时间的变化如下表所示:
(5)图中能表示CO变化曲线的是_______ 。用CH3OH表示0-2s内该反应的平均速率V=_______ 。
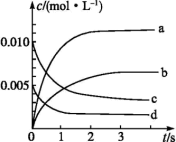
(6)能说明该反应已达到平衡状态的是_______ 。
a.2v(CH3OH)=v(H2)
b.容器内气体压强保持不变
c.断开2molH-H键的同时断开4molC-H键
d.容器内气体密度保持不变
Ⅰ.甲醛(HCHO)在化工、医药、农药等方面有广泛的应用,可用甲醇脱氢法制备。反应方程式为:CH3OH(l)
 HCHO(g)+H2(g)。
HCHO(g)+H2(g)。(1)发生反应时的过程如图所示,从热效应角度判断,可知该反应为

(2)下列方法中能减慢反应速率的是
a.使用催化剂 b.升高温度 c.降低反应物浓度 d.降低压强
(3)使用催化剂
Ⅱ.甲醛超标会危害人体健康,需对甲醛含量检测及处理。
(4)某甲醛气体探测仪利用燃料电池工作原理,其结构如图所示。电极a上发生的反应类型为

Ⅲ.在2L密闭容器内,800℃时CO与H2反应生成CH3OH,n(H2)随时间的变化如下表所示:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| (H2)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(6)能说明该反应已达到平衡状态的是
a.2v(CH3OH)=v(H2)
b.容器内气体压强保持不变
c.断开2molH-H键的同时断开4molC-H键
d.容器内气体密度保持不变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】煤化工产品在工业领域中有广泛的应用前景。
I.煤与水蒸气生产水煤气的化学方程式为: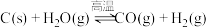 ,反应的能量变化如图所示:
,反应的能量变化如图所示:____ (填“吸热反应”或“放热反应”)
(2)在体积固定的密闭容器中发生上述反应,下列措施能加快反应速率的是_____(填序号)
Ⅱ.二甲醚(DME)被誉为“21世纪的清洁燃料”,制备二甲醚的主要原理如下:
①
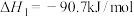
②
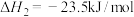
③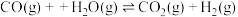
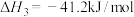
(3)反应 的
的
_____ kJ/mol
(4)在2L的密闭容器中合成二甲醚,CO、 和产物
和产物 (部分产物未标出)的物质的量随时间变化的曲线如图所示:
(部分产物未标出)的物质的量随时间变化的曲线如图所示: 的转化率为
的转化率为____ 。
②从反应开始到10s,用CO表示的反应速率为____ 。
③在体积固定的密闭容器中发生上述反应,能说明反应达到平衡状态的是____ 。
A.CO的含量保持不变 B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.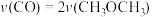
Ⅲ.可将二甲醚设计成燃料电池。图为某二甲醚燃料电池的工作原理示意图。a、b均为多孔性Pt电极。请填空:____ 极。
(6)电池中电子的流向为____ (填“由a流向b”或“由b流向a”)。
I.煤与水蒸气生产水煤气的化学方程式为:
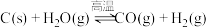 ,反应的能量变化如图所示:
,反应的能量变化如图所示: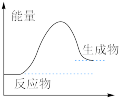
(2)在体积固定的密闭容器中发生上述反应,下列措施能加快反应速率的是_____(填序号)
| A.充入氩气增大压强 | B.加入固体碳 | C.增大水蒸气浓度 | D.及时分离CO |
Ⅱ.二甲醚(DME)被誉为“21世纪的清洁燃料”,制备二甲醚的主要原理如下:
①

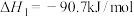
②

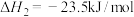
③
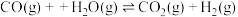
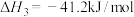
(3)反应
 的
的
(4)在2L的密闭容器中合成二甲醚,CO、
 和产物
和产物 (部分产物未标出)的物质的量随时间变化的曲线如图所示:
(部分产物未标出)的物质的量随时间变化的曲线如图所示: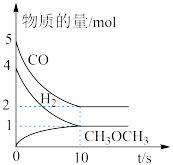
 的转化率为
的转化率为②从反应开始到10s,用CO表示的反应速率为
③在体积固定的密闭容器中发生上述反应,能说明反应达到平衡状态的是
A.CO的含量保持不变 B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.
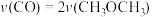
Ⅲ.可将二甲醚设计成燃料电池。图为某二甲醚燃料电池的工作原理示意图。a、b均为多孔性Pt电极。请填空:
(6)电池中电子的流向为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某小组在验证反应“ ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。
向硝酸酸化的 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
(1)检测到滤液中含有 ,可以选用的试剂为
,可以选用的试剂为___________ (填化学式)溶液。 产生的原因可能有以下几种。
产生的原因可能有以下几种。
假设a:可能是铁粉表面有氧化层,能产生 。
。
假设b:空气中存在 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
假设c:酸性溶液中的 具有氧化性,可产生
具有氧化性,可产生 。
。
(2)某同学证明上面假设c不成立,向硝酸酸化的___________ 硝酸钠溶液中加入过量铁粉,搅拌后静置,一段时间后,上层清液未变黄色,经检验无 。
。
(3)取过滤后的黑色固体,洗涤后,___________ (填操作和现象),证明黑色固体中含有Ag。
(4)某同学利用原电池证明 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为___________ 。写出石墨电极上发生的电极反应式:___________ 。电流表指针不再偏转后,向左侧烧杯中加入 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为___________ (填“正极”或“负极”),银电极的电极反应式为___________ 。
 ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。向硝酸酸化的
 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。(1)检测到滤液中含有
 ,可以选用的试剂为
,可以选用的试剂为 产生的原因可能有以下几种。
产生的原因可能有以下几种。假设a:可能是铁粉表面有氧化层,能产生
 。
。假设b:空气中存在
 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:假设c:酸性溶液中的
 具有氧化性,可产生
具有氧化性,可产生 。
。(2)某同学证明上面假设c不成立,向硝酸酸化的
 。
。(3)取过滤后的黑色固体,洗涤后,
(4)某同学利用原电池证明
 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为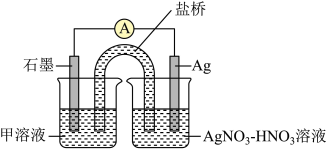
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一 种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物。
(1)W在元素周期表中的位置是______ 。
(2)2.24L(标准状况)XQ3被200mL 1mol/L QXY3溶液吸收后,所得溶液中离子浓度从大到小的顺序是______ 。
(3)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是______ 。
(4)已知:W(s)+Y2(g)═WY2(g)△H=-393.5kJ/mol WY(g)+ Y2(g)═WY2(g)△H=-283.0kJ/mol24g W与一定量的Y2反应,放出热量362.5kJ,所得产物的物质的量之比是
Y2(g)═WY2(g)△H=-283.0kJ/mol24g W与一定量的Y2反应,放出热量362.5kJ,所得产物的物质的量之比是______ 。
(5)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是______ 。

(1)W在元素周期表中的位置是
(2)2.24L(标准状况)XQ3被200mL 1mol/L QXY3溶液吸收后,所得溶液中离子浓度从大到小的顺序是
(3)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是
(4)已知:W(s)+Y2(g)═WY2(g)△H=-393.5kJ/mol WY(g)+
 Y2(g)═WY2(g)△H=-283.0kJ/mol24g W与一定量的Y2反应,放出热量362.5kJ,所得产物的物质的量之比是
Y2(g)═WY2(g)△H=-283.0kJ/mol24g W与一定量的Y2反应,放出热量362.5kJ,所得产物的物质的量之比是(5)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】到目前为止,由化学能转变的热能或电能仍然是人类使用的主要能源。
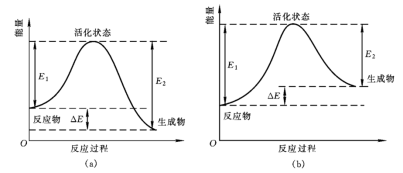
(1)从能量变化角度研究反应: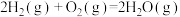 。下图能正确表示该反应中能量变化的是
。下图能正确表示该反应中能量变化的是___________ (填字母)。
(2)从断键和成键角度分析上述反应中能量的变化。部分化学键的键能如下表:
则生成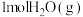 放出热量
放出热量___________ kJ。
(3)肼-空气燃料电池的电解质溶液是20%~30%的KOH溶液,反应方程式是:N2H4+O2=N2+2H2O,该燃料电池的负极电极反应式是___________ 。
(4)用零价铁(Fe)去除水体中的硝酸盐( )已成为环境修复研究的热点之一、Fe还原水体中
)已成为环境修复研究的热点之一、Fe还原水体中 的反应原理如图所示。
的反应原理如图所示。
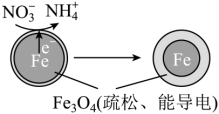
①作负极的物质是___________ 。
②正极的电极反应式是___________ 。
(1)从能量变化角度研究反应:
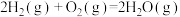 。下图能正确表示该反应中能量变化的是
。下图能正确表示该反应中能量变化的是
(2)从断键和成键角度分析上述反应中能量的变化。部分化学键的键能如下表:
| 化学键 |  |  |  |
| 键能(kJ/mol) | 436 | 496 | 463 |
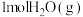 放出热量
放出热量(3)肼-空气燃料电池的电解质溶液是20%~30%的KOH溶液,反应方程式是:N2H4+O2=N2+2H2O,该燃料电池的负极电极反应式是
(4)用零价铁(Fe)去除水体中的硝酸盐(
 )已成为环境修复研究的热点之一、Fe还原水体中
)已成为环境修复研究的热点之一、Fe还原水体中 的反应原理如图所示。
的反应原理如图所示。
①作负极的物质是
②正极的电极反应式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某学习小组用如图所示A、B装置分别探究金属锌与稀硫酸的反应,实验过程中A装置烧杯内的溶液温度升高,B装置的电流计指针发生偏转。

(1)A装置的烧杯中发生反应的离子方程式为______________ 。
(2)B装置中Zn板是________ 极;Cu板上的现象是________ ,其发生的电极反应式是_____ 。若有1 mol电子流过导线,则正极生成的产物的物质的量为_______ 。
(3)从能量转化的角度看,A、B中反应物的总能量________ (填“大于”“小于”或“等于”)生成物的总能量,A中主要是将化学能转化为__________ ,B中主要是将化学能转化为___________ 。
(4)该小组同学反思原电池的原理,其中观点正确的是___________ (填字母)。
A 原电池反应的过程中可能没有电子发生转移 B 原电池装置需要2个电极
C 电极一定不能参加反应 D 氧化反应和还原反应可以拆开在两极发生
(5)有人以化学反应:2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则该原电池的正极发生的电极反应为___________ 。

(1)A装置的烧杯中发生反应的离子方程式为
(2)B装置中Zn板是
(3)从能量转化的角度看,A、B中反应物的总能量
(4)该小组同学反思原电池的原理,其中观点正确的是
A 原电池反应的过程中可能没有电子发生转移 B 原电池装置需要2个电极
C 电极一定不能参加反应 D 氧化反应和还原反应可以拆开在两极发生
(5)有人以化学反应:2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则该原电池的正极发生的电极反应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】硫元素的单质及其化合物在科学研究、工农业生产、农药的制备与使用等方面具有广泛用途。请
根据以下应用回答有关问题:
(1)已知单质硫有S2、S4、S6、S8、Sn等多种形式,在Sn分子内S原子以S—S单键形成“锯齿形”的n
元环。试画出S8的八元环结构式___________ 。
(2)绿色农药“石硫合剂”的有效成分为五硫化钙(CaS5)和硫代硫酸钙(CaS2O3),可由单质硫和熟石灰在加热条件下制得,该反应的化学方程式为(反应中单质硫要求用S4表示);____________ 。
已知多硫化钙为离子化合物,其中S原子以S—S单键连接成多硫链而形成—2价的原子团,试画出五硫化钙的电子式_________________ 。
(3)科学家探测出火星大气中含有一种称为硫化羰的物成,其化学式为COS,结构与二氧化碳分子相似。硫化羰可作为一种熏蒸剂,能防止某些昆虫、线虫的危害。请你利用下表中相关共价键的键能数据:
根据有关反应原理写出硫化羰气体与水蒸气反应生成CO2和H2S的热化学方程式:______________ .
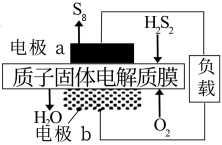
(4)S4广泛用于杀菌剂和抗真菌剂中,可由H2S2的燃料电池获得,其装置如下图所示。
①H2S2的名称是________ 。
②电极b为________ (选填“正极”、 “负极”)。
③电极a上发生的电极反应为:_______________ 。
(5)一氧化二硫(S2O)常温下是一种无色、不稳定的气体,实验室可由S8和氧化铜共热制得,同时生成硫化铜和SO2(注:生成物中气体产物等物质的量:升价与降价的硫也是等物质的量)。
该制备反应的化学方程式为________ ;
已知S2O常温时分解生成两种含硫的常见物质,请依据S2O中硫元素的价态分析并写出该分解反应的化学方程式_____________________ 。
根据以下应用回答有关问题:
(1)已知单质硫有S2、S4、S6、S8、Sn等多种形式,在Sn分子内S原子以S—S单键形成“锯齿形”的n
元环。试画出S8的八元环结构式
(2)绿色农药“石硫合剂”的有效成分为五硫化钙(CaS5)和硫代硫酸钙(CaS2O3),可由单质硫和熟石灰在加热条件下制得,该反应的化学方程式为(反应中单质硫要求用S4表示);
已知多硫化钙为离子化合物,其中S原子以S—S单键连接成多硫链而形成—2价的原子团,试画出五硫化钙的电子式
(3)科学家探测出火星大气中含有一种称为硫化羰的物成,其化学式为COS,结构与二氧化碳分子相似。硫化羰可作为一种熏蒸剂,能防止某些昆虫、线虫的危害。请你利用下表中相关共价键的键能数据:
| 共价键 | C=O | C=S | H—O | H—S |
| 键能/kJ.mol-1 | 745 | 536 | 464 | 339 |
(4)S4广泛用于杀菌剂和抗真菌剂中,可由H2S2的燃料电池获得,其装置如下图所示。
①H2S2的名称是
②电极b为
③电极a上发生的电极反应为:
(5)一氧化二硫(S2O)常温下是一种无色、不稳定的气体,实验室可由S8和氧化铜共热制得,同时生成硫化铜和SO2(注:生成物中气体产物等物质的量:升价与降价的硫也是等物质的量)。
该制备反应的化学方程式为
已知S2O常温时分解生成两种含硫的常见物质,请依据S2O中硫元素的价态分析并写出该分解反应的化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】甲烷和甲醇(CH3OH)既是重要的化工原料,又是未来重要的能源物质。
(1)该反应为 ,反应过程中能量变化如图所示。则1molCO(g)和2molH2(g)的总能量
,反应过程中能量变化如图所示。则1molCO(g)和2molH2(g)的总能量___________ (填“>”、“<”或“=”)1molCH3OH(g)的能量。

(2)在容积为1L的恒容密闭容器中投入等物质的量的CO2(g)和H2(g),进行反应: 。CO2(g)、CH3OH(g)的物质的量随时间变化关系如图所示:
。CO2(g)、CH3OH(g)的物质的量随时间变化关系如图所示:

图中,表示正反应速率与逆反应速率相等的点是___________ (填“a”、“b”、“c”或“d”)。用同一物质表示反应速率时,a、c两点的正反应速率:υa___________ υc (填“>”、“<”或“=”,下同),该反应达到平衡时,CO2的转化率___________ 50%。
(3)将2.0molCH4(g)和3.0molH2O(g)通入容积为2L的恒容密闭容器中,恒温条件下发生反应: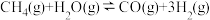 。测得在10min时反应达到平衡,此时CH4的物质的量为1.6mol,则0~10min内,用CO表示该反应的平均反应速率υ(CO)=
。测得在10min时反应达到平衡,此时CH4的物质的量为1.6mol,则0~10min内,用CO表示该反应的平均反应速率υ(CO)=___________ 。下列描述中能说明该反应已达平衡状态的是___________ (填标号)。
a. 断裂3mol H−H键时,生成2mol H−O键 b. 容器内混合气体的平均摩尔质量保持不变
c. 容器内混合气体的压强保持不变 d. 容器内CO与H2的体积之比保持不变
(4)甲烷可直接应用于燃料电池,该电池采用KOH溶液为电解质,其工作原理如图所示:

①外电路电子移动方向:___________ (填“a→b”或“b→a”)。
②a电极的电极方程式为___________ 。
③标准状况下消耗5.6LO2,外电路中通过导线的电子的数目为___________ 。
(1)该反应为
 ,反应过程中能量变化如图所示。则1molCO(g)和2molH2(g)的总能量
,反应过程中能量变化如图所示。则1molCO(g)和2molH2(g)的总能量
(2)在容积为1L的恒容密闭容器中投入等物质的量的CO2(g)和H2(g),进行反应:
 。CO2(g)、CH3OH(g)的物质的量随时间变化关系如图所示:
。CO2(g)、CH3OH(g)的物质的量随时间变化关系如图所示:
图中,表示正反应速率与逆反应速率相等的点是
(3)将2.0molCH4(g)和3.0molH2O(g)通入容积为2L的恒容密闭容器中,恒温条件下发生反应:
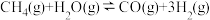 。测得在10min时反应达到平衡,此时CH4的物质的量为1.6mol,则0~10min内,用CO表示该反应的平均反应速率υ(CO)=
。测得在10min时反应达到平衡,此时CH4的物质的量为1.6mol,则0~10min内,用CO表示该反应的平均反应速率υ(CO)=a. 断裂3mol H−H键时,生成2mol H−O键 b. 容器内混合气体的平均摩尔质量保持不变
c. 容器内混合气体的压强保持不变 d. 容器内CO与H2的体积之比保持不变
(4)甲烷可直接应用于燃料电池,该电池采用KOH溶液为电解质,其工作原理如图所示:

①外电路电子移动方向:
②a电极的电极方程式为
③标准状况下消耗5.6LO2,外电路中通过导线的电子的数目为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】水资源的处理和利用是环境化学的重要课题。
I.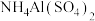 常作食品加工中的食品添加剂,也可用作净水剂。请回答下列问题:
常作食品加工中的食品添加剂,也可用作净水剂。请回答下列问题:
(1)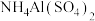 作净水剂的原理是
作净水剂的原理是_______ (用离子方程式说明)。几种均为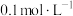 的电解质溶液的pH随温度变化的曲线如图1所示。其中符合
的电解质溶液的pH随温度变化的曲线如图1所示。其中符合 溶液的pH随温度变化的曲线是
溶液的pH随温度变化的曲线是_______ (填罗马数字),判断的理由是_______ 。
(2)高铁酸盐在水浴液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图2所示:pH=2.4时,溶液中主要含铁形体浓度的大小关系为_______ 。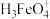 电离常数分别为:
电离常数分别为: ,
,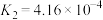 ,
, ,当pH=4时,溶液中
,当pH=4时,溶液中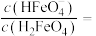
_______ 。
(4)高铁酸钾( )不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图3所示是高铁电池的模拟实验装置。
)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图3所示是高铁电池的模拟实验装置。 ,正极电极反应为
,正极电极反应为_______ 。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向_______ (填“左”或“右”)移动。
I.
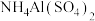 常作食品加工中的食品添加剂,也可用作净水剂。请回答下列问题:
常作食品加工中的食品添加剂,也可用作净水剂。请回答下列问题:(1)
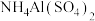 作净水剂的原理是
作净水剂的原理是 的电解质溶液的pH随温度变化的曲线如图1所示。其中符合
的电解质溶液的pH随温度变化的曲线如图1所示。其中符合 溶液的pH随温度变化的曲线是
溶液的pH随温度变化的曲线是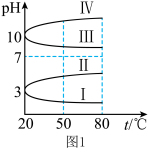
(2)高铁酸盐在水浴液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图2所示:pH=2.4时,溶液中主要含铁形体浓度的大小关系为
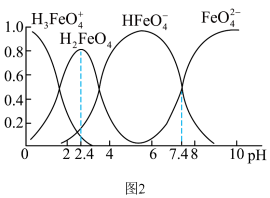
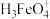 电离常数分别为:
电离常数分别为: ,
,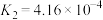 ,
, ,当pH=4时,溶液中
,当pH=4时,溶液中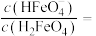
(4)高铁酸钾(
 )不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图3所示是高铁电池的模拟实验装置。
)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图3所示是高铁电池的模拟实验装置。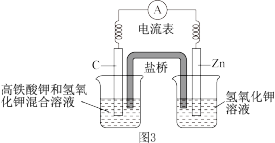
 ,正极电极反应为
,正极电极反应为②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】燃煤的过程中排放大量CO2、SO2、NOx以及固体颗粒物,对环境污染严重。请回答下列问题:
(1)将煤作为燃料常通过下列两种途径:
途径Ⅰ:C(s)+O2(g)=CO2(g) ΔH1<0 ①
途径Ⅱ:先制水煤气,后燃烧水煤气
C(s)+H2O(g) CO(g)+H2(g) ΔH2>0 ②
CO(g)+H2(g) ΔH2>0 ②
2CO(g)+O2(g)=2CO2(g) ΔH3<0 ③
2H2(g)+O2(g)=2H2O(g) ΔH4<0 ④
ΔH1、ΔH2、ΔH3、ΔH4的关系式是___________________ 。
(2)已知碳的气化反应在不同温度下平衡常数的对数值(lg K)如表:
升高温度时,反应i中H2的产率________ (填“增大”“减小”或“不变”)。在900 K时,反应CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数的对数值(lg K)为________ 。
(3)为了减少燃煤污染,可将煤燃烧产生的SO2制成自发电池,其电池总反应为2SO2+O2+2H2O=2H2SO4,该电池的负极反应式为__________________ 用这种方法处理含SO2废气的优点是______________ ;
(4)新型氨法烟气脱硫技术采用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵。亚硫酸铵又可用于燃煤烟道气脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式________________ 。
(5)用K2CO3溶液可吸收燃煤反应中生成的CO2,常温下pH=10的K2CO3溶液中由水电离的OH-的物质的量浓度为________ 。常温下,0.1 mol·L-1 KHCO3溶液的pH>8,则溶液中c(H2CO3)________ (填“>”“=”或“<”)c(CO32-)。
(1)将煤作为燃料常通过下列两种途径:
途径Ⅰ:C(s)+O2(g)=CO2(g) ΔH1<0 ①
途径Ⅱ:先制水煤气,后燃烧水煤气
C(s)+H2O(g)
 CO(g)+H2(g) ΔH2>0 ②
CO(g)+H2(g) ΔH2>0 ②2CO(g)+O2(g)=2CO2(g) ΔH3<0 ③
2H2(g)+O2(g)=2H2O(g) ΔH4<0 ④
ΔH1、ΔH2、ΔH3、ΔH4的关系式是
(2)已知碳的气化反应在不同温度下平衡常数的对数值(lg K)如表:
| 气化反应 | lg K | ||
| 700 K | 900 K | 1 200 K | |
| i.C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| ii. C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
升高温度时,反应i中H2的产率
(3)为了减少燃煤污染,可将煤燃烧产生的SO2制成自发电池,其电池总反应为2SO2+O2+2H2O=2H2SO4,该电池的负极反应式为
(4)新型氨法烟气脱硫技术采用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵。亚硫酸铵又可用于燃煤烟道气脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式
(5)用K2CO3溶液可吸收燃煤反应中生成的CO2,常温下pH=10的K2CO3溶液中由水电离的OH-的物质的量浓度为
您最近一年使用:0次



