I.种新型催化剂能使 和
和 发生反应:
发生反应: 。为研究化学反应速率的影响因素,在恒容条件下,某同学设计了三组实验,如表所示。
。为研究化学反应速率的影响因素,在恒容条件下,某同学设计了三组实验,如表所示。
(1) 末,
末,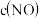 为
为 ,则
,则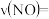
____  ,
,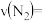
___ 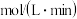 。
。
(2)下列选项中,能说明反应达到平衡的标志是_____ 。
A.单位时间消耗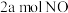 时,同时生成
时,同时生成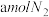
B.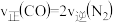
C.容器内压强不再发生改变
D.容器内气体的密度不再发生改变
(3)对比实验编号I和III,能验证_______ 对化学反应速率影响。下图是实验____ 和___ (填实验编号)的对比。
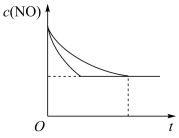
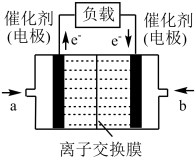
II.知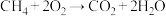 ,为了提高甲烷的能量利用率,可以把
,为了提高甲烷的能量利用率,可以把 设计成燃料电池使用,如图所示,
设计成燃料电池使用,如图所示, 为质子交换膜,只允许
为质子交换膜,只允许 通过,回答下列问题。
通过,回答下列问题。
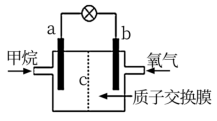
(1)该燃料电池外电路的电流方向由_______ 到_______ (填“a“b)。
(2) 在电池内部电解质溶液中向
在电池内部电解质溶液中向_______ (填“左”或“右”)移动。
(3)a极反应方程式:_______ 。
(4)在标准状况下,若每分钟通过质子交换膜的 为
为 ,消耗甲烷的体积为
,消耗甲烷的体积为_______ L
 和
和 发生反应:
发生反应: 。为研究化学反应速率的影响因素,在恒容条件下,某同学设计了三组实验,如表所示。
。为研究化学反应速率的影响因素,在恒容条件下,某同学设计了三组实验,如表所示。| 实验编号 | t/℃ |  初始浓度 初始浓度 |  初始浓度 初始浓度 | 催化剂的比表面积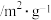 |
| I | 280 | 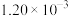 |  | 82 |
| II | 280 | 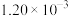 |  | 124 |
| III | 350 | 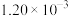 |  | 82 |
 末,
末,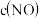 为
为 ,则
,则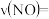
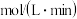 ,
,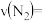
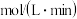 。
。(2)下列选项中,能说明反应达到平衡的标志是
A.单位时间消耗
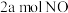 时,同时生成
时,同时生成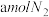
B.
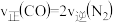
C.容器内压强不再发生改变
D.容器内气体的密度不再发生改变
(3)对比实验编号I和III,能验证

II.知
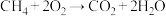 ,为了提高甲烷的能量利用率,可以把
,为了提高甲烷的能量利用率,可以把 设计成燃料电池使用,如图所示,
设计成燃料电池使用,如图所示, 为质子交换膜,只允许
为质子交换膜,只允许 通过,回答下列问题。
通过,回答下列问题。
(1)该燃料电池外电路的电流方向由
(2)
 在电池内部电解质溶液中向
在电池内部电解质溶液中向(3)a极反应方程式:
(4)在标准状况下,若每分钟通过质子交换膜的
 为
为 ,消耗甲烷的体积为
,消耗甲烷的体积为
更新时间:2021-07-10 09:44:30
|
相似题推荐
【推荐1】我国在西昌卫星发射“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
I.有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大。
(1)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-543 kJ·mol-1
H2(g)+F2(g)=2HF(g) ΔH2=-538 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH3=-484 kJ·mol-1
则:N2H4(g)+2F2(g)=N2(g)+4HF(g) ΔH4=______ 。
II.氧化剂二氧化氮可由NO和O2生成。800°C时,在2 L密闭容器内,0.200 mol NO与0.100 mol O2反应:2NO(g)+O2(g) 2NO2(g) ΔH的体系中,已知n(NO)随时间的变化如图所示:
2NO2(g) ΔH的体系中,已知n(NO)随时间的变化如图所示:
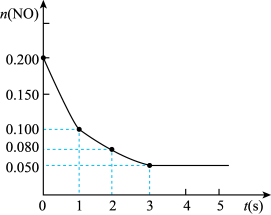
(2)已知:K(800℃)>K(1000℃),则该反应的ΔH______ 0(填“>”或“<”),用NO2表示从0~2 s内该反应的平均速率v(NO2)=______ 。
(3)能说明该反应已达到平衡状态的是______ 。
a.容器内颜色保持不变 b.2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(4)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有______ (任写一条)。
I.有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大。
(1)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-543 kJ·mol-1
H2(g)+F2(g)=2HF(g) ΔH2=-538 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH3=-484 kJ·mol-1
则:N2H4(g)+2F2(g)=N2(g)+4HF(g) ΔH4=
II.氧化剂二氧化氮可由NO和O2生成。800°C时,在2 L密闭容器内,0.200 mol NO与0.100 mol O2反应:2NO(g)+O2(g)
 2NO2(g) ΔH的体系中,已知n(NO)随时间的变化如图所示:
2NO2(g) ΔH的体系中,已知n(NO)随时间的变化如图所示:
(2)已知:K(800℃)>K(1000℃),则该反应的ΔH
(3)能说明该反应已达到平衡状态的是
a.容器内颜色保持不变 b.2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(4)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】某同学利用如图装置模拟工业生产制备少量硝酸,请结合所学知识完成下列问题。
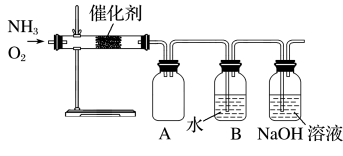
(1)实验时先用酒精喷灯加热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是_______ (填字母)。
A.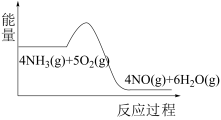 B.
B.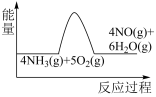 C.
C.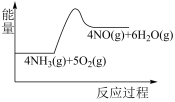
(2)高温时, ,因此氨气与氧气反应难以生成
,因此氨气与氧气反应难以生成 。根据下列1mol物质断键时的能量数据计算,当
。根据下列1mol物质断键时的能量数据计算,当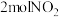 完全分解时,反应会
完全分解时,反应会_______ (填“吸收”或“放出”)_______ kJ能量。

(3)在2L的恒温密闭容器中,发生反应 ,通入等物质的量的NO和
,通入等物质的量的NO和 气体,n(NO)随时间的变化如下表:
气体,n(NO)随时间的变化如下表:
①某同学由数据推测,反应在第4s时恰好到达平衡状态。该推测_______ (填“正确”或“错误”)
②在第5s时, 的转化率为
的转化率为_______ 。
③容器中混合气体压强与反应开始时的压强比值为_______ 。

(1)实验时先用酒精喷灯加热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是
A.
 B.
B. C.
C.
(2)高温时,
 ,因此氨气与氧气反应难以生成
,因此氨气与氧气反应难以生成 。根据下列1mol物质断键时的能量数据计算,当
。根据下列1mol物质断键时的能量数据计算,当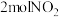 完全分解时,反应会
完全分解时,反应会
(3)在2L的恒温密闭容器中,发生反应
 ,通入等物质的量的NO和
,通入等物质的量的NO和 气体,n(NO)随时间的变化如下表:
气体,n(NO)随时间的变化如下表:| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.012 | 0.008 | 0.005 | 0.004 | 0.004 |
②在第5s时,
 的转化率为
的转化率为③容器中混合气体压强与反应开始时的压强比值为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】调控化学反应速率对化工生产有重要的意义 ,某校实验小组欲通过实验探究浓度、催化剂、温度等条件对反应速率的影响。
I.第一实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
(1)H2O2分解的化学反应方程式为_______ 。
(2)选取①②在探究浓度对速率的影响时,时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_______ 。
(3)选取_______ (填实验序号)实验,可完成催化剂对反应速率影响的探究
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图所示。分析图示能够得出的实验结论是_______ 。

II.第二实验小组欲用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素(离子方程式为2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。该实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。该实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
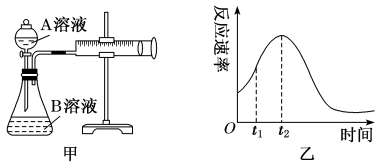
(5)该实验探究的是_______ 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是_______ (填实验序号)。
(6)若实验①在2min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO )=
)=_______ mol·L-1(假设混合溶液的体积为50 mL),2min内H2C2O4的消耗速率为v (H2C2O4) =_______ mol·L-1·min-1
(7)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,②_______ 。
I.第一实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 编号 | 反应物 | 催化剂 |
| ① | 10 mL 2%H2O2溶液 | 无 |
| ② | 10 mL 5%H2O2溶液 | 无 |
| ③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑥ | 10 mL 5%H2O2溶液+1 mL H2O | 无 |
(2)选取①②在探究浓度对速率的影响时,时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是
(3)选取
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图所示。分析图示能够得出的实验结论是

II.第二实验小组欲用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素(离子方程式为2MnO
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。该实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。该实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1 mol·L-1 H2C2O4溶液 | 30mL 0.01 mol·L-1 KMnO4溶液 |
| ② | 20mL 0.2 mol·L-1 H2C2O4溶液 | 30mL0.01 mol·L-1 KMnO4溶液 |
(6)若实验①在2min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO
 )=
)=(7)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,②
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】一定温度下,在密闭容器中发生反应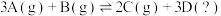
 ,正反应速率表达式为
,正反应速率表达式为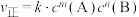 (k是正反应速率常数,只与温度有关)。测得正反应速率常数与浓度关系如表所示:
(k是正反应速率常数,只与温度有关)。测得正反应速率常数与浓度关系如表所示:
(1)n=___________ 。
(2)向容积为2L的恒容密闭容器中仅充入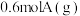 和
和 ,发生上述反应,测得
,发生上述反应,测得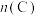 随时间的变化如图所示:
随时间的变化如图所示:

①物质D的聚集状态为___________ 。
②a、b、c三点气体C的逆反应速率由大到小的顺序为___________ (用a、b、c表示)。
③T2时,此反应的平衡常数K=___________ (不写单位)。
(3)在恒温、恒容容器中进行反应
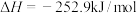 。下列不能说明反应达到平衡状态的是___________(填字母)。
。下列不能说明反应达到平衡状态的是___________(填字母)。
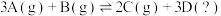
 ,正反应速率表达式为
,正反应速率表达式为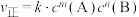 (k是正反应速率常数,只与温度有关)。测得正反应速率常数与浓度关系如表所示:
(k是正反应速率常数,只与温度有关)。测得正反应速率常数与浓度关系如表所示:| 序号 |  |  |  |
| I | 0.10 | 0.10 | 0.15 |
| Ⅱ | 0.20 | 0.20 | 2.40 |
| Ⅲ | 0.20 | 0.10 | 1.20 |
(1)n=
(2)向容积为2L的恒容密闭容器中仅充入
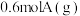 和
和 ,发生上述反应,测得
,发生上述反应,测得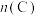 随时间的变化如图所示:
随时间的变化如图所示:
①物质D的聚集状态为
②a、b、c三点气体C的逆反应速率由大到小的顺序为
③T2时,此反应的平衡常数K=
(3)在恒温、恒容容器中进行反应

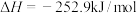 。下列不能说明反应达到平衡状态的是___________(填字母)。
。下列不能说明反应达到平衡状态的是___________(填字母)。| A.混合气体的平均密度不再变化 |
| B.混合气体的平均摩尔质量不再变化 |
C. |
| D.容器内的气体压强不再变化 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】100℃时,将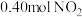 气体充入
气体充入 的真空密闭容器中发生反应:
的真空密闭容器中发生反应: ,每隔一段时间就对该容器内的物质进行测量,得到下表数据:
,每隔一段时间就对该容器内的物质进行测量,得到下表数据:
(1)从反应开始至 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为___________ 。
(2)100℃时,该反应的化学平衡常数的数值为___________ (保留两位有效数字)。
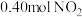 气体充入
气体充入 的真空密闭容器中发生反应:
的真空密闭容器中发生反应: ,每隔一段时间就对该容器内的物质进行测量,得到下表数据:
,每隔一段时间就对该容器内的物质进行测量,得到下表数据:| 时间/s | 0 | 20 | 40 | 60 | 80 |
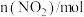 | 0.40 | a | 0.26 | b | c |
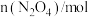 | 0.00 | 0.05 | d | 0.08 | 0.08 |
(1)从反应开始至
 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为(2)100℃时,该反应的化学平衡常数的数值为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】在化学反应的研究和实际应用中,人们除了选择合适的化学反应以实现新期特的物质转化或能量转化,还要关注化学反应进行的快慢和程度,以提高生产效率。
(1)控制条件,让反应在恒容密闭容器中进行如下反应: 。用传感器测得不同时间NO和CO的浓度如表。
。用传感器测得不同时间NO和CO的浓度如表。
前2s内的平均反应速率 =
=_______ ,从表格看,已达化学平衡的时间段为:_______ 。
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的 气体后,发生反应
气体后,发生反应
 ,已知
,已知 是红棕色气体,
是红棕色气体, 是无色气体。反应速率(v)与时间(t)的关系曲线。下列叙述正确的是
是无色气体。反应速率(v)与时间(t)的关系曲线。下列叙述正确的是_______ 。
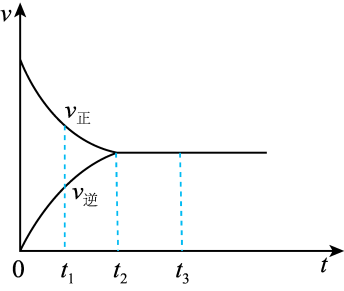
a. 时,反应未达到平衡,
时,反应未达到平衡, 浓度在减小
浓度在减小
b. 时,反应达到平衡,反应不再进行
时,反应达到平衡,反应不再进行
c. 各物质浓度不再变化
各物质浓度不再变化
d. 各物质浓度相等
各物质浓度相等
e. ,
, 浓度增大
浓度增大
f.反应过程中气体的颜色不变
g.建立平衡过程中,混合气体平均相对分子质量增大
(3)在压强为0.1MPa条件下,amol CO与3a mol 的混合气体在催化剂作用下能自发反应生成甲醇:
的混合气体在催化剂作用下能自发反应生成甲醇: 放热。为了寻得合成甲醇的适宜温度与压强,某同学设计了三组实验,部分实验条件已经填在下面的实验设计表中。表中剩余的实验数据:
放热。为了寻得合成甲醇的适宜温度与压强,某同学设计了三组实验,部分实验条件已经填在下面的实验设计表中。表中剩余的实验数据:
_______ ,
_______ 。
(4)比较相同浓度的 溶液和不同浓度的
溶液和不同浓度的 溶液反应的反应快慢可通过测定
溶液反应的反应快慢可通过测定_______ 来实现。
(5)在四个不同的容器中,在不同的条件下进行合成氨反应: 根据在相同时间内测定的结果判断,生成氨气的反应速率由大到小排列_______
根据在相同时间内测定的结果判断,生成氨气的反应速率由大到小排列_______
(1)控制条件,让反应在恒容密闭容器中进行如下反应:
 。用传感器测得不同时间NO和CO的浓度如表。
。用传感器测得不同时间NO和CO的浓度如表。| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
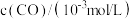 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
 =
=(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的
 气体后,发生反应
气体后,发生反应
 ,已知
,已知 是红棕色气体,
是红棕色气体, 是无色气体。反应速率(v)与时间(t)的关系曲线。下列叙述正确的是
是无色气体。反应速率(v)与时间(t)的关系曲线。下列叙述正确的是
a.
 时,反应未达到平衡,
时,反应未达到平衡, 浓度在减小
浓度在减小b.
 时,反应达到平衡,反应不再进行
时,反应达到平衡,反应不再进行c.
 各物质浓度不再变化
各物质浓度不再变化d.
 各物质浓度相等
各物质浓度相等e.
 ,
, 浓度增大
浓度增大f.反应过程中气体的颜色不变
g.建立平衡过程中,混合气体平均相对分子质量增大
(3)在压强为0.1MPa条件下,amol CO与3a mol
 的混合气体在催化剂作用下能自发反应生成甲醇:
的混合气体在催化剂作用下能自发反应生成甲醇: 放热。为了寻得合成甲醇的适宜温度与压强,某同学设计了三组实验,部分实验条件已经填在下面的实验设计表中。表中剩余的实验数据:
放热。为了寻得合成甲醇的适宜温度与压强,某同学设计了三组实验,部分实验条件已经填在下面的实验设计表中。表中剩余的实验数据:
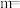
| 实验编号 | T(℃) | 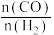 | P(MPa) |
| ① | 180 | 2∶3 | 0.1 |
| ② | n | 2∶3 | 5 |
| ③ | 350 | m | 5 |
 溶液和不同浓度的
溶液和不同浓度的 溶液反应的反应快慢可通过测定
溶液反应的反应快慢可通过测定(5)在四个不同的容器中,在不同的条件下进行合成氨反应:
 根据在相同时间内测定的结果判断,生成氨气的反应速率由大到小排列_______
根据在相同时间内测定的结果判断,生成氨气的反应速率由大到小排列_______A.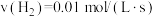 | B.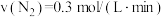 |
C.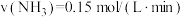 | D.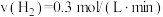 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】分别按下图A、B、C所示装置进行实验,图中三个烧杯里的溶液为同浓度的稀硫酸。请回答下列问题:
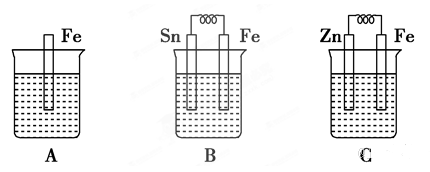
(1)以下叙述中,正确的是__________ 。
A.B中铁片是负极,C中铁片是正极
B.三个烧杯中铁片表面均无气泡产生
C.产生气泡的速率A中比B中慢
D.B溶液中SO42-向铁片电极移动
(2)装置B变化过程中能量转化的形式主要是:____________ 。
(3)装置B中正极反应式为____________ ,负极反应式为____________ 。
(4)有同学想把Ba(OH)2·8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?__________ (填“是”或“否”),理由是__________ 。

(1)以下叙述中,正确的是
A.B中铁片是负极,C中铁片是正极
B.三个烧杯中铁片表面均无气泡产生
C.产生气泡的速率A中比B中慢
D.B溶液中SO42-向铁片电极移动
(2)装置B变化过程中能量转化的形式主要是:
(3)装置B中正极反应式为
(4)有同学想把Ba(OH)2·8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】I.元素周期表的建立是化学发展史上重要的里程碑之一,它揭示了元素之间的内在联系。如图是元素周期表的短周期示意图,相应方格中每个序号代表处于该位置的一种元素。
请回答下列问题:
(1)元素①的名称为___________ 。
(2)⑥和⑦两种元素的气态氢化物中稳定性较强的是___________ (填化学式)。
(3)②和④两种元素形成的常见气态化合物中化学键类型为___________ 。
(4)元素③的最高价氧化物的水化物为___________ 。(填化学式)
Ⅱ.现有如下两个反应:
A. B.
B.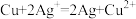
(1)以上两个反应,___________ (填字母)反应不能设计成原电池
(2)另一个反应可设计一个化学电池,其中负极材料为___________ (填名称)
| ① | ||||||||
| ② | ③ | ④ | ||||||
| ⑤ | ⑥ | ⑦ |
(1)元素①的名称为
(2)⑥和⑦两种元素的气态氢化物中稳定性较强的是
(3)②和④两种元素形成的常见气态化合物中化学键类型为
(4)元素③的最高价氧化物的水化物为
Ⅱ.现有如下两个反应:
A.
 B.
B.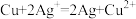
(1)以上两个反应,
(2)另一个反应可设计一个化学电池,其中负极材料为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)⇌CH3OH(g) ∆H1=-90.7kJ·mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2=-23.5kJ·mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的∆H=_______ kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有_______ 。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是_______ 。
(4)将合成气以 =2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)⇌ CH3OCH3(g)+H2O(g) ∆H,其CO的平衡转化率随温度、压强变化关系如图所示:
=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)⇌ CH3OCH3(g)+H2O(g) ∆H,其CO的平衡转化率随温度、压强变化关系如图所示:
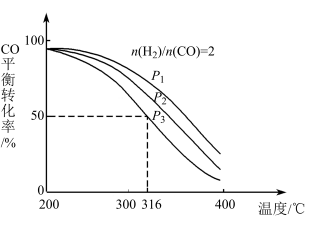
下列说法正确的是_______ 。
A.∆H<0
B.P1<P2<P3
C.若在P3和316℃时,起始时 =3,则达到平衡时,CO转化率小于50%
=3,则达到平衡时,CO转化率小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察下图回答问题。催化剂中 约为
约为_______ 时最有利于二甲醚的合成。

(6)如图是二甲醚燃料电池(电解质溶液为KOH溶液)的结构示意图,则b处通入的是___ (填“二甲醚”或“氧气”),a处发生的电极反应是__ 。
①CO(g)+2H2(g)⇌CH3OH(g) ∆H1=-90.7kJ·mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2=-23.5kJ·mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的∆H=
(2)下列措施中,能提高CH3OCH3产率的有
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是
(4)将合成气以
 =2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)⇌ CH3OCH3(g)+H2O(g) ∆H,其CO的平衡转化率随温度、压强变化关系如图所示:
=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)⇌ CH3OCH3(g)+H2O(g) ∆H,其CO的平衡转化率随温度、压强变化关系如图所示:
下列说法正确的是
A.∆H<0
B.P1<P2<P3
C.若在P3和316℃时,起始时
 =3,则达到平衡时,CO转化率小于50%
=3,则达到平衡时,CO转化率小于50%(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察下图回答问题。催化剂中
 约为
约为
(6)如图是二甲醚燃料电池(电解质溶液为KOH溶液)的结构示意图,则b处通入的是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2L密闭容器内,400°C时发生反应:CO(g)+2H2(g) CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
(1)图中表示CH3OH的物质的量浓度变化的曲线是_______ (填字母)。
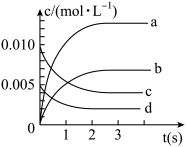
(2)用H2表示从0~2s内该反应的平均速率v(H2)_______ 。随着反应的进行,该反应的速率逐渐减慢的原因是_______ 。
(3)该反应是一个放热反应,说明该反应中破坏1molCO和2molH2的化学键吸收的能量_______ 形成lmolCH3OH释放的能量(填“<”、“=”或“>”)。
(4)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)KOH(电解质溶液)构成。电池的总反应式为:2CH3OH+3O2+4OH-=2 +6H2O则电池放电时通入空气的电极为
+6H2O则电池放电时通入空气的电极为_______ (“正”或“负”)极;该电池负极的电极反应式是_______ 从电极反应式来看,每消耗1molCH3OH转移_______ mol电子。
(5)若已知:在CO2加氢合成CH3OH的体系中,同时发生以下反应:
反应i:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应ii:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
某温度下,向容积为1L的密闭容器中通入1molCO2(g)和5molH2(g),10min后体系达到平衡,此时H2的转化率为8%,CH3OH的选择性为50%。(已知:CH3OH的选择性=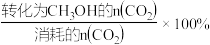 ),则平衡时气体的总物质的量是
),则平衡时气体的总物质的量是_______ mol。
 CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CH3OH)(mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |
(1)图中表示CH3OH的物质的量浓度变化的曲线是

(2)用H2表示从0~2s内该反应的平均速率v(H2)
(3)该反应是一个放热反应,说明该反应中破坏1molCO和2molH2的化学键吸收的能量
(4)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)KOH(电解质溶液)构成。电池的总反应式为:2CH3OH+3O2+4OH-=2
 +6H2O则电池放电时通入空气的电极为
+6H2O则电池放电时通入空气的电极为(5)若已知:在CO2加氢合成CH3OH的体系中,同时发生以下反应:
反应i:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)反应ii:CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)某温度下,向容积为1L的密闭容器中通入1molCO2(g)和5molH2(g),10min后体系达到平衡,此时H2的转化率为8%,CH3OH的选择性为50%。(已知:CH3OH的选择性=
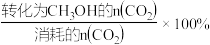 ),则平衡时气体的总物质的量是
),则平衡时气体的总物质的量是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】CO2的脱除、利用与封存成为科学家研究的重要课题。
(1)已知:①CH4(g)+2O2(g)⇌CO2(g)+2H2O(g) ΔH1=akJ·mol-1
②2CO(g)+O2(g)⇌2CO2(g) ΔH2=b kJ·mol-1
则反应 3CO2(g)+CH4(g)⇌4CO(g)+2H2O(g)的ΔH3=_______ kJ·mol-1。
(2)探究反应 CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的反应速率和平衡,向1L恒容密闭容器中通入CO2和CH4各1mol,测得CH4的平衡转化率与温度及压强的关系如图所示。

①CO2(g)+CH4(g)⇌2CO(g)+2H2(g)是_______ 反应(填“吸热”或“放热”)。
②下列叙述不能判断反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)达化学平衡状态的是_____ 。
A.混合气体的密度保持不变
B.CO的体积分数保持不变
C.c(CO)和c(H2)的比值保持不变
D.断裂4mol C-H键的同时断裂2mol H-H键
③在压强为P1,温度为1000℃时,反应经5min达平衡,该反应的平衡常数K=_______ (mol∙L-1)2;比较x点和y点的速率:x_______ y(填“>”“<”或“=”下同);压强P1_______ P2(填“大于”“小于”或“等于”),原因是_______ 。
(3)可以利用混合传导膜(MECC)技术进行CO2的脱除并富集资源化,如下图,脱除CO2过程中得到电子的物质是_______ ,正极的电极反应式为_______ 。

(1)已知:①CH4(g)+2O2(g)⇌CO2(g)+2H2O(g) ΔH1=akJ·mol-1
②2CO(g)+O2(g)⇌2CO2(g) ΔH2=b kJ·mol-1
则反应 3CO2(g)+CH4(g)⇌4CO(g)+2H2O(g)的ΔH3=
(2)探究反应 CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的反应速率和平衡,向1L恒容密闭容器中通入CO2和CH4各1mol,测得CH4的平衡转化率与温度及压强的关系如图所示。

①CO2(g)+CH4(g)⇌2CO(g)+2H2(g)是
②下列叙述不能判断反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)达化学平衡状态的是
A.混合气体的密度保持不变
B.CO的体积分数保持不变
C.c(CO)和c(H2)的比值保持不变
D.断裂4mol C-H键的同时断裂2mol H-H键
③在压强为P1,温度为1000℃时,反应经5min达平衡,该反应的平衡常数K=
(3)可以利用混合传导膜(MECC)技术进行CO2的脱除并富集资源化,如下图,脱除CO2过程中得到电子的物质是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氨是一种重要的化工原料,电化学合成氨在工业上起着相当重要的作用。
(1)电解法合成氨反应装置如图所示:______ (填“阴”或“阳”)极。
②电解装置中质子交换膜的作用为_________ 。
(2)科学家研究通过一种生物燃料电池实现室温下合成氨,其工作原理如图所示:______ (填“a”或“b”)电极,正极的电极反应为________ ;对比传统的工业合成氨,生物燃料电池合成氨的优点是________ (任写一条)。
(3)以悬浮的纳米Fe2O3作催化剂,H2O和N2为原料直接常压电化学合成氨技术取得了突破性进展,其工作原理如图所示:_______ 。
②蒙乃尔筛网处发生的电极反应为_______ 。
(1)电解法合成氨反应装置如图所示:

②电解装置中质子交换膜的作用为
(2)科学家研究通过一种生物燃料电池实现室温下合成氨,其工作原理如图所示:
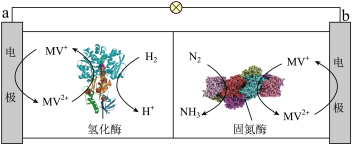
(3)以悬浮的纳米Fe2O3作催化剂,H2O和N2为原料直接常压电化学合成氨技术取得了突破性进展,其工作原理如图所示:
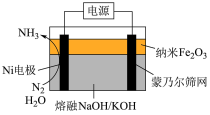
②蒙乃尔筛网处发生的电极反应为
您最近一年使用:0次



