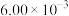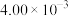为工业制硫酸的重要反应。回答下列问题:
为工业制硫酸的重要反应。回答下列问题:(1)已知该反应在反应过程中体系温度会升高,且每摩尔
 、
、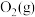 、
、 所含化学能分别为
所含化学能分别为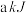 、
、 、
、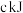 ,则每有
,则每有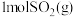 参与反应时,
参与反应时, 。
。(2)一定温度下,向体积为2L的刚性密闭容器中充入
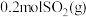 和
和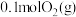 ,发生反应:
,发生反应: 。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如
。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如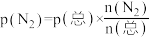 。
。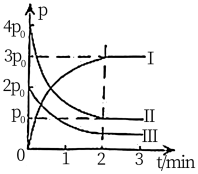
①图中表示
 分压变化的曲线为
分压变化的曲线为 时,
时, 的转化率为
的转化率为②
 内,用
内,用 表示该反应的速率为
表示该反应的速率为 。
。③能说明上述反应已达到平衡状态的是
a.容器内
 、
、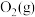 的物质的量浓度之比为
的物质的量浓度之比为
b.
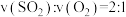
c.容器中气体的密度不随时间而变化
d.容器内压强不随时间面变化
更新时间:2021-07-11 11:22:54
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】化学反应都伴随有能量变化。
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:
 kJ⋅mol-1
kJ⋅mol-1

 kJ⋅mol-1
kJ⋅mol-1

 kJ⋅mol-1
kJ⋅mol-1
 与
与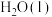 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为___________ 。
(2)如图所示为常温常压下,1mol 和1mol
和1mol 完全反应生成
完全反应生成 和
和 过程中的能量变化。
过程中的能量变化。
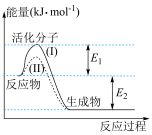
①曲线II表示___________ (填“有”或“无”)催化剂作用时的能量变化。
②若能量变化如曲线I所示,该反应逆反应的活化能为___________ kJ⋅mol-1。
③若常温常压下,1mol 完全燃烧放出的热量为
完全燃烧放出的热量为 kJ,则
kJ,则

___________ kJ⋅mol-1。
(3)工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。键能如下表所示,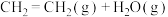
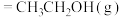 反应的
反应的
___________ kJ⋅mol-1。
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:

 kJ⋅mol-1
kJ⋅mol-1
 kJ⋅mol-1
kJ⋅mol-1
 kJ⋅mol-1
kJ⋅mol-1 与
与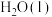 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为(2)如图所示为常温常压下,1mol
 和1mol
和1mol 完全反应生成
完全反应生成 和
和 过程中的能量变化。
过程中的能量变化。
①曲线II表示
②若能量变化如曲线I所示,该反应逆反应的活化能为
③若常温常压下,1mol
 完全燃烧放出的热量为
完全燃烧放出的热量为 kJ,则
kJ,则

(3)工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。键能如下表所示,
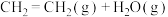
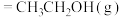 反应的
反应的
| 化学键 |  |  |  |  |  |
| 键能/(kJ·mol-1) | 413 | 615 | 463 | 348 | 351 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:O2(g)+S(s)=SO2(g)△H=-akJ·mol-1
O2(g) +2SO2(g)⇌2SO3(g) △H = -b kJ·mol-1
写出SO3(g)分解生成O2(g)与S(s)的热化学方程式:__________________ 。
(2)研究SO2催化氧化生成SO3的反应,回答下列相关问题:
①甲图是SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到平衡时,用O2表示的平均反应速率为__________________ 。
②在一容积可变的密闭容器中充入20 mol SO2(g)和10mol O2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示。则P1与P2的大小关系是P1______ P2( “>”“ <”或“=”),A、B、C三点的平衡常数大小关系为__________ (用KA、KB、KC和“<”“>”或“=”表示)。
(3)常温下,H2SO3的电离平衡常数Ka1=1.54×10-2,Ka2=1.02×10-7。
①将SO2通入水中反应生成H2SO3。试计算常温下H2SO3⇌2H++SO32-的平衡常数K =_____ 。(结果保留小数点后两位数字)
②浓度均为0. 1 mol • L-1的Na2SO3、NaHSO3混合溶液中,
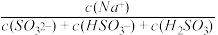 =
=________ 。
(4)往1 L0.2 mol • L-1Na2SO3溶液中加入0.1 mol的CaCl2固体,充分反应后(忽略溶液体积变化),溶液中c(Ca2+)=_________ 。(已知,常温下Ksp(CaSO3)=1.28×l0-9)
(5)用含等物质的量溶质的下列溶液分别吸收SO2,理论吸收量最多的是__________ (填序号)。
A.Na2SO3B.Fe(NO3)3C.Ba(OH)2D.酸性 KMnO4
(1)已知25℃时:O2(g)+S(s)=SO2(g)△H=-akJ·mol-1
O2(g) +2SO2(g)⇌2SO3(g) △H = -b kJ·mol-1
写出SO3(g)分解生成O2(g)与S(s)的热化学方程式:
(2)研究SO2催化氧化生成SO3的反应,回答下列相关问题:
①甲图是SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到平衡时,用O2表示的平均反应速率为
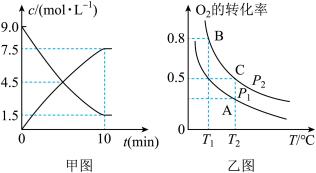
②在一容积可变的密闭容器中充入20 mol SO2(g)和10mol O2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示。则P1与P2的大小关系是P1
(3)常温下,H2SO3的电离平衡常数Ka1=1.54×10-2,Ka2=1.02×10-7。
①将SO2通入水中反应生成H2SO3。试计算常温下H2SO3⇌2H++SO32-的平衡常数K =
②浓度均为0. 1 mol • L-1的Na2SO3、NaHSO3混合溶液中,
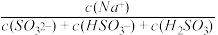 =
=(4)往1 L0.2 mol • L-1Na2SO3溶液中加入0.1 mol的CaCl2固体,充分反应后(忽略溶液体积变化),溶液中c(Ca2+)=
(5)用含等物质的量溶质的下列溶液分别吸收SO2,理论吸收量最多的是
A.Na2SO3B.Fe(NO3)3C.Ba(OH)2D.酸性 KMnO4
您最近一年使用:0次
【推荐3】由N、O、S等元素形成多种化合物在生产生活中有着重要应用。
Ⅰ.已知: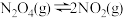
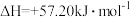 。t℃时,将一定量的NO2和N2O4混合气体充入一个容积为2 L的恒容密闭容器中,测得两种物质浓度随时间变化关系如下表所示:
。t℃时,将一定量的NO2和N2O4混合气体充入一个容积为2 L的恒容密闭容器中,测得两种物质浓度随时间变化关系如下表所示:
(1)该反应的平衡常数K=_______ 。
(2)20 min时改变的条件是_______ ,重新达到平衡时,N2O4的体积分数将_______ (填字母)
a.增大 b.减小 c.不变 d.无法判断
(3)t℃时,下列情况不能说明该反应处于平衡状态的是_______。
(4)若反应在t℃进行,某时刻测得n(NO2)=0.6 mol、n(N2O4)=1.2 mol,则此时v(正)_______ v(逆)。(填“>”“<”或“=”)
Ⅱ.硫及其化合物在工业生产和生活中有重要的应用,运用化学原理研究硫及其化合物有重要意义。回答下列问题:
(5)已知:2O3(g)⇌3O2(g) △H1=-285 kJ•mol-1
2SO2(g)+O2(g)⇌2SO3(g) △H2=-196.6 kJ•mol-1
则反应SO2(g)+O3(g)⇌SO3(g)+O2(g)的△H=_______ kJ•mol-1
(6)对于反应SO2(g)+O3(g)⇌SO3(g)+O2(g),在催化剂作用下、523 K和543 K时SO2的转化率随时间变化的结果如图所示。

①543K时SO2的平衡转化率a=_______ 。
②下列措施在其他条件不变时能提高SO2平衡转化率的是_______ 。
A.压缩容器的体积 B.降温温度
C.增大O3的浓度 D.升高温度
Ⅰ.已知:
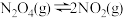
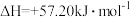 。t℃时,将一定量的NO2和N2O4混合气体充入一个容积为2 L的恒容密闭容器中,测得两种物质浓度随时间变化关系如下表所示:
。t℃时,将一定量的NO2和N2O4混合气体充入一个容积为2 L的恒容密闭容器中,测得两种物质浓度随时间变化关系如下表所示:| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
(1)该反应的平衡常数K=
(2)20 min时改变的条件是
a.增大 b.减小 c.不变 d.无法判断
(3)t℃时,下列情况不能说明该反应处于平衡状态的是_______。
| A.混合气体的密度保持不变 | B.混合气体的颜色不再变化 |
| C.混合气体的气体压强保持不变 | D.N2O4与NO2的物质的量之比为10:3 |
Ⅱ.硫及其化合物在工业生产和生活中有重要的应用,运用化学原理研究硫及其化合物有重要意义。回答下列问题:
(5)已知:2O3(g)⇌3O2(g) △H1=-285 kJ•mol-1
2SO2(g)+O2(g)⇌2SO3(g) △H2=-196.6 kJ•mol-1
则反应SO2(g)+O3(g)⇌SO3(g)+O2(g)的△H=
(6)对于反应SO2(g)+O3(g)⇌SO3(g)+O2(g),在催化剂作用下、523 K和543 K时SO2的转化率随时间变化的结果如图所示。

①543K时SO2的平衡转化率a=
②下列措施在其他条件不变时能提高SO2平衡转化率的是
A.压缩容器的体积 B.降温温度
C.增大O3的浓度 D.升高温度
您最近一年使用:0次
【推荐1】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g) CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
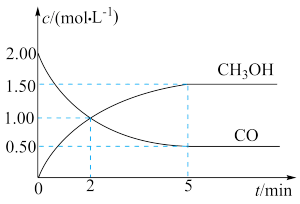
①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=____________ 。
②下列说法正确的是____________ (填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)=v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g)的△H=
CaCO3(s)+2H2(g)的△H=__________ kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=__________ (用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________ 。(填字母)
A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
 CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=
②下列说法正确的是
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)=v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g)的△H=
CaCO3(s)+2H2(g)的△H=若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=
②对于可逆反应C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】利用催化技术可将汽车尾气中的NO和CO转化成CO2和N2。某课题组查阅资料知:使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。他们为探究增大该化学反应速率的因素,在相同的恒容密闭容器中,进行了三组对比实验,数据如下:
三组实验中c(CO)随时间的变化如图所示:
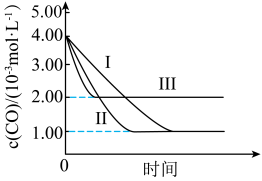
请按要求回答下列问题。
(1)写出反应的化学方程式:_______ 。在上述条件下,该反应均能自发进行,则该反应的ΔH_______ 0(填写“>”、“<”或“=”)
(2)此实验设计探究增大该化学反应速率的因素有_______ 。
(3)T3=_______ ℃。
(4)第Ⅰ组实验中,达到平衡时c(N2)=_______ mol∙L-1。
(5)通过三组实验对比得出结论:
①由实验Ⅰ、Ⅱ可得的结论:在其他条件相同的情况下,_______ 。
②由实验Ⅰ、Ⅲ可得的结论:_______ 。
(6)若与第Ⅰ组实验对比,第Ⅳ组实验仅将c(CO)改为5.00×10-3mol∙L-1,280℃下该反应的平衡常数的值为_______ 。
编号 | T/℃ | c(NO)/( mol∙L-1) | c(CO)/( mol∙L-1) | 催化剂的比表面积/( m2∙g-1) |
Ⅰ | 280. |
|
| 80.0 |
Ⅱ | 360 |
|
| 80.0 |
Ⅲ | T3 |
|
| 120 |

请按要求回答下列问题。
(1)写出反应的化学方程式:
(2)此实验设计探究增大该化学反应速率的因素有
(3)T3=
(4)第Ⅰ组实验中,达到平衡时c(N2)=
(5)通过三组实验对比得出结论:
①由实验Ⅰ、Ⅱ可得的结论:在其他条件相同的情况下,
②由实验Ⅰ、Ⅲ可得的结论:
(6)若与第Ⅰ组实验对比,第Ⅳ组实验仅将c(CO)改为5.00×10-3mol∙L-1,280℃下该反应的平衡常数的值为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】乙烯作为现代有机合成的重要原料,研究其制备方法具有重要的意义。
回答下列问题:
I.乙烷制备乙烯
(1)某温度、 下,向反应器中充入
下,向反应器中充入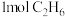 只发生反应
只发生反应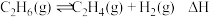 ,
, 的平衡转化率为
的平衡转化率为 ;保持温度和压强不变,向反应器中再充入水蒸气,
;保持温度和压强不变,向反应器中再充入水蒸气, 后达到平衡,此时
后达到平衡,此时 的平衡转化率为
的平衡转化率为 ,需要向反应器中充入
,需要向反应器中充入___________  水蒸气;用压强变化表示的
水蒸气;用压强变化表示的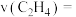
___________  ;此时该反应的
;此时该反应的
___________ ( 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压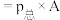 的物质的量分数)。
的物质的量分数)。
(2) 为一种选择性交换膜,其结构如图所示,其中第二周期组成元素的第二电离能与第一电离能差值最大的是
为一种选择性交换膜,其结构如图所示,其中第二周期组成元素的第二电离能与第一电离能差值最大的是___________ (填元素符号),结构中1处 的键角
的键角___________ (填“大于”“小于”或“等于”)2处 的键角。
的键角。
在催化剂作用下,二氧化碳可制取乙烯,发生以下反应:
①
②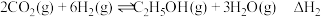
③
(3)
___________  。
。
(4)若将 和
和 按物质的量之比
按物质的量之比 混合,在
混合,在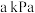 恒压反应器中连续反应,测得
恒压反应器中连续反应,测得 的转化率与
的转化率与 、
、 的选择性随温度变化如图所示。
的选择性随温度变化如图所示。 的转化率曲线是
的转化率曲线是___________ (填“X”“Y”或“Z”,下同), 的选择性曲线是
的选择性曲线是___________ ,说明判断依据:___________ 。
回答下列问题:
I.乙烷制备乙烯
(1)某温度、
 下,向反应器中充入
下,向反应器中充入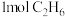 只发生反应
只发生反应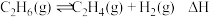 ,
, 的平衡转化率为
的平衡转化率为 ;保持温度和压强不变,向反应器中再充入水蒸气,
;保持温度和压强不变,向反应器中再充入水蒸气, 后达到平衡,此时
后达到平衡,此时 的平衡转化率为
的平衡转化率为 ,需要向反应器中充入
,需要向反应器中充入 水蒸气;用压强变化表示的
水蒸气;用压强变化表示的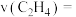
 ;此时该反应的
;此时该反应的
 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压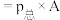 的物质的量分数)。
的物质的量分数)。(2)
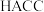 为一种选择性交换膜,其结构如图所示,其中第二周期组成元素的第二电离能与第一电离能差值最大的是
为一种选择性交换膜,其结构如图所示,其中第二周期组成元素的第二电离能与第一电离能差值最大的是 的键角
的键角 的键角。
的键角。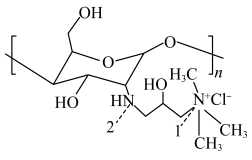
在催化剂作用下,二氧化碳可制取乙烯,发生以下反应:
①

②
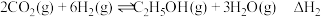
③

(3)

 。
。(4)若将
 和
和 按物质的量之比
按物质的量之比 混合,在
混合,在 恒压反应器中连续反应,测得
恒压反应器中连续反应,测得 的转化率与
的转化率与 、
、 的选择性随温度变化如图所示。
的选择性随温度变化如图所示。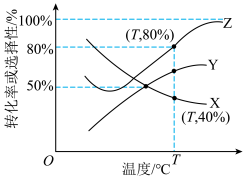
 的转化率曲线是
的转化率曲线是 的选择性曲线是
的选择性曲线是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】为了减少温室气体排放,目前工业上采用CO2与H2在CuO-ZnO/ZrO催化下反应制备重要化工原料CH3OH的工艺:CO2(g)+3H2(g) CH3OH(g)+H2O(g);⊿H<0。为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
CH3OH(g)+H2O(g);⊿H<0。为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
根据题目回答下列问题:
(1)0~3 s内用H2表示的平均反应速率是__________ ,
(2)平衡时CO2的转化率是_______ 。
(3)能说明反应已达平衡状态的是_________________ 。
A.υ(H2)=3υ(CO2) B.容器内压强保持不变
C.υ逆(CO2)=υ正(CH3OH) D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是______________ 。(填序号)
A.及时分离出产物 B.适当升高温度
C.增大CO2浓度 D.选择适当的催化剂
 CH3OH(g)+H2O(g);⊿H<0。为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
CH3OH(g)+H2O(g);⊿H<0。为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
根据题目回答下列问题:
(1)0~3 s内用H2表示的平均反应速率是
(2)平衡时CO2的转化率是
(3)能说明反应已达平衡状态的是
A.υ(H2)=3υ(CO2) B.容器内压强保持不变
C.υ逆(CO2)=υ正(CH3OH) D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是
A.及时分离出产物 B.适当升高温度
C.增大CO2浓度 D.选择适当的催化剂
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】推动CO2的综合利用实现碳中和是党中央作出的重大战略决策。
(1)科学家利用电化学装置实现CH4和CO2两种分子的耦合转化,其原理如图所示:
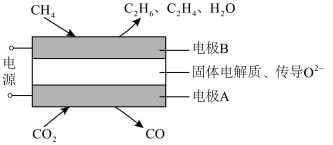
①电极A上的电极反应式为___________ 。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比___________ 。
(2)在一定温度下,CO2一定条件可转化为CH3OH,
 。
。
①下列有关该反应的说法正确的是___________ 。
A.升高温度逆反应速率加快,正反应速率减慢
B.反应体系中CH3OH浓度不再变化,说明反应达到平衡状态
C.恒温恒容下达到平衡后,再通入N2,反应速率不变
D.平衡时,若改变体积增大压强,则平衡常数K变大
②某温度下恒容密闭容器中,CO2和H2起始浓度分别为a mol/L和3a mol/L ,反应达平衡时,CO2转化率为b,该温度下反应的平衡常数K=___________ 。
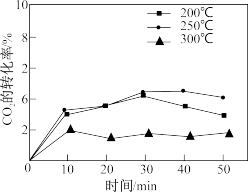
(3)CO2与丙烯催化合成甲基丙烯酸。催化剂在温度不同时对CO2转化率的影响如图所示,300℃时CO2转化率低于200℃和250℃的原因可能为___________ 。
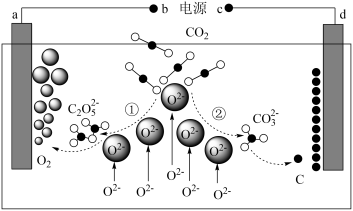
(4)我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下。过程①的反应式为___________ ,a极的电极反应式为___________ 。
(1)科学家利用电化学装置实现CH4和CO2两种分子的耦合转化,其原理如图所示:

①电极A上的电极反应式为
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比
(2)在一定温度下,CO2一定条件可转化为CH3OH,

 。
。①下列有关该反应的说法正确的是
A.升高温度逆反应速率加快,正反应速率减慢
B.反应体系中CH3OH浓度不再变化,说明反应达到平衡状态
C.恒温恒容下达到平衡后,再通入N2,反应速率不变
D.平衡时,若改变体积增大压强,则平衡常数K变大
②某温度下恒容密闭容器中,CO2和H2起始浓度分别为a mol/L和3a mol/L ,反应达平衡时,CO2转化率为b,该温度下反应的平衡常数K=
(3)CO2与丙烯催化合成甲基丙烯酸。催化剂在温度不同时对CO2转化率的影响如图所示,300℃时CO2转化率低于200℃和250℃的原因可能为

(4)我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下。过程①的反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH <0
2SO3(g) ΔH <0
(1)降低温度,该反应K值______ ,二氧化硫转化率______ 。(以上均填“增大”“减小”或“不变”)
(2)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是______________________ 。
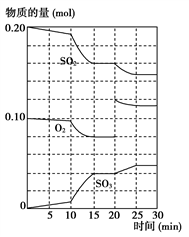
(3)据上图判断,反应进行至20 min时,曲线发生变化的原因是__________________ (用文字表达)。
(4)可用上述反应中某种物理量来说明该反应已达到平衡状态的是_______ 。
A .SO2的生成速率与SO3的生成速率相等
B. 消耗a mol SO2的同时生成a mol SO3
C. 各组分浓度不在发生变化
D.恒容体系中压强不再发生变化
E. 恒容体系中气体密度不再变化
F. ΔH不再发生变化
G.容器里SO2、O2、SO3的浓度比是2:1:2
 2SO3(g) ΔH <0
2SO3(g) ΔH <0(1)降低温度,该反应K值
(2)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是

(3)据上图判断,反应进行至20 min时,曲线发生变化的原因是
(4)可用上述反应中某种物理量来说明该反应已达到平衡状态的是
A .SO2的生成速率与SO3的生成速率相等
B. 消耗a mol SO2的同时生成a mol SO3
C. 各组分浓度不在发生变化
D.恒容体系中压强不再发生变化
E. 恒容体系中气体密度不再变化
F. ΔH不再发生变化
G.容器里SO2、O2、SO3的浓度比是2:1:2
您最近一年使用:0次