磷酸根离子的空间构型为___________ ,其中P的价层电子对数为___________ 、杂化轨道类型为___________ 。
2021高三·全国·专题练习 查看更多[5]
(已下线)考点34 分子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考向37 分子结构与性质-备战2022年高考化学一轮复习考点微专题(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第一部分 二轮专题突破 专题20 原子结构、分子结构与性质的基础考查(选考)(已下线)02 常考题空2 立体构型及杂化类型的判断 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
更新时间:2021-08-10 11:15:12
|
相似题推荐
填空题
|
较易
(0.85)
名校
【推荐1】铝广泛应用于航空、建筑、汽车等行业,目前工业上采用电解氧化铝和冰晶石混合物的方法制取铝。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.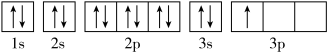
B.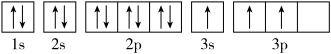
C.
D.
其中能量最低的是____ (填字母),电子由状态C到状态B所得原子光谱为____ 光谱(填“发射”或“吸收”) ,状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合_____ 。
(2)熔融态氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。
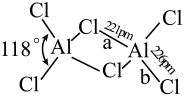
①a键的键能_____ b键的键能(填“>”“<”或“=”),其理由是_______ 。
②Al2Cl6中铝原子的杂化方式为___ ;AlCl3的空间结构为______ 。
(3)冰晶石属于离子化合物,由Na+和AlF63−组成,在冰晶石的晶胞中,AlF63−占据的位置相当于氯化钠晶胞中Cl−的位置。
①冰晶石的化学式为_____ ,一个冰晶石晶胞中Na+的个数为_____ 。
②已知冰晶石的密度为2.95 g/cm3,则冰晶石晶胞的边长a=____ pm(列出算式即可,阿伏伽德罗常数值为6.02×1023)。
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.

B.

C.

D.

其中能量最低的是
(2)熔融态氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。

①a键的键能
②Al2Cl6中铝原子的杂化方式为
(3)冰晶石属于离子化合物,由Na+和AlF63−组成,在冰晶石的晶胞中,AlF63−占据的位置相当于氯化钠晶胞中Cl−的位置。
①冰晶石的化学式为
②已知冰晶石的密度为2.95 g/cm3,则冰晶石晶胞的边长a=
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】回答下列问题:
(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是____ 、中心原子的杂化形式为____ 。LiAlH4中,存在____ (填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(2)Li2O是离子晶体,其晶格能可通过图(a)的Born-Haber循环计算得到。

可知,Li原子的第一电离能为____ kJ•mol-1,O=O键键能为_____ kJ•mol-1,Li2O晶格能为____ kJ•mol-1。
(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是
A.离子键 B.σ键 C.π键 D.氢键
(2)Li2O是离子晶体,其晶格能可通过图(a)的Born-Haber循环计算得到。

可知,Li原子的第一电离能为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃时反应获得。
(1)N的电子排布式为_______ ,其能量最高的电子共有_______ 个;氮气的结构式为_______ ;氮化硅属于_______ 晶体。
(2)氮化硅陶瓷抗腐蚀能力强,但氢氟酸能将其腐蚀,反应时的产物之一为NH3。NH3的分子构型为_______ ,上述反应的化学方程式为_______ 。有时发生上述反应过程中无NH3放出,推测可能生成了_______ (填化学式),其内部存在的化学键是_______ 。
(3)试比较SiF4和SiCl4的熔点高低并说明理由_______ 。
(4)四氯化硅能被氢气还原为单质硅。目前,工业上常利用四氯化硅、氮气和氢气,加强热后制备较高纯度的氮化硅。该过程需通入过量氢气,分析原因_______ 。
(1)N的电子排布式为
(2)氮化硅陶瓷抗腐蚀能力强,但氢氟酸能将其腐蚀,反应时的产物之一为NH3。NH3的分子构型为
(3)试比较SiF4和SiCl4的熔点高低并说明理由
(4)四氯化硅能被氢气还原为单质硅。目前,工业上常利用四氯化硅、氮气和氢气,加强热后制备较高纯度的氮化硅。该过程需通入过量氢气,分析原因
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】考查下列三种分子:BF3、NF3、IF3,分别回答下列问题:
(1)写出各分子的路易斯电子结构式(用点和线标示原子的价电子结构):_______
(2)预言它们的几何构型,包括所有的键角:_______
(3)说明它们是否是极性分子,简述你的理由:_______
(4)讨论它们可能的路易斯酸碱性_______ 。
(1)写出各分子的路易斯电子结构式(用点和线标示原子的价电子结构):
(2)预言它们的几何构型,包括所有的键角:
(3)说明它们是否是极性分子,简述你的理由:
(4)讨论它们可能的路易斯酸碱性
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】 的几何构型为
的几何构型为_______ ,其中心离子杂化方式为_______ 。
 的几何构型为
的几何构型为
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】乙炔分子的成键情况

(1)碳原子的杂化方式:碳原子为_______ 杂化,形成2个_______ 杂化轨道。
(2)成键方式和空间构型:每个碳原子的_______ 杂化轨道分别与1个氢原子的_______ 轨道形成2个C-H_______ 键(sp—s),与另一个碳原子的_______ 杂化轨道形成C-C_______ 键(sp—sp)。碳原子未杂化的2p轨道两两形成2个_______ 键。乙炔分子的空间构型为_______ 形。
(3)C≡C、C≡N、CO2中的碳原子,都是_______ 杂化。

(1)碳原子的杂化方式:碳原子为
(2)成键方式和空间构型:每个碳原子的
(3)C≡C、C≡N、CO2中的碳原子,都是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】C、N、O、F等元素的化合物在航天、美容、食品等多领域中有广泛的用途,请回答:
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为______ ;N、O、F的第一电离能由大到小的顺序为_____ (用元素符号表示)。
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为______ 晶体(填晶体类型)。
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第______ 周期第______ 族。
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO 的作用类型分别是
的作用类型分别是______ 、______ 。
A.离子键 B.配位键 C.氢键 D.金属键 中键角的大小并解释原因:
中键角的大小并解释原因:______ 。
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO
 的作用类型分别是
的作用类型分别是A.离子键 B.配位键 C.氢键 D.金属键
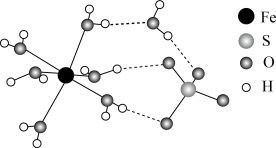
 中键角的大小并解释原因:
中键角的大小并解释原因:
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】据《科学》报道,中国科学家首次实现超导体(Bi2Te3/NBSe2)中分段费米面。回答下列问题:
(1)Bi与P位于同主族,基态P原子的价层电子排布式为___________ 。基态Se原子核外电子云轮廓图呈哑铃形的能级上共有___________ 个电子。
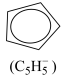
(2)二氯二茂铌的组成为(C5H5)2NbCl2.环戊二烯阴离子(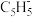 )的平面结构简式如图所示:
)的平面结构简式如图所示:
①C、H、Cl的电负性由大到小的顺序为___________ 。
②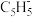 中C原子的杂化类型是
中C原子的杂化类型是___________ 。
③已知分子中的大π键可以用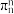 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则 中大π键可以表示为
中大π键可以表示为___________ 。
(3) 的空间构型为
的空间构型为___________ 。
(4)四氟化铌(NbF4)的熔点为72℃,它的晶体类型为___________ 。
(1)Bi与P位于同主族,基态P原子的价层电子排布式为
(2)二氯二茂铌的组成为(C5H5)2NbCl2.环戊二烯阴离子(
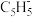 )的平面结构简式如图所示:
)的平面结构简式如图所示:
①C、H、Cl的电负性由大到小的顺序为
②
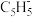 中C原子的杂化类型是
中C原子的杂化类型是③已知分子中的大π键可以用
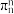 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则 中大π键可以表示为
中大π键可以表示为(3)
 的空间构型为
的空间构型为(4)四氟化铌(NbF4)的熔点为72℃,它的晶体类型为
您最近一年使用:0次



