判断正误:
1.弱电解质的电离平衡右移,电离平衡常数一定增大。_______
2.电离常数大的酸溶液中的c(H+)一定比电离常数小的酸溶液中的c(H+)大。_______
3.某一弱电解质,电离度越大,电离常数就越大。_______
4.相同温度下,向1mol·L-1的醋酸溶液中加入少量冰醋酸,其电离度变小。_______
5.常温时,0.1mol·L-1氨水的pH=11.1:NH3·H2O⇌NH +OH-。
+OH-。_______
6.常温下,0.1mol·L-1CH3COONa溶液的pH大于7能证明乙酸是弱酸。_______
7.室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力增强。_______
8.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度。_______
9.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小。
减小。_______
10.室温下向10mL0.1mol/L的氨水中加水稀释后,溶液中 不变。
不变。_______
11.等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合: <
<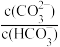 。
。_______
12.将浓度为0.1mol·L-1HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,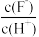 始终增大。
始终增大。_______
1.弱电解质的电离平衡右移,电离平衡常数一定增大。
2.电离常数大的酸溶液中的c(H+)一定比电离常数小的酸溶液中的c(H+)大。
3.某一弱电解质,电离度越大,电离常数就越大。
4.相同温度下,向1mol·L-1的醋酸溶液中加入少量冰醋酸,其电离度变小。
5.常温时,0.1mol·L-1氨水的pH=11.1:NH3·H2O⇌NH
 +OH-。
+OH-。6.常温下,0.1mol·L-1CH3COONa溶液的pH大于7能证明乙酸是弱酸。
7.室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力增强。
8.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度。
9.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中
 减小。
减小。10.室温下向10mL0.1mol/L的氨水中加水稀释后,溶液中
 不变。
不变。11.等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合:
 <
<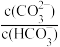 。
。12.将浓度为0.1mol·L-1HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,
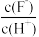 始终增大。
始终增大。
更新时间:2021-08-10 12:44:15
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】醋酸是重要的一元酸,在有机和无机反应中都有应用。现有25 ℃时,pH=3的醋酸。请回答以下问题:
(1)若向醋酸中加入少量醋酸钠固体,此时溶液中
________ (填“增大”“减小”或“不变”)。
(2)若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH________ (填“>”“<”或“=”)7,用离子方程式表示其原因_____________________________________ 。
(3)若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是___________________________________________ 。
(4)若向醋酸中加入NaOH溶液至溶液恰好呈中性,此时c(Na+)______ c(CH3COO-)(填“>”、“<”或“=”)。
(5)若向醋酸中加入一定量NaOH溶液,所得混合液pH=6,则此溶液中c(CH3COO-)-C(Na+)=________ mol/L(填写准确数据)。
(1)若向醋酸中加入少量醋酸钠固体,此时溶液中

(2)若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH
(3)若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是
(4)若向醋酸中加入NaOH溶液至溶液恰好呈中性,此时c(Na+)
(5)若向醋酸中加入一定量NaOH溶液,所得混合液pH=6,则此溶液中c(CH3COO-)-C(Na+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,根据所学知识回答下列问题:
(1)下列方法中,可以使 溶液中
溶液中 值增大的措施是
值增大的措施是_______ (填序号)。
a.加水稀释
b.加入少量 固体
固体
c.加少量烧碱溶液
(2)常温下,将 的酸HA溶液某和
的酸HA溶液某和 的NaOH溶液等体积混合后,混合溶液的
的NaOH溶液等体积混合后,混合溶液的 。由此可知,酸HA是酸
。由此可知,酸HA是酸_______ (填“强”或“弱”),该混合溶液中
_______ mol/L(填数值)。若将等浓度的此酸HA溶液和NaOH溶液等体积混合,混合后溶液呈_______ 性,其原因可用离子方程式表示为_______ 。
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a. ;b.NaClO;c.
;b.NaClO;c. 。(已知25℃时电离常数:
。(已知25℃时电离常数:
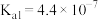 ,
, ,HClO
,HClO 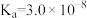 ;
;
 )
)
①三种溶液pH最大的是_______ (用序号表示)。
②溶液a的pH大于8,则溶液中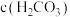
_______ 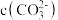 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)已知25℃时, ,
, 。该温度下,
。该温度下, 和
和 共存的悬浊液中,
共存的悬浊液中,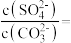
_______ 。
(1)下列方法中,可以使
 溶液中
溶液中 值增大的措施是
值增大的措施是a.加水稀释
b.加入少量
 固体
固体c.加少量烧碱溶液
(2)常温下,将
 的酸HA溶液某和
的酸HA溶液某和 的NaOH溶液等体积混合后,混合溶液的
的NaOH溶液等体积混合后,混合溶液的 。由此可知,酸HA是酸
。由此可知,酸HA是酸
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.
 ;b.NaClO;c.
;b.NaClO;c. 。(已知25℃时电离常数:
。(已知25℃时电离常数:
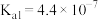 ,
, ,HClO
,HClO 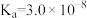 ;
;
 )
)①三种溶液pH最大的是
②溶液a的pH大于8,则溶液中
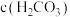
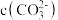 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)已知25℃时,
 ,
, 。该温度下,
。该温度下, 和
和 共存的悬浊液中,
共存的悬浊液中,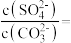
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】某一元弱酸(用HA表示)在水中的电离方程式是HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向___________ (填“正”或“逆”)反应方向移动。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向___________ (填“正”或“逆”)反应方向移动,溶液中c(A-)将___________ (填“增大”“减小”或“不变”,下同),溶液中c(OH-)将___________ 。
(3)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c( )=c(Cl-),则溶液显
)=c(Cl-),则溶液显___________ 性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=___________
(4)①现有室温下pH均为5的 溶液和
溶液和 溶液。两种溶液中,
溶液。两种溶液中,
___________ 。
② 和
和 两种溶液中,由水电离出的
两种溶液中,由水电离出的 分别为
分别为___________ 、___________ 。
 H++A-,回答下列问题:
H++A-,回答下列问题:(1)向溶液中加入适量NaA固体,以上平衡将向
(2)若向溶液中加入适量NaCl溶液,以上平衡将向
(3)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显(4)①现有室温下pH均为5的
 溶液和
溶液和 溶液。两种溶液中,
溶液。两种溶液中,
②
 和
和 两种溶液中,由水电离出的
两种溶液中,由水电离出的 分别为
分别为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】I.水是一种很好的溶剂,也是物质发生化学反应的主要介质。
(1)某温度下纯水中的 ,则此时溶液中的
,则此时溶液中的
___________  。
。
A.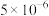 B.
B.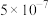 C.
C.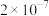 D.
D.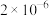
在该温度下,0.04 的NaOH溶液的pH=
的NaOH溶液的pH=___________ 。
(2)该温度下,某溶液中由水电离产生的 和
和 的乘积为
的乘积为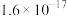 ,则该溶液的pH=
,则该溶液的pH=___________ 。
Ⅱ.室温下,在1 的某二元酸H2A溶液中,含A元素。组分的物质的量分数随pH变化的关系如图所示。
的某二元酸H2A溶液中,含A元素。组分的物质的量分数随pH变化的关系如图所示。

(3)写出H2A的电离方程式___________ 。
(4)根据图像,计算室温下HA-的电离平衡常数的数值Ka=___________ 。(写出计算过程)
(5)等物质的量浓度NaHA和Na2A溶液等体积混合,比较混合后的溶液中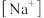 、
、 、
、 的大小正确的是___________。
的大小正确的是___________。
(1)某温度下纯水中的
 ,则此时溶液中的
,则此时溶液中的
 。
。A.
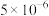 B.
B.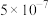 C.
C.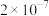 D.
D.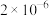
在该温度下,0.04
 的NaOH溶液的pH=
的NaOH溶液的pH=(2)该温度下,某溶液中由水电离产生的
 和
和 的乘积为
的乘积为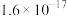 ,则该溶液的pH=
,则该溶液的pH=Ⅱ.室温下,在1
 的某二元酸H2A溶液中,含A元素。组分的物质的量分数随pH变化的关系如图所示。
的某二元酸H2A溶液中,含A元素。组分的物质的量分数随pH变化的关系如图所示。
(3)写出H2A的电离方程式
(4)根据图像,计算室温下HA-的电离平衡常数的数值Ka=
(5)等物质的量浓度NaHA和Na2A溶液等体积混合,比较混合后的溶液中
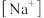 、
、 、
、 的大小正确的是___________。
的大小正确的是___________。A. | B. |
C.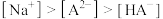 | D. |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)为了证明NH3·H2O是弱电解质,甲、乙、丙、丁、戊五人分别进行如下实验。
①甲用pH试纸测出0.010mol·L-1氨水的pH为10,则认定NH3·H2O是弱电解质,你认为这一方法________ (填“正确”或“不正确”)。
②乙取相同pH、相同体积的氨水与NaOH溶液,加入几滴酚酞溶液后,分别滴入同浓度的盐酸至溶液刚好褪色。实验结束后,测得消耗的盐酸的体积分别为amL和bmL。若a____ b(填“>”、“=”或“<”),则证明氨水是弱碱。
③丙取出10mL0.010mol·L-1氨水,滴入2滴酚酞溶液,显红色,再加入少量NH4Cl晶体,颜色变______ (填“深”或“浅”)。你认为证明氨水是弱碱的原因是______ 。
④丁取出10mL0.010mol·L-1氨水,用pH试纸测其pH= a,然后用蒸馏水稀释至1000mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是_____ 。
(2)已知室温时,0.1mol·L-1的某一元酸HA在水中有0.1%发生电离,回答下列各问题:
①HA的电离平衡常数K=______ 。
②由HA电离出的c(H+约为水电离出的c(H+)的______ 倍。
①甲用pH试纸测出0.010mol·L-1氨水的pH为10,则认定NH3·H2O是弱电解质,你认为这一方法
②乙取相同pH、相同体积的氨水与NaOH溶液,加入几滴酚酞溶液后,分别滴入同浓度的盐酸至溶液刚好褪色。实验结束后,测得消耗的盐酸的体积分别为amL和bmL。若a
③丙取出10mL0.010mol·L-1氨水,滴入2滴酚酞溶液,显红色,再加入少量NH4Cl晶体,颜色变
④丁取出10mL0.010mol·L-1氨水,用pH试纸测其pH= a,然后用蒸馏水稀释至1000mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是
(2)已知室温时,0.1mol·L-1的某一元酸HA在水中有0.1%发生电离,回答下列各问题:
①HA的电离平衡常数K=
②由HA电离出的c(H+约为水电离出的c(H+)的
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】化学上把外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液。现有25°C时,浓度均为0.10 mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。回答下列问题:
(1)写出CH3COONa水解的离子方程式_____________ ,改变下列条件,能使CH3COONa稀溶液中 保持增大的是
保持增大的是_______ 。
a.升温b.加入NaOH固体c.稀释d.加入CH3COONa固体
(2)该缓冲溶液中除水分子外,所有粒子浓度由大到小的顺序_____________ 。
(3)人体血液里主要通过碳酸氢盐缓冲体系(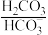 )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,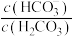 ≈
≈ ,1g2=0.3。由题给数据可算得正常人体血液的pH约为
,1g2=0.3。由题给数据可算得正常人体血液的pH约为_______ ,当过量的酸进入血液中时,血液缓冲体系中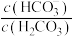 的值将
的值将__________ (填“变大” “变小”或“不变”)。
(1)写出CH3COONa水解的离子方程式
 保持增大的是
保持增大的是a.升温b.加入NaOH固体c.稀释d.加入CH3COONa固体
(2)该缓冲溶液中除水分子外,所有粒子浓度由大到小的顺序
(3)人体血液里主要通过碳酸氢盐缓冲体系(
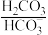 )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,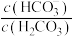 ≈
≈ ,1g2=0.3。由题给数据可算得正常人体血液的pH约为
,1g2=0.3。由题给数据可算得正常人体血液的pH约为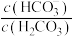 的值将
的值将
您最近一年使用:0次



