化学上把外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液。现有25°C时,浓度均为0.10 mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。回答下列问题:
(1)写出CH3COONa水解的离子方程式_____________ ,改变下列条件,能使CH3COONa稀溶液中 保持增大的是
保持增大的是_______ 。
a.升温b.加入NaOH固体c.稀释d.加入CH3COONa固体
(2)该缓冲溶液中除水分子外,所有粒子浓度由大到小的顺序_____________ 。
(3)人体血液里主要通过碳酸氢盐缓冲体系(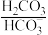 )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,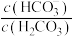 ≈
≈ ,1g2=0.3。由题给数据可算得正常人体血液的pH约为
,1g2=0.3。由题给数据可算得正常人体血液的pH约为_______ ,当过量的酸进入血液中时,血液缓冲体系中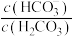 的值将
的值将__________ (填“变大” “变小”或“不变”)。
(1)写出CH3COONa水解的离子方程式
 保持增大的是
保持增大的是a.升温b.加入NaOH固体c.稀释d.加入CH3COONa固体
(2)该缓冲溶液中除水分子外,所有粒子浓度由大到小的顺序
(3)人体血液里主要通过碳酸氢盐缓冲体系(
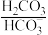 )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,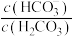 ≈
≈ ,1g2=0.3。由题给数据可算得正常人体血液的pH约为
,1g2=0.3。由题给数据可算得正常人体血液的pH约为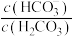 的值将
的值将
19-20高二下·四川乐山·期末 查看更多[4]
江西省吉安县立中学2020-2021学年高二上学期期中考试化学试题四川省广安代市中学2019-2020学年高二下学期第二次月考化学试题(已下线)第03章 水溶液中的离子平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)四川省乐山市2019-2020学年高二下学期期末考试化学试题
更新时间:2020-08-02 03:50:39
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】依据醋酸的性质,请回答下列问题(以下讨论均在常温时)。
(1)取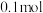 (冰醋酸)作导电性实验,稀释过程中溶液的导电能力变化如下图所示。
(冰醋酸)作导电性实验,稀释过程中溶液的导电能力变化如下图所示。

① 的电离方程式是
的电离方程式是_______ 。
②a、b、c三点中 最小的是
最小的是_______ 。
③在稀释过程中,
_______ (填“增大”“减小”或“不确定”)。
(2)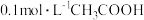 溶液的
溶液的 ,该溶液中由水电离出的
,该溶液中由水电离出的 浓度是
浓度是_______  。
。
(3)向相同的两密闭容器中加入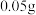 镁条,分别注入
镁条,分别注入 盐酸、
盐酸、 醋酸,测得容器内压强随时间变化如下图所示。
醋酸,测得容器内压强随时间变化如下图所示。

①反应为醋酸的曲线是_______ (填字母)。
②反应开始时反应速率 的原因是
的原因是_______ 。
(1)取
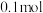 (冰醋酸)作导电性实验,稀释过程中溶液的导电能力变化如下图所示。
(冰醋酸)作导电性实验,稀释过程中溶液的导电能力变化如下图所示。
①
 的电离方程式是
的电离方程式是②a、b、c三点中
 最小的是
最小的是③在稀释过程中,

(2)
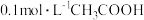 溶液的
溶液的 ,该溶液中由水电离出的
,该溶液中由水电离出的 浓度是
浓度是 。
。(3)向相同的两密闭容器中加入
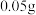 镁条,分别注入
镁条,分别注入 盐酸、
盐酸、 醋酸,测得容器内压强随时间变化如下图所示。
醋酸,测得容器内压强随时间变化如下图所示。
①反应为醋酸的曲线是
②反应开始时反应速率
 的原因是
的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】25 ℃时,部分物质的电离常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________ 。
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为______ 。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________ (填序号),一定不变的是________ (填序号)。一定变大的是________ (填序号),
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E. c(CH3COO-)·c(H+)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是____________ (填序号)。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7,K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E. c(CH3COO-)·c(H+)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是
您最近一年使用:0次
填空题
|
适中
(0.65)
真题
名校
【推荐3】吸收工厂烟气中的SO2,能有效减少SO2对空气的污染。氨水、ZnO水悬浊液吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。
已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO3-、SO32-的物质的量分数随pH的分布如图-1所示。
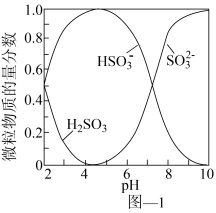
(1)氨水吸收SO2。向氨水中通入少量SO2,主要反应的离子方程式为___________ ;当通入SO2至溶液pH=6时,溶液中浓度最大的阴离子是_____________ (填化学式)。
(2)ZnO水悬浊液吸收SO2。向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图-2)。溶液pH几乎不变阶段,主要产物是____________ (填化学式);SO2吸收率迅速降低阶段,主要反应的离子方程式为_______________ 。

(3)O2催化氧化。其他条件相同时,调节吸收SO2得到溶液的pH在4.5~6.5范围内,pH越低SO 生成速率越大,其主要原因是
生成速率越大,其主要原因是__________ ;随着氧化的进行,溶液的pH将__________ (填“增大”、“减小”或“不变”)。
已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO3-、SO32-的物质的量分数随pH的分布如图-1所示。

(1)氨水吸收SO2。向氨水中通入少量SO2,主要反应的离子方程式为
(2)ZnO水悬浊液吸收SO2。向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图-2)。溶液pH几乎不变阶段,主要产物是

(3)O2催化氧化。其他条件相同时,调节吸收SO2得到溶液的pH在4.5~6.5范围内,pH越低SO
 生成速率越大,其主要原因是
生成速率越大,其主要原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。
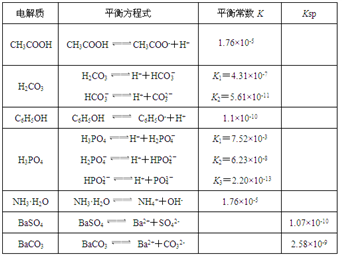
回答下列问题(C6H5OH为苯酚):
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为___________ (填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式:______ ;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______ c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是______ ;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O-)+ c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式____ 。
(6)如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

① T1______ T2(填>、=、<)。
② 讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是______ 。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
③现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理______ 次。[提示: BaSO4(s)+ CO32- (aq) BaCO3(s)+ SO42- (aq) ]
BaCO3(s)+ SO42- (aq) ]

回答下列问题(C6H5OH为苯酚):
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为
(2)写出C6H5OH与Na3PO4反应的离子方程式:
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O-)+ c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式
(6)如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

① T1
② 讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
③现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理
 BaCO3(s)+ SO42- (aq) ]
BaCO3(s)+ SO42- (aq) ]
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】已知氢硫酸是一种二元弱酸,请回答以下问题:
(1)已知 0.1mol/L NaHS 溶液显碱性,则c(S2-)___ c(H2S)(填“>”“<”或“=”)。
(2)常温下,向 0.2mol/L的 H2S溶液中逐滴滴入 0.2mol/L NaOH 溶液至中性,此时溶液中以下所示关系不正确的是___ (填字母)。
(3)已知常温下,CaS饱和溶液中存在平衡CaS(s) ⇌Ca2+(aq)+S2-(aq) △H>0。
①温度升高时,KSP(CaS ) =___ (填“增大”“减少”或“不变”,下同)。
②滴加少量浓盐酸时,c(Ca2+ )___ ,原因是___ (用文字和离子方程式说明)。
③若向CaS 饱和溶液中加入Cu(NO3)2 溶液中,生成一种黑色固体物质,写出该过程中反应的离子方程式:___ 。
(1)已知 0.1mol/L NaHS 溶液显碱性,则c(S2-)
(2)常温下,向 0.2mol/L的 H2S溶液中逐滴滴入 0.2mol/L NaOH 溶液至中性,此时溶液中以下所示关系不正确的是
| A.c(H+)·c(OH-)=1×10-14 |
| B.c(Na+)=c(HS-)+2c(S2-) |
| C.c(Na+)> c(HS-)+c(S2-)+ c(H2S) |
| D.c(H2S)> c(S2-) |
①温度升高时,KSP(CaS ) =
②滴加少量浓盐酸时,c(Ca2+ )
③若向CaS 饱和溶液中加入Cu(NO3)2 溶液中,生成一种黑色固体物质,写出该过程中反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知25℃时,电离平衡常数:
回答下列问题:
(1)下列四种物质电离出质子的能力由大到小的顺序是___________ (填标号)。
a、HCO3- b、HClO c、CH3COOH d、H2CO3
(2)下列反应不能发生的是___________。
(3)用蒸馏水稀释0.10mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___________。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.4×10-7K2=4.7×10-11 | 3.0×10-8 |
(1)下列四种物质电离出质子的能力由大到小的顺序是
a、HCO3- b、HClO c、CH3COOH d、H2CO3
(2)下列反应不能发生的是___________。
A. |
| B.ClO-+CH3COOH=CH3COO-+HClO |
C.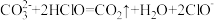 |
D.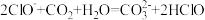 |
A. | B. | C. | D. |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】某同学将适量的石灰石颗粒置于 饱和溶液中,后续实验过程及典型实验现象如图所示。
饱和溶液中,后续实验过程及典型实验现象如图所示。
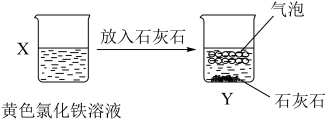

请回答下列问题:
(1) 能促进水的电离,其理由是
能促进水的电离,其理由是______ ;若饱和 溶液的
溶液的 ,则由水电离出的
,则由水电离出的 和
和 乘积为
乘积为______ 。
(2)用一个离子方程式解释Y中现象:______ 。
(3)将Y放置一昼夜后,将所得到的透明液体(记为Z)转移到另一个烧杯,并进行相应的实验(见图),则X、Z中分散质粒子直径较大的是______ ,将X溶液蒸干并灼烧,最后得到的固体物质是______ (填化学式)。
(4)若向 溶液中加入足量镁粉,充分反应后不可能得到的物质是
溶液中加入足量镁粉,充分反应后不可能得到的物质是______ (填字母序号)。
A.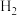 B.
B. C.
C. D.
D.
 饱和溶液中,后续实验过程及典型实验现象如图所示。
饱和溶液中,后续实验过程及典型实验现象如图所示。

请回答下列问题:
(1)
 能促进水的电离,其理由是
能促进水的电离,其理由是 溶液的
溶液的 ,则由水电离出的
,则由水电离出的 和
和 乘积为
乘积为(2)用一个离子方程式解释Y中现象:
(3)将Y放置一昼夜后,将所得到的透明液体(记为Z)转移到另一个烧杯,并进行相应的实验(见图),则X、Z中分散质粒子直径较大的是
(4)若向
 溶液中加入足量镁粉,充分反应后不可能得到的物质是
溶液中加入足量镁粉,充分反应后不可能得到的物质是A.
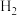 B.
B. C.
C. D.
D.
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】按要求填空
(1)常温时的Fe2(SO4)3的水溶液pH_______ 7(填“>”“<”或“=”),原因是(用离子方程式表示):_______ 。
(2)将AlCl3溶液蒸干、灼烧,最后所得的固体的主要成分是_______ 。
(3)纯碱溶液显碱性,原因是(用离子方程式表示):_______ 。
(4)物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是_______ 。
(5)常温时,向明矾溶液中逐滴加入Ba(OH)2溶液至SO 刚好沉淀完全时,溶液的pH
刚好沉淀完全时,溶液的pH_______ 7(填“>”“<”或“=”),离子反应总方程式为:_______ 。
(1)常温时的Fe2(SO4)3的水溶液pH
(2)将AlCl3溶液蒸干、灼烧,最后所得的固体的主要成分是
(3)纯碱溶液显碱性,原因是(用离子方程式表示):
(4)物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
(5)常温时,向明矾溶液中逐滴加入Ba(OH)2溶液至SO
 刚好沉淀完全时,溶液的pH
刚好沉淀完全时,溶液的pH
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】已知:硫酸、硒酸、亚磷酸等是二元酸。请根据所给信息完成下列问题。
(1)硒酸(H2SeO4)在水溶液中的电离如下: ,
, ,
,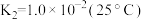 。
。
①向 溶液中滴加少量氨水,该反应的离子方程式为
溶液中滴加少量氨水,该反应的离子方程式为___________ 。
②已知 的电离平衡常数
的电离平衡常数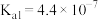 ,
, ,则
,则 和
和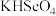 两溶液混合反应的离子方程式为:
两溶液混合反应的离子方程式为:___________ 。
(2)亚磷酸( )是二元弱酸,已知常温下
)是二元弱酸,已知常温下 的电离常数的值:
的电离常数的值: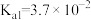 ,
, 。则
。则 溶液显
溶液显___________ 性。(选填“酸”、“碱”或“中”)
(3)某化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸( )具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为:
)具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为: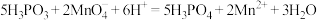 。
。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:___________ 。
②已知三次滴定的测量数据如下表,该亚磷酸溶液的物质的量浓度为______  。(保留小数点后两位)
。(保留小数点后两位)
(4)某研究性学习小组在实验室中配制 的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是
的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是___________ 。
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
(1)硒酸(H2SeO4)在水溶液中的电离如下:
 ,
, ,
,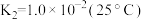 。
。①向
 溶液中滴加少量氨水,该反应的离子方程式为
溶液中滴加少量氨水,该反应的离子方程式为②已知
 的电离平衡常数
的电离平衡常数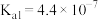 ,
, ,则
,则 和
和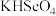 两溶液混合反应的离子方程式为:
两溶液混合反应的离子方程式为:(2)亚磷酸(
 )是二元弱酸,已知常温下
)是二元弱酸,已知常温下 的电离常数的值:
的电离常数的值: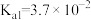 ,
, 。则
。则 溶液显
溶液显(3)某化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸(
 )具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为:
)具有较强的还原性,能被酸性溶液氧化为磷酸,其反应原理为: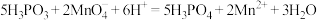 。
。①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:
②已知三次滴定的测量数据如下表,该亚磷酸溶液的物质的量浓度为
 。(保留小数点后两位)
。(保留小数点后两位)| 试验编号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 22.00 |
| 2 | 0.50 | 22.50 |
| 3 | 0.50 | 25.50 |
(4)某研究性学习小组在实验室中配制
 的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是
的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】回答下列问题:
(1)在一定温度下, 在水中的沉淀溶解平衡可用离子方程式表示为
在水中的沉淀溶解平衡可用离子方程式表示为_________ ,该平衡的 可表示为
可表示为_________ 。
(2)醋酸钠溶液呈碱性的原因是_________ (用离子方程式表示)。
(3)已知常温下 的
的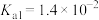 ,
, ,则
,则 溶液中水的电离程度
溶液中水的电离程度_________ 纯水中水的电离程度(填“>”、“<”或“=”)。
(4)已知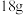 葡萄糖
葡萄糖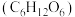 固体在人体组织中被
固体在人体组织中被 完全氧化为
完全氧化为 气体和液态水,能产生
气体和液态水,能产生 热量。写出该反应的热化学方程式
热量。写出该反应的热化学方程式_________ 。
(1)在一定温度下,
 在水中的沉淀溶解平衡可用离子方程式表示为
在水中的沉淀溶解平衡可用离子方程式表示为 可表示为
可表示为(2)醋酸钠溶液呈碱性的原因是
(3)已知常温下
 的
的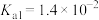 ,
, ,则
,则 溶液中水的电离程度
溶液中水的电离程度(4)已知
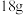 葡萄糖
葡萄糖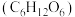 固体在人体组织中被
固体在人体组织中被 完全氧化为
完全氧化为 气体和液态水,能产生
气体和液态水,能产生 热量。写出该反应的热化学方程式
热量。写出该反应的热化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】氢氟酸能腐蚀玻璃。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
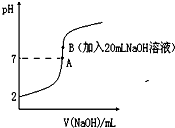
已知:电离度(α)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[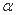 (HF)]增大的是
(HF)]增大的是_______ ,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_____________ 。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:_____ ,电离度α(HF)为______ %。
(3)下列有关图中各点微粒浓度关系正确的是________ 。
a.在A处溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合: = Ka(HF)
= Ka(HF)
(4)向此氢氟酸溶液中滴加10mlNaOH溶液后,请将HF分子与溶液中的离子浓度一起从大到小排序___________________________________________

已知:电离度(α)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。

请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[
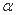 (HF)]增大的是
(HF)]增大的是a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:
(3)下列有关图中各点微粒浓度关系正确的是
a.在A处溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合:
 = Ka(HF)
= Ka(HF)(4)向此氢氟酸溶液中滴加10mlNaOH溶液后,请将HF分子与溶液中的离子浓度一起从大到小排序
您最近一年使用:0次

 杂质)为原料制备无水
杂质)为原料制备无水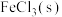 。
。 )熔点-101℃,沸点76℃,易水解。
)熔点-101℃,沸点76℃,易水解。
 的化学方程式为
的化学方程式为

