丙烯是重要的化工原料,利用丙烷制备丙烯通常有三种方法。
方法一:丙烷直接脱氢法
(1)丙烷直接脱氢的主要反应为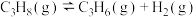
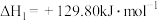 。
。 、
、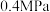 下向装有催化剂的恒压密闭容器中以
下向装有催化剂的恒压密闭容器中以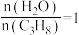 投料发生反应。平衡时,丙烷的转化率45%。用分压表示该反应的平衡常数
投料发生反应。平衡时,丙烷的转化率45%。用分压表示该反应的平衡常数
___________ ;增大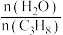 的值可提高丙烷的平衡转化率,解释其原因为
的值可提高丙烷的平衡转化率,解释其原因为___________ 。
方法二:丙烷氧化脱氢法
(2)丙烷氧化脱氢制丙烯时,主要发生反应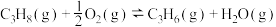
 。已知:氢气的燃烧热
。已知:氢气的燃烧热 为
为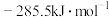 ;水的汽化热
;水的汽化热 为
为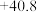
 ;结合
;结合 ,可计算
,可计算
___________ 。
方法三:丙烷与 耦合法
耦合法
(3)丙烷与 耦合法制丙烯时,主要发生如下反应:
耦合法制丙烯时,主要发生如下反应:
i.
ii.
iii.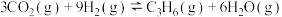
iv.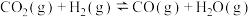
在 时,将
时,将 和
和 按体积比为1:1充入一恒压密闭容器中进行反应,实验测得体系中
按体积比为1:1充入一恒压密闭容器中进行反应,实验测得体系中 、
、 的转化率和
的转化率和 的选择性、
的选择性、 的平衡产率随催化剂组成和压强的变化分别如图3和图4所示。
的平衡产率随催化剂组成和压强的变化分别如图3和图4所示。
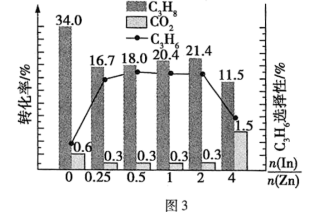
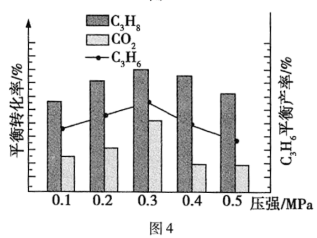
已知: 的选择性越高,副产物的含量越低。
的选择性越高,副产物的含量越低。
耦合法制丙烯适宜选择的生产条件为___________ ;随压强增大 的平衡产率先增大后减小的原因为
的平衡产率先增大后减小的原因为___________ 。
方法一:丙烷直接脱氢法
(1)丙烷直接脱氢的主要反应为
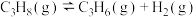
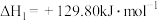 。
。 、
、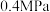 下向装有催化剂的恒压密闭容器中以
下向装有催化剂的恒压密闭容器中以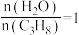 投料发生反应。平衡时,丙烷的转化率45%。用分压表示该反应的平衡常数
投料发生反应。平衡时,丙烷的转化率45%。用分压表示该反应的平衡常数
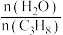 的值可提高丙烷的平衡转化率,解释其原因为
的值可提高丙烷的平衡转化率,解释其原因为方法二:丙烷氧化脱氢法
(2)丙烷氧化脱氢制丙烯时,主要发生反应
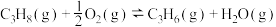
 。已知:氢气的燃烧热
。已知:氢气的燃烧热 为
为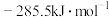 ;水的汽化热
;水的汽化热 为
为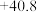
 ;结合
;结合 ,可计算
,可计算
方法三:丙烷与
 耦合法
耦合法(3)丙烷与
 耦合法制丙烯时,主要发生如下反应:
耦合法制丙烯时,主要发生如下反应:i.

ii.

iii.
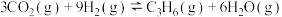
iv.
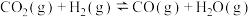
在
 时,将
时,将 和
和 按体积比为1:1充入一恒压密闭容器中进行反应,实验测得体系中
按体积比为1:1充入一恒压密闭容器中进行反应,实验测得体系中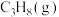 、
、 的转化率和
的转化率和 的选择性、
的选择性、 的平衡产率随催化剂组成和压强的变化分别如图3和图4所示。
的平衡产率随催化剂组成和压强的变化分别如图3和图4所示。

已知:
 的选择性越高,副产物的含量越低。
的选择性越高,副产物的含量越低。耦合法制丙烯适宜选择的生产条件为
 的平衡产率先增大后减小的原因为
的平衡产率先增大后减小的原因为
更新时间:2021-09-10 17:49:14
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用CO2发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
Ⅰ.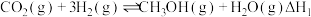
Ⅱ.
回答下列问题:
(1)已知: ,则
,则
___________ 。
(2)向密闭容器中加入 和
和 ,合成
,合成 。已知反应Ⅰ的正反应速率可表示为
。已知反应Ⅰ的正反应速率可表示为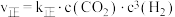 ,逆反应速率可表示为
,逆反应速率可表示为 ,其中
,其中 为速率常数。
为速率常数。

①上图中能够代表 的曲线为
的曲线为___________ (填“ ”“
”“ ”或“
”或“ ”“
”“ ”)。
”)。
②温度为 时,反应Ⅰ的化学平衡常数
时,反应Ⅰ的化学平衡常数
___________ 。
③对于上述反应体系,下列说法正确的是___________
A.增大CO2的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
B.恒容密闭容器中当气体密度不变时,反应达到平衡状态
C.加入催化剂,H2的平衡转化率不变
(3)不同条件下,按照 投料,
投料, 的平衡转化率如下图所示。
的平衡转化率如下图所示。
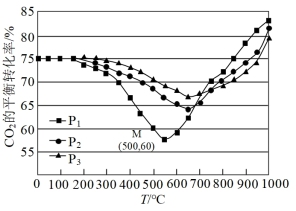
①压强 由大到小的顺序是
由大到小的顺序是___________ 。
②压强为 时,温度高于
时,温度高于 之后,随着温度升高
之后,随着温度升高 平衡转化率增大的原因
平衡转化率增大的原因___________ 。
Ⅰ.
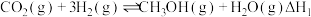
Ⅱ.

回答下列问题:
(1)已知:
 ,则
,则
(2)向密闭容器中加入
 和
和 ,合成
,合成 。已知反应Ⅰ的正反应速率可表示为
。已知反应Ⅰ的正反应速率可表示为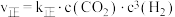 ,逆反应速率可表示为
,逆反应速率可表示为 ,其中
,其中 为速率常数。
为速率常数。
①上图中能够代表
 的曲线为
的曲线为 ”“
”“ ”或“
”或“ ”“
”“ ”)。
”)。②温度为
 时,反应Ⅰ的化学平衡常数
时,反应Ⅰ的化学平衡常数
③对于上述反应体系,下列说法正确的是
A.增大CO2的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
B.恒容密闭容器中当气体密度不变时,反应达到平衡状态
C.加入催化剂,H2的平衡转化率不变
(3)不同条件下,按照
 投料,
投料, 的平衡转化率如下图所示。
的平衡转化率如下图所示。
①压强
 由大到小的顺序是
由大到小的顺序是②压强为
 时,温度高于
时,温度高于 之后,随着温度升高
之后,随着温度升高 平衡转化率增大的原因
平衡转化率增大的原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】O2对人类有着重要的作用。请回答下列问题:
(1)甲醇是一种绿色可再生能源,已知热化学方程式:
ⅰ.2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ•mol-1
ⅱ.2H2(g)+O2(g)=2H2O(g) ΔH2=-483.0kJ•mol-1
ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=-574.0kJ•mol-1
则计算CH3OH(g)+ O2(g)=CO2(g)+2H2O(g)的ΔH=
O2(g)=CO2(g)+2H2O(g)的ΔH=___________ 。
(2)人体内化学反应时刻需要O2参与,如肌肉中的肌红蛋白(Mb),具有结合O2的能力,可表示为Mb(aq)+O2(g) MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1,已知K=
MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1,已知K=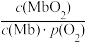 (气体和溶液中的溶质分别用分压和物质的量浓度表达)。
(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
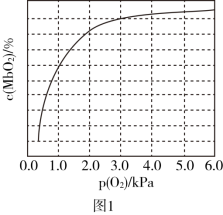
①37℃时,已知平衡常数K=2,测得人正常呼吸时α的最大值为98%,则空气中氧气分压p(O2)=___________ kPa。
②血红蛋白Hb结合O2形成动脉血,存在反应1:HbH+(aq)+O2(g) HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O
HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O H++HCO
H++HCO ,结合两个反应,肺部氧分压
,结合两个反应,肺部氧分压___________ (填“较高”或“较低”)有利于CO2排出体外。请你从平衡移动的角度解释原因___________ 。
(3)游泳池水质普遍存在尿素[CO(NH2)2]超标现象,一种电化学除游泳池中尿素的实验装置如图2所示,其中钌钛常用作析氯电极 ,本身不参与电解。已知:3NaClO+CO(NH2)2=3NaCl+2H2O+N2↑+CO2↑。
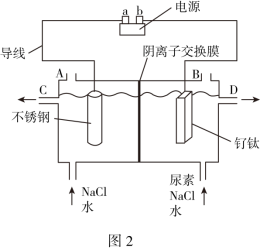
①电解过程中钌钛电极上发生反应为___________ 。
②电解过程中不锈钢电极附近pH___________ (填“降低”“升高”或“不变”)。
③标准状况下,电解过程中每逸出22.4L N2,电路中至少通过电子数目___________ 。
(1)甲醇是一种绿色可再生能源,已知热化学方程式:
ⅰ.2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ•mol-1
ⅱ.2H2(g)+O2(g)=2H2O(g) ΔH2=-483.0kJ•mol-1
ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=-574.0kJ•mol-1
则计算CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g)的ΔH=
O2(g)=CO2(g)+2H2O(g)的ΔH=(2)人体内化学反应时刻需要O2参与,如肌肉中的肌红蛋白(Mb),具有结合O2的能力,可表示为Mb(aq)+O2(g)
 MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1,已知K=
MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1,已知K=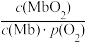 (气体和溶液中的溶质分别用分压和物质的量浓度表达)。
(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
①37℃时,已知平衡常数K=2,测得人正常呼吸时α的最大值为98%,则空气中氧气分压p(O2)=
②血红蛋白Hb结合O2形成动脉血,存在反应1:HbH+(aq)+O2(g)
 HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O
HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O H++HCO
H++HCO ,结合两个反应,肺部氧分压
,结合两个反应,肺部氧分压(3)游泳池水质普遍存在尿素[CO(NH2)2]超标现象,一种电化学除游泳池中尿素的实验装置如图2所示,其中钌钛常用作

①电解过程中钌钛电极上发生反应为
②电解过程中不锈钢电极附近pH
③标准状况下,电解过程中每逸出22.4L N2,电路中至少通过电子数目
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】(1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: _______ 。

(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
根据以上三个热化学方程式,计算C(s,石墨)+2H2(g)=CH4(g)的反应热ΔH为_______ 。
(3)如图,当线路接通时,发现M(滴有酚酞的K2SO4溶液浸润过得滤纸)a端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化。

回答下列问题:
①甲、乙分别是什么装置_______ 、 _______ 。
②写出C的电极名称和电极反应式_______ ; _______ 。

(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
根据以上三个热化学方程式,计算C(s,石墨)+2H2(g)=CH4(g)的反应热ΔH为
(3)如图,当线路接通时,发现M(滴有酚酞的K2SO4溶液浸润过得滤纸)a端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化。

回答下列问题:
①甲、乙分别是什么装置
②写出C的电极名称和电极反应式
您最近一年使用:0次
【推荐1】硫的化合物在化工生产、污水处理等领域应用广泛。
Ⅰ.羰基硫(O=C=S)广泛存在于以煤为原料制备的各种化工原料气中,能引起催化剂中毒、大气污染等。羰基硫的水解和氢解是两种常用的脱硫方法,其反应式分别为:
a.水解反应:COS(g)+H2O(g) H2S(g)+CO2(g) △H1=-35 kJ/mol
H2S(g)+CO2(g) △H1=-35 kJ/mol
b.氢解反应:COS(g)+H2(g)⇌H2S(g)+CO(g) △H2
已知:CO(g)+H2O(g)⇌H2(g)+CO2(g) △H3=-42kJ/mol
(1)完成上述氢解反应的热化学方程式:______ 。
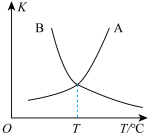
(2)一定条件下,密闭容器中发生反应 a,其中 COS(g)的平衡转化 率(α)与温度(T)的关系如图所示。则 A、B、C 三点对应的状态中,v(COS)=v(H2S)的是______ (填字母)。

(3)反应 b 的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应的平衡常数(K 正)的是______ (填“A”或“B”)。
(4)T1℃时,向容积为 10L 的恒容密闭容器中充入2mol COS(g)和2mol H2(g),发生反应 b,则:COS的平衡转化率为______ 。
Ⅱ.矿石冶炼与含硫化合物有关。
(5)将冰铜矿(主要为Cu2S和FeS相熔合而成)加熔剂(石英砂)在1200℃左右吹入空气 进行吹炼:Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程中发生反应的化学方程式分别是:___________ ;___________ 。
(6)废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性。
①吸收Cl2后的溶液中一定存在的阴离子有OH-、______ 。
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液。此实验不能证明溶液中含有SO32-,理由是___________ 。
Ⅰ.羰基硫(O=C=S)广泛存在于以煤为原料制备的各种化工原料气中,能引起催化剂中毒、大气污染等。羰基硫的水解和氢解是两种常用的脱硫方法,其反应式分别为:
a.水解反应:COS(g)+H2O(g)
 H2S(g)+CO2(g) △H1=-35 kJ/mol
H2S(g)+CO2(g) △H1=-35 kJ/molb.氢解反应:COS(g)+H2(g)⇌H2S(g)+CO(g) △H2
已知:CO(g)+H2O(g)⇌H2(g)+CO2(g) △H3=-42kJ/mol
(1)完成上述氢解反应的热化学方程式:
(2)一定条件下,密闭容器中发生反应 a,其中 COS(g)的平衡转化 率(α)与温度(T)的关系如图所示。则 A、B、C 三点对应的状态中,v(COS)=v(H2S)的是

(3)反应 b 的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应的平衡常数(K 正)的是

(4)T1℃时,向容积为 10L 的恒容密闭容器中充入2mol COS(g)和2mol H2(g),发生反应 b,则:COS的平衡转化率为
Ⅱ.矿石冶炼与含硫化合物有关。
(5)将冰铜矿(主要为Cu2S和FeS相熔合而成)加熔剂(石英砂)在1200℃左右吹入空气 进行吹炼:Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程中发生反应的化学方程式分别是:
(6)废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性。
①吸收Cl2后的溶液中一定存在的阴离子有OH-、
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液。此实验不能证明溶液中含有SO32-,理由是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氯胺是一种长效缓释水消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl,NHCl2和NCl3)。工业上可利用NH3(g)+Cl2(g)  NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
(1)氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质是___ ,二氯胺与水反应的化学方程式为___ 。
(2)已知部分化学键的键能和化学反应的能量变化如表和如图所示(忽略不同物质中同种化学键键能的细微差别)。

则ΔH2=___ kJ/mol,x=___ 。
(3)在密闭容器中反应NH3(g)+Cl2(g) NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随
NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随 (氨氯比)的变化曲线如图所示。
(氨氯比)的变化曲线如图所示。
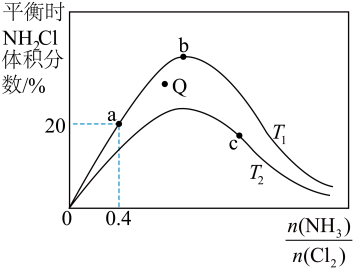
①a、b、c三点对应平衡常数的大小关系是___ 。T1温度下该反应的平衡常数为___ (列出算式即可)。
②在T2温度下,Q点对应的速率:v正___ v逆(填“大于”“小于”或“等于”)。
③在氨氯比一定时,提高NH3的转化率的方法是___ (任写1种)
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是___ 。
 NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:(1)氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质是
(2)已知部分化学键的键能和化学反应的能量变化如表和如图所示(忽略不同物质中同种化学键键能的细微差别)。

| 化学键 | N-H | N-Cl | H-Cl |
| 键能(kJ/mol) | 391.3 | x | 431.8 |
则ΔH2=
(3)在密闭容器中反应NH3(g)+Cl2(g)
 NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随
NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随 (氨氯比)的变化曲线如图所示。
(氨氯比)的变化曲线如图所示。
①a、b、c三点对应平衡常数的大小关系是
②在T2温度下,Q点对应的速率:v正
③在氨氯比一定时,提高NH3的转化率的方法是
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g) xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)2min内,B的转化率为___________ 。
(2)从开始反应至达到平衡状态,消耗A的平均反应速率为___________ , x=___________ 。
(3)下列各项不能作为该反应达到平衡状态的标志的是___________(填字母)。
 xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。(1)2min内,B的转化率为
(2)从开始反应至达到平衡状态,消耗A的平均反应速率为
(3)下列各项不能作为该反应达到平衡状态的标志的是___________(填字母)。
| A.气体密度不再变化 | B.压强不再变化 |
| C.A的消耗速率与B的消耗速率之比为2:1 | D.气体平均相对分子质量不再变化 |
您最近一年使用:0次



