水中的溶解氧是水生生物生存不可缺少的条件。某课外小组设计如图所示的实验装置(夹持装置略),采用碘量法测定学校周边河水中的溶解氧的含量。
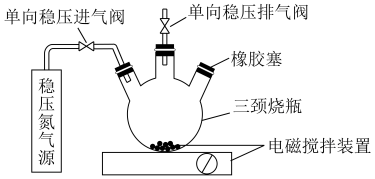
实验步骤及测定原理如下:
I.取样、氧的固定
a.用溶解氧瓶采集水样,记录大气压及水体温度。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mL 无氧溶液(过量)和2mL碱性KI无氧溶液(过量)开启搅拌器,反应生成
无氧溶液(过量)和2mL碱性KI无氧溶液(过量)开启搅拌器,反应生成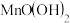 ,实现氧的固定。
,实现氧的固定。
II.酸化、滴定
d.搅拌,并向烧瓶中加入2mL硫酸无氧溶液至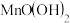 被
被 还原为
还原为 ,溶液为中性或弱酸性。
,溶液为中性或弱酸性。
e.在暗处静置5min后,取一定量溶液,用 标准溶液滴定生成的
标准溶液滴定生成的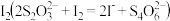 ,记录数据。
,记录数据。
f.重复e中滴定操作2~3次。
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为___________ 。
(2)取水样时应尽量避免扰动水体表面,这样操作的主要目的是___________ 。
(3)“氧的固定”中发生主要反应的化学方程式为___________ 。
(4)“步骤e”中,用a
 标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为
标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为______________ ;若200mL水样经处理后,共消耗 标准溶液的体积为b mL,则水样中溶解氧的含量为
标准溶液的体积为b mL,则水样中溶解氧的含量为___________ (用含字母的式子表示) 。
。

实验步骤及测定原理如下:
I.取样、氧的固定
a.用溶解氧瓶采集水样,记录大气压及水体温度。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mL
 无氧溶液(过量)和2mL碱性KI无氧溶液(过量)开启搅拌器,反应生成
无氧溶液(过量)和2mL碱性KI无氧溶液(过量)开启搅拌器,反应生成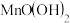 ,实现氧的固定。
,实现氧的固定。II.酸化、滴定
d.搅拌,并向烧瓶中加入2mL硫酸无氧溶液至
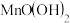 被
被 还原为
还原为 ,溶液为中性或弱酸性。
,溶液为中性或弱酸性。e.在暗处静置5min后,取一定量溶液,用
 标准溶液滴定生成的
标准溶液滴定生成的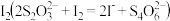 ,记录数据。
,记录数据。f.重复e中滴定操作2~3次。
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为
(2)取水样时应尽量避免扰动水体表面,这样操作的主要目的是
(3)“氧的固定”中发生主要反应的化学方程式为
(4)“步骤e”中,用a

 标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为
标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为 标准溶液的体积为b mL,则水样中溶解氧的含量为
标准溶液的体积为b mL,则水样中溶解氧的含量为 。
。
21-22高二上·江苏盐城·阶段练习 查看更多[3]
江苏省盐城市伍佑中学2021-2022学年高二上学期第一次阶段考试化学(必修)试题(已下线)必考点06 水的电离和溶液pH-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)周末培优2 水的电离和溶液的酸碱性-2021-2022学年高二化学课后培优练(人教版选修4)
更新时间:2021-10-16 07:43:58
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】工业用焦炭和硫酸钠反应制备硫化钠:Na2SO4 + 2C Na2S + CO2↑,完成下列填空:
Na2S + CO2↑,完成下列填空:
(1)硫元素在周期表中的位置为___________ ,硫原子核外有___________ 种不同运动状态的电子。
(2)CS2的结构与CO2相似,二者形成晶体时的熔点高低为:CS2___________ CO2(填“>、=、<”)。
(3)有关二硫化碳分子的描述正确的是______
(4)C元素和S元素比较,非金属性强的是___________ ,写出一个能支持你的结论的事实:___________ 。
(5)Na2S又称臭碱,Na2S溶液中含硫元素微粒的浓度由大到小的顺序是___________ 。
(6)天然气中常含有少量H2S,在酸性介质中进行天然气脱硫的原理示意图如图示,
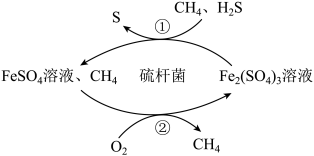
配平步骤①涉及到的方程式(先在括号里补齐生成物):_________
___________Fe2 (SO4)3 + ___________ H2S =___________ FeSO4 +___________ S↓ +___________
(7)图示中反应②是FeSO4在酸性条件下被O2氧化的过程,若有1摩尔FeSO4在酸性条件下被氧化,需要O2的体积(标准状况)为___________ 升。
 Na2S + CO2↑,完成下列填空:
Na2S + CO2↑,完成下列填空:(1)硫元素在周期表中的位置为
(2)CS2的结构与CO2相似,二者形成晶体时的熔点高低为:CS2
(3)有关二硫化碳分子的描述正确的是______
| A.含有非极性键 | B.是直线形分子 | C.属于极性分子 | D.结构式为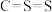 |
(5)Na2S又称臭碱,Na2S溶液中含硫元素微粒的浓度由大到小的顺序是
(6)天然气中常含有少量H2S,在酸性介质中进行天然气脱硫的原理示意图如图示,

配平步骤①涉及到的方程式(先在括号里补齐生成物):
___________Fe2 (SO4)3 + ___________ H2S =___________ FeSO4 +___________ S↓ +___________
(7)图示中反应②是FeSO4在酸性条件下被O2氧化的过程,若有1摩尔FeSO4在酸性条件下被氧化,需要O2的体积(标准状况)为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液。各物质间的转化如下图所示,回答下列各问题(部分生成物未列出):
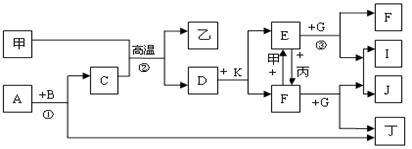
(1)写出乙的化学式_______ 、A的电子式_________ 、甲在周期表中位置是__________ ;
(2)写出G的一种用途____________________ ;
(3)写出B与K的浓溶液反应的化学方程式:_______________________________ ;
(4)整个转换过程中属于氧化还原反应的数目有__________ 个;
(5)写出反应③E与A按物质的量之比2:1的反应的离子方程式___ 。

(1)写出乙的化学式
(2)写出G的一种用途
(3)写出B与K的浓溶液反应的化学方程式:
(4)整个转换过程中属于氧化还原反应的数目有
(5)写出反应③E与A按物质的量之比2:1的反应的离子方程式
您最近一年使用:0次
【推荐3】工业生产中,常使用硫酸化焙烧法处理电解铜阳极泥(主要含Ag2Se、Cu2Se、Cu2Te、SiO2)以提取阳极泥中的铜、银、硒、碲等元素,主要流程如图所示:
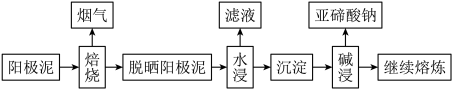
(1)电解精炼铜常用______ 作阴极。
(2)将阳极泥与浓硫酸混合,维持温度在443~573K,焙烧数小时,使其中的硒、碲变为二氧化物,铜、银等转化为硫酸盐。焙烧中Cu2Se发生反应的化学方程式为______ 。
(3)焙烧结束后,升温至773~873K使二氧化硒挥发。将烟气通入吸收塔后,二氧化硒在吸收塔中进一步转化为无定形的硒单质析出,该过程的还原剂为______ 。请写出SeO2转化为硒单质的化学方程式:为______ 。
(4)得到脱硒阳极泥后,用水浸出滤液,此时剩余沉淀的主要成分为TeO2、_____ 。
(5)滤出的沉淀用氢氧化钠溶液浸取,大部分的碲以亚碲酸钠(Na2TeO3)的形式转入浸取液中。将亚碲酸钠溶液在电解槽中以铂作电极进行电解即可得到碲单质。请写出该过程的电极反应方程式:阳极_____ ;阴极______ 。
(6)在磷酸和硫酸的混合溶液中,高锰酸钾可将碲(IV)氧化为碲(VI)。用此性质可以测定样品中碲(IV)的含量,过程如下:在亚碲酸钠样品中加入0.1000mol/L高锰酸钾30.00mL充分反应,反应后的溶液用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色恰好褪去;重复实验3次,平均消耗(NH4)2Fe(SO4)2标准溶液10.00mL,则样品中亚碲酸钠的含量为_____ g。(Na2TeO3的相对分子质量为222)

(1)电解精炼铜常用
(2)将阳极泥与浓硫酸混合,维持温度在443~573K,焙烧数小时,使其中的硒、碲变为二氧化物,铜、银等转化为硫酸盐。焙烧中Cu2Se发生反应的化学方程式为
(3)焙烧结束后,升温至773~873K使二氧化硒挥发。将烟气通入吸收塔后,二氧化硒在吸收塔中进一步转化为无定形的硒单质析出,该过程的还原剂为
(4)得到脱硒阳极泥后,用水浸出滤液,此时剩余沉淀的主要成分为TeO2、
(5)滤出的沉淀用氢氧化钠溶液浸取,大部分的碲以亚碲酸钠(Na2TeO3)的形式转入浸取液中。将亚碲酸钠溶液在电解槽中以铂作电极进行电解即可得到碲单质。请写出该过程的电极反应方程式:阳极
(6)在磷酸和硫酸的混合溶液中,高锰酸钾可将碲(IV)氧化为碲(VI)。用此性质可以测定样品中碲(IV)的含量,过程如下:在亚碲酸钠样品中加入0.1000mol/L高锰酸钾30.00mL充分反应,反应后的溶液用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色恰好褪去;重复实验3次,平均消耗(NH4)2Fe(SO4)2标准溶液10.00mL,则样品中亚碲酸钠的含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
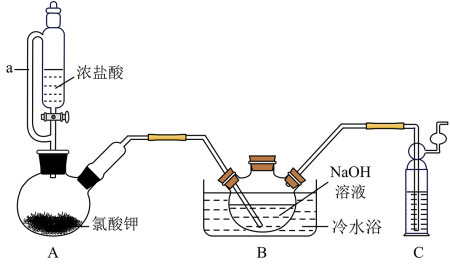
【推荐1】优氯净(二氯异氰尿酸钠)是一种适用范围广,高效的杀菌消毒剂。常温下为白色固体,难落于冷水。实验室常用高浓度的 溶液和
溶液和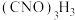 固体,在10℃时反应制备二氧异氰尿酸钠,实验装置如图所示(部分夹持装置略)。
固体,在10℃时反应制备二氧异氰尿酸钠,实验装置如图所示(部分夹持装置略)。
已知: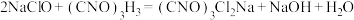
回答下列问题:
(1)装置A中发生的离子反应方程式为_______ 。
(2)待装置B中出现液面上方有黄绿色气体现象时,可由三颈烧瓶上口加入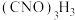 固体;反应过程中仍需不断通入
固体;反应过程中仍需不断通入 的理由是
的理由是_______ 。
(3)反应结束后,装置B中的浊液经_______ 、_______ 、干燥得粗产品。上述装置存在一处缺陷会导致装置B中NaOH利用率降低,改进的方法是_______ 。
(4)有效氯含量是判断产品质量的标准。实验检通过下列方法测定有效氯含量。原理为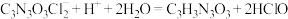 、
、 、
、 。准确称取1.1200g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用
。准确称取1.1200g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用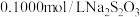 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。
①该样品的有效氯为_______ (有效氯=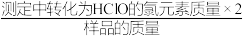 ×100%。(保留三位有效数字)
×100%。(保留三位有效数字)
②若在检测中加入稀硫酸的过少,将导致样品的有效氯测定值_______ (填“偏高”或“偏低”)。
 溶液和
溶液和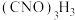 固体,在10℃时反应制备二氧异氰尿酸钠,实验装置如图所示(部分夹持装置略)。
固体,在10℃时反应制备二氧异氰尿酸钠,实验装置如图所示(部分夹持装置略)。
已知:
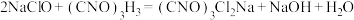
回答下列问题:
(1)装置A中发生的离子反应方程式为
(2)待装置B中出现液面上方有黄绿色气体现象时,可由三颈烧瓶上口加入
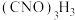 固体;反应过程中仍需不断通入
固体;反应过程中仍需不断通入 的理由是
的理由是(3)反应结束后,装置B中的浊液经
(4)有效氯含量是判断产品质量的标准。实验检通过下列方法测定有效氯含量。原理为
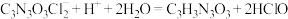 、
、 、
、 。准确称取1.1200g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用
。准确称取1.1200g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用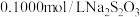 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。①该样品的有效氯为
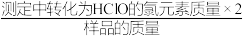 ×100%。(保留三位有效数字)
×100%。(保留三位有效数字)②若在检测中加入稀硫酸的过少,将导致样品的有效氯测定值
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】溶解氧(指溶解在水体中氧气分子)是衡量水质的一个重要指标。为测定某水样中溶解氧含量(ρ= )设计了如下实验方案。实验步骤如下:
)设计了如下实验方案。实验步骤如下:
步骤1:水样的采集与固定
用水样瓶准确量取100mL的待测水样(不能留有气泡),并用针筒向水样下方快速注入2.0mLMnSO4溶液和3.0mL碱性KI溶液,盖好瓶盖,上下颠倒摇匀,此时生成Mn2+在碱性条件下被水中的氧气氧化为MnOOH棕色沉淀,静置至澄清。
步骤2:碘的游离
向水样瓶中加入3.0mL浓硫酸,使I-在酸性条件下被MnOOH氧化为I2,同时MnOOH被还原Mn2+,待沉淀完全溶解后,将它们全部转移到250mL锥形瓶中。
步骤3:碘的滴定
向锥形瓶中加入少量淀粉溶液,再滴加0.005mol·L-1的Na2S2O3标准溶液,恰好完全反应时,消耗Na2S2O3标准溶液的体积为16mL。(已知:I2+2S2O32-=2I-+S4O62-)
(1)MnOOH中Mn元素的化合价是___ 。
(2)写出步骤2中所发生反应的离子方程式___ 。
(3)若待测水样中留有气泡,则测定结果将___ 。(填“偏大”、“偏小”或“无影响”)
(4)计算该水样中溶解氧的含量ρ(以mg·L-1表示),并写出计算过程:___ 。
 )设计了如下实验方案。实验步骤如下:
)设计了如下实验方案。实验步骤如下:步骤1:水样的采集与固定
用水样瓶准确量取100mL的待测水样(不能留有气泡),并用针筒向水样下方快速注入2.0mLMnSO4溶液和3.0mL碱性KI溶液,盖好瓶盖,上下颠倒摇匀,此时生成Mn2+在碱性条件下被水中的氧气氧化为MnOOH棕色沉淀,静置至澄清。
步骤2:碘的游离
向水样瓶中加入3.0mL浓硫酸,使I-在酸性条件下被MnOOH氧化为I2,同时MnOOH被还原Mn2+,待沉淀完全溶解后,将它们全部转移到250mL锥形瓶中。
步骤3:碘的滴定
向锥形瓶中加入少量淀粉溶液,再滴加0.005mol·L-1的Na2S2O3标准溶液,恰好完全反应时,消耗Na2S2O3标准溶液的体积为16mL。(已知:I2+2S2O32-=2I-+S4O62-)
(1)MnOOH中Mn元素的化合价是
(2)写出步骤2中所发生反应的离子方程式
(3)若待测水样中留有气泡,则测定结果将
(4)计算该水样中溶解氧的含量ρ(以mg·L-1表示),并写出计算过程:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】草酸( )是一种重要的化学试剂,常用来定量测定某些物质的浓度,因此其浓度的准确度非常重要。为测定某未知浓度的草酸溶液的浓度,设计了酸碱中和滴定和氧化还原滴定两种测定方法。
)是一种重要的化学试剂,常用来定量测定某些物质的浓度,因此其浓度的准确度非常重要。为测定某未知浓度的草酸溶液的浓度,设计了酸碱中和滴定和氧化还原滴定两种测定方法。
I.酸碱中和滴定法
已知: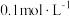 草酸氢钠溶液pH=2.7,该溶液具有一定缓冲性,滴入少量强酸或强碱溶液时溶液pH变化较小;草酸的电离常数
草酸氢钠溶液pH=2.7,该溶液具有一定缓冲性,滴入少量强酸或强碱溶液时溶液pH变化较小;草酸的电离常数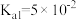 ,
,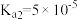 。
。
操作步骤:量取待测草酸溶液10.00 mL于锥形瓶中,滴加2滴指示剂;将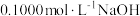 溶液盛装于滴定管中,到达滴定终点时停止滴定,并记录NaOH溶液的最终读数,再重复滴定3次,记录数据如下:
溶液盛装于滴定管中,到达滴定终点时停止滴定,并记录NaOH溶液的最终读数,再重复滴定3次,记录数据如下:
(1)该滴定过程中应选用的指示剂为______ (填“酚酞”或“甲基橙”)。
(2)将NaOH溶液盛装于滴定管后,需要排尽滴定管尖嘴部分的气泡,并将液面调至______ 。
(3)由上述滴定结果可计算得
______  。
。
(4)若出现下列情况,测定结果偏高的是______(填选项字母)。
II.氧化还原滴定法
用已知浓度的 溶液滴定该草酸溶液,最终生成能使澄清石灰水变浑浊的无色气体和
溶液滴定该草酸溶液,最终生成能使澄清石灰水变浑浊的无色气体和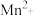 。
。
(5)滴定过程中涉及反应的离子方程式为______ 。
(6)滴定时盛装 溶液的滴定管为
溶液的滴定管为______ (填“酸式滴定管”或“碱式滴定管”),滴定过程中,刚开始滴定时溶液的颜色变化较慢,一段时间后溶液的颜色变化速度明显加快,猜测原因为______ (指明具体微粒的具体作用),滴定至终点的现象为______ 。
 )是一种重要的化学试剂,常用来定量测定某些物质的浓度,因此其浓度的准确度非常重要。为测定某未知浓度的草酸溶液的浓度,设计了酸碱中和滴定和氧化还原滴定两种测定方法。
)是一种重要的化学试剂,常用来定量测定某些物质的浓度,因此其浓度的准确度非常重要。为测定某未知浓度的草酸溶液的浓度,设计了酸碱中和滴定和氧化还原滴定两种测定方法。I.酸碱中和滴定法
已知:
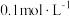 草酸氢钠溶液pH=2.7,该溶液具有一定缓冲性,滴入少量强酸或强碱溶液时溶液pH变化较小;草酸的电离常数
草酸氢钠溶液pH=2.7,该溶液具有一定缓冲性,滴入少量强酸或强碱溶液时溶液pH变化较小;草酸的电离常数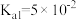 ,
,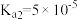 。
。操作步骤:量取待测草酸溶液10.00 mL于锥形瓶中,滴加2滴指示剂;将
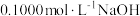 溶液盛装于滴定管中,到达滴定终点时停止滴定,并记录NaOH溶液的最终读数,再重复滴定3次,记录数据如下:
溶液盛装于滴定管中,到达滴定终点时停止滴定,并记录NaOH溶液的最终读数,再重复滴定3次,记录数据如下:滴定次数 实验数据/mL | 1 | 2 | 3 | 4 |
V(草酸) | 10.00 | 10.00 | 10.00 | 10.00 |
| 15.95 | 15.00 | 15.02 | 14.98 |
(2)将NaOH溶液盛装于滴定管后,需要排尽滴定管尖嘴部分的气泡,并将液面调至
(3)由上述滴定结果可计算得

 。
。(4)若出现下列情况,测定结果偏高的是______(填选项字母)。
| A.滴定前用蒸馏水冲洗锥形瓶 |
| B.在振荡锥形瓶时不慎将瓶内溶液溅出 |
| C.滴定至终点时,俯视读数 |
| D.用蒸馏水清洗滴定管后,未用NaOH标准液润洗 |
II.氧化还原滴定法
用已知浓度的
 溶液滴定该草酸溶液,最终生成能使澄清石灰水变浑浊的无色气体和
溶液滴定该草酸溶液,最终生成能使澄清石灰水变浑浊的无色气体和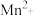 。
。(5)滴定过程中涉及反应的离子方程式为
(6)滴定时盛装
 溶液的滴定管为
溶液的滴定管为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
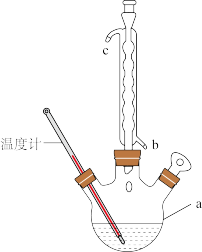
【推荐1】阿司匹林(又称乙酰水杨酸,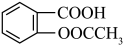 是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128—135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128—135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
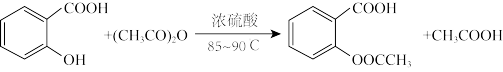
制备基本操作流程、装置示意图和有关数据如下(夹持和加热仪器已略去):
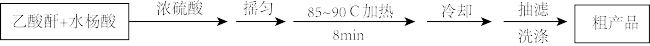
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥仪器的原因是____ 。
(2)合成阿司匹林时,最合适的加热方法是____ ,其原因是________ 。抽滤所得粗产品要用少量冰水洗涤,其目的是________ 。
(3)上述所得粗产品中还有一些副产品,其中有一种是高分子化合物。提纯粗产品
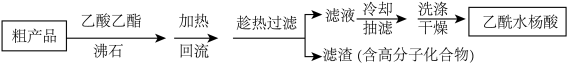
①这种提纯方法叫做____ 。
②该方案中选用乙酸乙酯作溶剂的原因是____________________ 。
(4)该学习小组在实验中原料用量:2.0 g水杨酸、5.0 mL乙酸酐(ρ=1.08g/cm-3),最终称得产品质量m=2.2 g,则所得乙酰水杨酸的产率为____ (结果保留3位有效数字)。
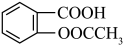 是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128—135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128—135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为: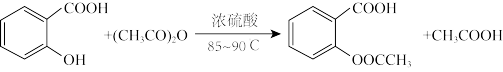
制备基本操作流程、装置示意图和有关数据如下(夹持和加热仪器已略去):

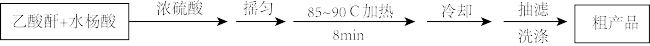
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 | 乙酸乙酯 |
| 水杨酸 | 138 | 158(熔点) | 微溶 | 易溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 | 可溶 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 | 可溶 |
(1)制备阿司匹林时,要使用干燥仪器的原因是
(2)合成阿司匹林时,最合适的加热方法是
(3)上述所得粗产品中还有一些副产品,其中有一种是高分子化合物。提纯粗产品

①这种提纯方法叫做
②该方案中选用乙酸乙酯作溶剂的原因是
(4)该学习小组在实验中原料用量:2.0 g水杨酸、5.0 mL乙酸酐(ρ=1.08g/cm-3),最终称得产品质量m=2.2 g,则所得乙酰水杨酸的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某小组拟用含稀硫酸的KMnO4溶液与H2C2O4 (弱酸)溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,设计了下表的实验方案并记录了实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20mol/LH2C2O4溶液、0.010mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。
【实验内容及记录】
(1)表格中“乙”需要测的物理量为_______ 。
(2)实验①②探究的是_______ 对化学反应速率的影响。
(3)若②③探究浓度对反应速率的影响,表格中a=_______ ,③中加入amL蒸馏水的目的是_______ 。
(4)实验②④探究的是_______ 对化学反应速率的影响。
(5)实验室有一瓶混有泥沙的草酸样品,利用下列反应的原理来测定其含量。
①配平化学方程式:_______ 。
 ②具体操作为:
②具体操作为:
a.配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
b.滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol/L KMnO4标准溶液装入_______ (填“酸式”或“碱式”)滴定管,进行滴定操作。判断滴定达到终点的现象是_______ 。
c.计算:重复上述操作2次,记录实验数据如下表。此样品的纯度为_______ 。
③误差分析:下列操作会导致测定结果偏高的是_______ 。
A.未用KMnO4标准溶液润洗滴定管 B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 D.观察读数时,滴定前仰视,滴定后俯视
【实验内容及记录】
| 物理量编号 | V(0.20mol/LH2C2O4溶液) | V(蒸馏水)/ | V(0.010mol/L KMnO4溶液)/mL | m( MnSO4固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 0 | 25 | |
| ③ | 1.0 | a | 4.0 | 0 | 25 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
(2)实验①②探究的是
(3)若②③探究浓度对反应速率的影响,表格中a=
(4)实验②④探究的是
(5)实验室有一瓶混有泥沙的草酸样品,利用下列反应的原理来测定其含量。
①配平化学方程式:
 ②具体操作为:
②具体操作为:a.配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
b.滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol/L KMnO4标准溶液装入
c.计算:重复上述操作2次,记录实验数据如下表。此样品的纯度为
| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.00 | 20.01 |
| 2 | 1.00 | 20.99 |
| 3 | 0.00 | 21.10 |
A.未用KMnO4标准溶液润洗滴定管 B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 D.观察读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】SO2、NO2能形成酸雨,某同学以它们为主题设计了两组实验:
【实验一】用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中.分别缓慢通入适量O2或Cl2,如图A、B、C所示。一段时间后,A、B装置的集气瓶中充满溶液(假设瓶内液体不扩散),C装置的集气瓶中还有气体剩余(考滤液体的扩散) 。
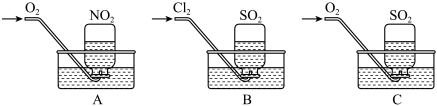
(1)写出装置A中总反应的化学方程式_____________________________ ,假设该实验条件下,气体摩尔体积为a L/mol,则装置A的集气瓶中所得溶液溶质的物质的量浓度为______________ 。
(2)写出B装置的溶液充满集气瓶时,有关反应的离子方程式_______________ 。
(3)实验前在C装置的水槽里滴加几滴紫色石蕊试液,通入氧气后,可观察到的实验现象是水槽中溶液___________________________ (答颜色的变化),写出反应的总化学方程式____________________________________ 。
【实验二】利用上图B的原理,设计下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计用于准确测量通过的尾气体积。将尾气通入一定体积的碘水,并通过实验测定SO2的含量。当洗气瓶D中溶液蓝色刚好消失时,立即关闭活塞K。
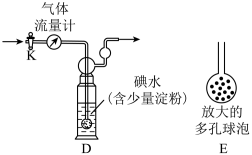
(4)D中导管末端连接一个多孔球泡E,其作用是_______________________ ,可以提高实验的准确度。
(5)当流量计中刚好通过2L尾气时,D中溶液蓝色刚好消失,立即关闭活塞K,容器D中恰好得到100mL溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g 白色沉淀,通过计算可知,上述尾气中二氧化硫的含量为________ g/L。若洗气瓶D中溶液蓝色消失后,没有及时关闭活塞K,测得的SO2含量_________ (填“偏高”、“偏低”或“无影响”)。
【实验一】用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中.分别缓慢通入适量O2或Cl2,如图A、B、C所示。一段时间后,A、B装置的集气瓶中充满溶液(假设瓶内液体不扩散),C装置的集气瓶中还有气体剩余(考滤液体的扩散) 。

(1)写出装置A中总反应的化学方程式
(2)写出B装置的溶液充满集气瓶时,有关反应的离子方程式
(3)实验前在C装置的水槽里滴加几滴紫色石蕊试液,通入氧气后,可观察到的实验现象是水槽中溶液
【实验二】利用上图B的原理,设计下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计用于准确测量通过的尾气体积。将尾气通入一定体积的碘水,并通过实验测定SO2的含量。当洗气瓶D中溶液蓝色刚好消失时,立即关闭活塞K。

(4)D中导管末端连接一个多孔球泡E,其作用是
(5)当流量计中刚好通过2L尾气时,D中溶液蓝色刚好消失,立即关闭活塞K,容器D中恰好得到100mL溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g 白色沉淀,通过计算可知,上述尾气中二氧化硫的含量为
您最近一年使用:0次

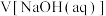 (消耗)
(消耗)

