A、B、C、D、E、F为原子序数依次增大的短周期主族元素。B、F原子的最外层电子数均为其电子层数的两倍,D、F元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质由上述元素的两种或三种元素组成,元素B形成的单质M均能与甲、乙的浓溶液反应(相对分子质量甲<乙),转化关系如图(反应条件略去),元素E形成的单质是“21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:
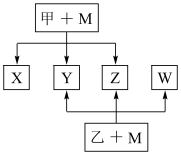
(1)下列事实不能证明元素F的非金属性弱于元素D的是___________ (填标号)。
a.D和F的最简单氢化物的稳定性:F<D
b.常温下F的单质呈固态,D的单质呈气态;
c.D与F形成的化合物中,F显正价
d.D和F的单质氧化性:F<D
(2)写出M与甲的浓溶液加热时反应的化学方程式___________ ;
(3)X、Y、Z、W属于同一类物质,X、Y、W都能与Z反应,4种化合物中沸点最高的是_____ (填化学式);
(4)化合物ED2与M在高温下能发生置换反应,若反应中有1mol电子发生转移,则参加反应的化合物ED2的质量为___________ g;
(5)元素C能分别与元素A和D均按原子个数比1:2形成化合物丙和丁,丙的结构式为______ ;常温下,液体丙与气体丁反应生成两种无污染的物质,该反应的氧化产物与还原产物的物质的量之比为_________ 。

(1)下列事实不能证明元素F的非金属性弱于元素D的是
a.D和F的最简单氢化物的稳定性:F<D
b.常温下F的单质呈固态,D的单质呈气态;
c.D与F形成的化合物中,F显正价
d.D和F的单质氧化性:F<D
(2)写出M与甲的浓溶液加热时反应的化学方程式
(3)X、Y、Z、W属于同一类物质,X、Y、W都能与Z反应,4种化合物中沸点最高的是
(4)化合物ED2与M在高温下能发生置换反应,若反应中有1mol电子发生转移,则参加反应的化合物ED2的质量为
(5)元素C能分别与元素A和D均按原子个数比1:2形成化合物丙和丁,丙的结构式为
更新时间:2021-12-17 18:14:34
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】现用二氧化锰与浓盐酸反应制备纯净干燥的氯气,再用氯气与铜粉反应制取少量CuCl2,其装置如下:
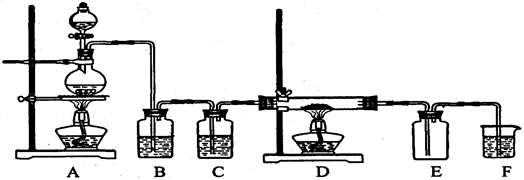
(1)写出装置A中发生反应的离子方程式_________________________ 。
(2)B中选用的试剂是饱和食盐水,其作用是除去Cl2中混有的__________ 杂质;装置E的作用是___________________ 。
(3)即使A装置中的MnO2和D装置中的Cu都是足量的,100mL 12mol/L浓盐酸经充分反应后得到的CuCl2也不足0.3mol,其原因是______________
A.装置漏气 B.A装置在加热过程中盐酸易挥发
C.CuCl2潮解吸水 D.A装置中反应生成的水要稀释盐酸,剩余的盐酸不再反应
(4)某实验小组的同学用经Cl2消毒的自来水配制下列溶液:①KI;②AgNO3;③AlCl3;④FeCl2;⑤稀盐酸,发现部分药品变质,它们是(请用序号作答)____________________ 。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_____________________________________ 。
(6)一定条件下,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应。生成物中含有三种含氯元素的离子,其中ClO-、ClO 两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
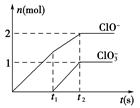
该过程中参加反应Cl2的物质的量是________ mol。若产生的n(C1-)为11mol,n(C1O3-)为2 mol,则参加反应的Ca(OH)2的物质的量为________ mol。

(1)写出装置A中发生反应的离子方程式
(2)B中选用的试剂是饱和食盐水,其作用是除去Cl2中混有的
(3)即使A装置中的MnO2和D装置中的Cu都是足量的,100mL 12mol/L浓盐酸经充分反应后得到的CuCl2也不足0.3mol,其原因是
A.装置漏气 B.A装置在加热过程中盐酸易挥发
C.CuCl2潮解吸水 D.A装置中反应生成的水要稀释盐酸,剩余的盐酸不再反应
(4)某实验小组的同学用经Cl2消毒的自来水配制下列溶液:①KI;②AgNO3;③AlCl3;④FeCl2;⑤稀盐酸,发现部分药品变质,它们是(请用序号作答)
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)
(6)一定条件下,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应。生成物中含有三种含氯元素的离子,其中ClO-、ClO
 两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
该过程中参加反应Cl2的物质的量是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】已知氯气与碱反应时,产物受温度影响。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,并探究其氧化还原性质。
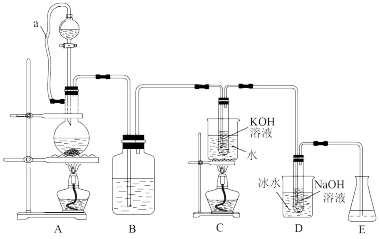
回答下列问题:
(1)A装置中a的作用是_______ 。
(2)装置A产生7.1gCl2时,被氧化的HCl的质量是_______ 。
(3)装置B中的试剂为_______ 。
(4)装置E选用试剂_______ (填标号)。
A.NaCl溶液 B.NaOH溶液 C.稀硫酸
(5)装置C中反应的离子方程式为_______ 。
(6)该兴趣小组在40℃条件下,将一定量的Cl2通入一定量的NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和NaClO3,已知Cl-和ClO-的个数比为11:1,则此过程中氧化剂和还原剂的个数比为_______ 。

回答下列问题:
(1)A装置中a的作用是
(2)装置A产生7.1gCl2时,被氧化的HCl的质量是
(3)装置B中的试剂为
(4)装置E选用试剂
A.NaCl溶液 B.NaOH溶液 C.稀硫酸
(5)装置C中反应的离子方程式为
(6)该兴趣小组在40℃条件下,将一定量的Cl2通入一定量的NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和NaClO3,已知Cl-和ClO-的个数比为11:1,则此过程中氧化剂和还原剂的个数比为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)某透明溶液中仅含Na+、Fe2+、Ba2+、Al3+、 、Cl-、
、Cl-、 的4种离子,所含离子均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
的4种离子,所含离子均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
①溶液中存在的离子是___________ ;
②写出溶液中加入过量的稀硫酸反应的离子方程式___________ ;
③向原溶液中滴加足量NaOH溶液后,过滤洗涤灼烧,最终固体质量为___________ g。
(2)磷的一种化合物叫亚磷酸(H3PO3)。已知:
I .0.1 mol/L H3PO3溶液的pH = 1.7;
II. H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;
III. H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
关于H3PO3的说法:①强酸;②弱酸;③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是___________ 。
A.②④⑥ B.②③⑥ C.①④⑤ D.②③⑤
写出H3PO3与过量NaOH溶液反应的离子方程式___________ 。
(3)H3PO2(次磷酸)是一元中强酸,H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①NaH2PO2属于___________ (填“正盐”“酸式盐”或“碱式盐”)。
②利用H3PO2进行化学镀银的反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为___________ (写化学式)。
(1)某透明溶液中仅含Na+、Fe2+、Ba2+、Al3+、
 、Cl-、
、Cl-、 的4种离子,所含离子均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
的4种离子,所含离子均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:①溶液中存在的离子是
②写出溶液中加入过量的稀硫酸反应的离子方程式
③向原溶液中滴加足量NaOH溶液后,过滤洗涤灼烧,最终固体质量为
(2)磷的一种化合物叫亚磷酸(H3PO3)。已知:
I .0.1 mol/L H3PO3溶液的pH = 1.7;
II. H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;
III. H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
关于H3PO3的说法:①强酸;②弱酸;③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是
A.②④⑥ B.②③⑥ C.①④⑤ D.②③⑤
写出H3PO3与过量NaOH溶液反应的离子方程式
(3)H3PO2(次磷酸)是一元中强酸,H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①NaH2PO2属于
②利用H3PO2进行化学镀银的反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】下表是周期表的一部分,根据①至⑩元素在周期表中的位置,回答下列问题。
(1)⑤在周期表中的位置为_______ ;①⑥两元素组成的简单化合物的分子空间结构为_______ 形。
(2)②最高价氧化物对应水化物的电子式为_______ 。
(3)③④⑥三种元素的原子半径由大到小的顺序为_______ (用元素符号表示)。
(4)用一个化学方程式证明⑥⑦的非金属性强弱_______ 。
(5)⑦⑧⑨最高价氧化物对应水化物的酸性由强到弱的顺序为_______ 。(用化学式表示)
(6)⑩的原子结构示意图为_______ 。
| ① | |||||||||||||||||
| ⑥ | |||||||||||||||||
| ② | ③ | ⑦ | ⑧ | ⑨ | |||||||||||||
| ④ | ⑤ | ⑩ | |||||||||||||||
(2)②最高价氧化物对应水化物的电子式为
(3)③④⑥三种元素的原子半径由大到小的顺序为
(4)用一个化学方程式证明⑥⑦的非金属性强弱
(5)⑦⑧⑨最高价氧化物对应水化物的酸性由强到弱的顺序为
(6)⑩的原子结构示意图为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】常见的短周期元素A、B、C、D、E的原子序数依次增大。常温下,A、C可形成A2C2和A2C两种液态化合物,B原子最外层电子数是次外层电子数的2倍,D原子电子层数与最外层电子数相等,E与C同主族。
(1)写出上述五种元素的元素符号;B._______ D._______ E._______ 。
(2)上述五种元素中,非金属性最强的是_______ (填写元素名称),最高价氧化物对应水化物酸性最强的是_______ (写化学式)。
(3)D的单质与第三周期A的同主族元素最高价氧化物对应水化物反应的离子方程式为_______ 。
(4)B的单质与E的最高价氧化物对应水化物浓溶液反应的化学方程式为_______ 。
(5)由A2和C2形成的燃料电池中,用KOH做电解质溶液则负极发生的电极反应式为_______ ,正极发生了_______ (填氧化或还原)反应。
(1)写出上述五种元素的元素符号;B.
(2)上述五种元素中,非金属性最强的是
(3)D的单质与第三周期A的同主族元素最高价氧化物对应水化物反应的离子方程式为
(4)B的单质与E的最高价氧化物对应水化物浓溶液反应的化学方程式为
(5)由A2和C2形成的燃料电池中,用KOH做电解质溶液则负极发生的电极反应式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】X、Y、Z、R、Q是五种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,X、Y、R最外层电子数之和为8,Q的单质为黄绿色有害气体。请回答下列问题:
(1)Z在元素周期表中的位置为________ 。
(2)Y和Z元素的原子半径由大到小的顺序为_____ (写元素符号)。Y和Z的气态氢化物中稳定性较强的是_______ (填化学式)。
(3) Y单质的电子式为________ ,用电子式表示RQ2的形成过程__________
(4)X、Z两元素形成的原子个数比为1∶1的化合物中含有的化学键类型为________ 。
(5)Y的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式_______ 。
(1)Z在元素周期表中的位置为
(2)Y和Z元素的原子半径由大到小的顺序为
(3) Y单质的电子式为
(4)X、Z两元素形成的原子个数比为1∶1的化合物中含有的化学键类型为
(5)Y的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在点燃条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素A的名称_______ B的元素符号_______ D2-的离子结构示意图_______ 。
(2)分别写出AB2的结构式是_______ ,C2B2的电子式为_______ 。
(3)用电子式表示化合物C2D的形成过程_______ 。
(1)元素A的名称
(2)分别写出AB2的结构式是
(3)用电子式表示化合物C2D的形成过程
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y);D形成的分子为双原子分子。回答问题:
(1)D元素的名称为_________ ,F形成的离子的结构示意图为__________ 。
(2)元素E、F形成的化合物的电子式为_______ 。
(3)元素C、F氢化物的沸点C______ F(填“>”或“<”)。
(4)写出液态化合物Y的一种用途_________ 。
(5)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式______ 。
(6)A、B、G三种元素两两组合形成的化合物在空气中相遇形成白烟,反应的化学方程式为_____ 。
(1)D元素的名称为
(2)元素E、F形成的化合物的电子式为
(3)元素C、F氢化物的沸点C
(4)写出液态化合物Y的一种用途
(5)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式
(6)A、B、G三种元素两两组合形成的化合物在空气中相遇形成白烟,反应的化学方程式为
您最近一年使用:0次
【推荐3】X、Y、Z、W、M、R是六种原子序数依次增大的前四周期元素。基态X原子的核外电子只有一种自旋取向,基态Y原子是第二周期未成对电子数最多的原子,Z元素的焰色为黄色,基态W原子的价层电子排布式为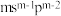 ,M与Y同族,R为原子序数为28的元素。请回答下列问题:
,M与Y同族,R为原子序数为28的元素。请回答下列问题:
(1)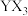
______ (填“是”或“不是”)极性分子,中心原子的杂化轨道类型为______ ;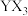 中的键角
中的键角______ (填“>”、“<”或“=”) 中的键角。
中的键角。
(2)元素Z、W的最高价氧化物对应的水化物会发生反应,发生反应的离子方程式为___________ 。
(3)M位于元素周期表中的______ (填“s”、“p”、“d”或“ds”)区,比较Y与M的简单氢化物的沸点:______ (写分子式),原因为_____________ 。
(4)基态R原子的价层电子轨道表示式为______ ,第三周期中与基态R原子有相同的未成对电子数的原子有______ 种。
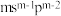 ,M与Y同族,R为原子序数为28的元素。请回答下列问题:
,M与Y同族,R为原子序数为28的元素。请回答下列问题:(1)
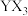
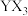 中的键角
中的键角 中的键角。
中的键角。(2)元素Z、W的最高价氧化物对应的水化物会发生反应,发生反应的离子方程式为
(3)M位于元素周期表中的
(4)基态R原子的价层电子轨道表示式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】U、V、W、X、Y和Z为原子序数依次增大的六种短周期元素。U为非金属元素,且U与X同主族;V与X两元素的最高正化合价之和为6;W与Y同主族;X的周期数是族序数的3倍;Y的最外层电子数是最内层电子数的3倍。
请推测出U、V、W、X、Y和Z六种元素,并用相应的化学用语或者.化学符号回答下列问题:
(1)V的原子结构示意图为___ ,W、X、Y三种元素的原子半径由大到小的顺序为___ 。
(2)物质VU4Z的电子式为___ ,存在的化学键有___ 。
(3)U与W能形成的18e-分子的结构式为___ ,W的化合价为___ 。
(4)W和U两元素形成的阴离子与V和U两元素形成的阳离子含有相同的电子数,且在水溶液中、加热条件下能够发生反应生成含相同电子数的两种分子,该反应的离子方程式为___ 。
(5)加热搅拌条件下,XZW3能将强酸性溶液中的Fe2+氧化成Fe3+,当消耗1molXZW3时,转移6mole-,其离子方程式是___ 。
请推测出U、V、W、X、Y和Z六种元素,并用相应的化学用语或者.化学符号回答下列问题:
(1)V的原子结构示意图为
(2)物质VU4Z的电子式为
(3)U与W能形成的18e-分子的结构式为
(4)W和U两元素形成的阴离子与V和U两元素形成的阳离子含有相同的电子数,且在水溶液中、加热条件下能够发生反应生成含相同电子数的两种分子,该反应的离子方程式为
(5)加热搅拌条件下,XZW3能将强酸性溶液中的Fe2+氧化成Fe3+,当消耗1molXZW3时,转移6mole-,其离子方程式是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】现有部分短周期元素的性质或原子结构如下:
(1)X的无中子原子的符号为____________ ,Y的原子结构示意图为_____________ ,Q在元素周期表中的位置为___________________ 。
(2)Y、Z的最高价氧化物对应的水化物的碱性由强到弱的顺序是_______________________ (用化学式表示),写出两者反应的离子方程式:__________________________________________ 。
(3)M、W两种元素中非金属性较强的是______________ (用元素符号表示),下列表述中能证明这一事实的____________________ (填序号),
a. 常温下,M的单质与W的单质的状态不同
b. 向W的氢化物中通入M2,有淡黄色固体析出
c. M、W形成的化合物中W元素为正价
| 元素 | 元素的性质或原子结构 |
| X | 该元素的一种原子无中子 |
| Y | 原子半径最大的短周期元素 |
| Z | 第三周期元素中简单离子半径最小 |
| M | 地壳中含量最多的元素 |
| Q | 其氧化物是光导纤维的基本原料 |
| W | 其核电荷数为M元素核电荷数的2倍 |
(2)Y、Z的最高价氧化物对应的水化物的碱性由强到弱的顺序是
(3)M、W两种元素中非金属性较强的是
a. 常温下,M的单质与W的单质的状态不同
b. 向W的氢化物中通入M2,有淡黄色固体析出
c. M、W形成的化合物中W元素为正价
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
(1)B在周期表中的位置______________ 。
(2)CB2通入A2B2溶液中可被氧化为W,方程式为____________ 。用W的溶液(体积为1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示)

电池总反应可表示为:PbO2 +Pb+ 2W=2PbSO4 + 2H2O 。若电池中转移0.1 mol电子时,则W的浓度由质量分数39 % (密度1.3 g·cm-3)变为____________ mol·L-1。
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为_________________________ 。

(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为________________ 。比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是_____________________ 。
(1)B在周期表中的位置
(2)CB2通入A2B2溶液中可被氧化为W,方程式为

电池总反应可表示为:PbO2 +Pb+ 2W=2PbSO4 + 2H2O 。若电池中转移0.1 mol电子时,则W的浓度由质量分数39 % (密度1.3 g·cm-3)变为
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为

(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为
您最近一年使用:0次



