某小组同学为验证与探究影响化学反应速率的因素,分别设计如下实验方案。
(1)甲同学依据反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,在A、B、C三支试管中按下表物质的量进行实验,记录下的时间数据是:16 s、28 s、33 s。
①将对应a、b、c的时间分别写出:a___________ 、b___________ 、c___________ 。
②实验结论是:___________ 。
(2)乙同学拟验证固体反应物的颗粒大小对反应速率的影响。
实验步骤:在试管①中加入1 g粉末状大理石,加入2 mol/L盐酸20 mL;在试管②中加入2g颗粒状大理石,加入2 mol/L盐酸40 mL。他根据实验过程,绘制出的生成CO2体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为下列___________是符合的。
(3)丙同学拟验证还原性:I->Br-,实验操作、现象与结论如下表:
丙同学设计的实验方案___________ (填“合理”或“不合理”),理由是___________ 。
(1)甲同学依据反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,在A、B、C三支试管中按下表物质的量进行实验,记录下的时间数据是:16 s、28 s、33 s。
| 试管编号 | 加3%Na2S2O3 | 加H2O | 加H2SO4(1∶5) | 出现浑浊时间 |
| A | 3 mL | 3 mL | 5滴 | a |
| B | 4 mL | 2 mL | 5滴 | b |
| C | 5 mL | 1 mL | 5滴 | c |
②实验结论是:
(2)乙同学拟验证固体反应物的颗粒大小对反应速率的影响。
实验步骤:在试管①中加入1 g粉末状大理石,加入2 mol/L盐酸20 mL;在试管②中加入2g颗粒状大理石,加入2 mol/L盐酸40 mL。他根据实验过程,绘制出的生成CO2体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为下列___________是符合的。
A.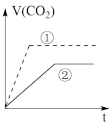 | B.C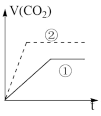 |
C.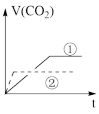 | D.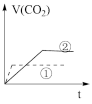 |
| 实验操作 | 实验现象 | 实验结论 |
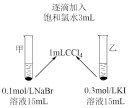 | 逐滴加入氯水的同时振荡,观察CCl4层的颜色变化,乙中CCl4层颜色明显变化快。 | 结论:验证成立,还原性I- >Br-。 |
更新时间:2021-12-14 06:42:55
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】研究氮氧化物的转化机理对环境保护具有重要意义。请回答下列问题:
(1)N2O是硝酸工业中氨催化氧化的副产物,CO处理N2O的原理为CO+N2O=N2+CO2。
①硝酸工业中氨被氧化成一氧化氮,生成的一氧化氮被反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸。写出一氧化氮到硝酸的总化学方程式:____________ 。
②在Fe+作用下,反应CO+N2O=N2+CO2分两步进行,已知第ⅰ步反应为
N2O+Fe+=N2+FeO+,试写出第ⅱ步反应的方程式:____________ 。
(2)处理 NO2的原理之一为2NO2(g)+2C(s) N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2 N2O4)。
N2O4)。
①实验测得NO2的转化率与时间的关系如图所示:
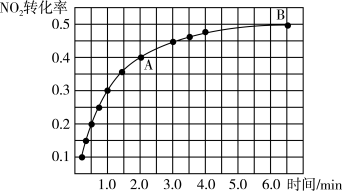
反应达到平衡时CO2的体积分数为____________ ,混合气体的平均摩尔质量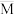 (A)
(A)____________ 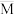 (B) (填“大于”“小于”或“等于”)。
(B) (填“大于”“小于”或“等于”)。
②下列能够判断该反应已达到平衡状态的是____________ (填序号)。
A.CO2的质量分数保持不变
B.容器中CO2与N2的百分含量之比保持不变
C.2v逆(NO2)=v正(N2)
D.混合气体的颜色保持不变
(3)羟基自由基(·OH)也可以用于脱硫脱硝。图表示光催化氧化技术可生成·OH,光照时,价带失去电子产生空穴(h+,具有强氧化性),价带上H2O直接转化为·OH, 在导带获得电子生成H2O2或
在导带获得电子生成H2O2或 ,最终转化为·OH。
,最终转化为·OH。

①价带上H2O遇h+直接转化为·OH的反应式可表示为______ ;
②在净化器中·OH与NO反应的化学方程式可表示为______ 。
(1)N2O是硝酸工业中氨催化氧化的副产物,CO处理N2O的原理为CO+N2O=N2+CO2。
①硝酸工业中氨被氧化成一氧化氮,生成的一氧化氮被反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸。写出一氧化氮到硝酸的总化学方程式:
②在Fe+作用下,反应CO+N2O=N2+CO2分两步进行,已知第ⅰ步反应为
N2O+Fe+=N2+FeO+,试写出第ⅱ步反应的方程式:
(2)处理 NO2的原理之一为2NO2(g)+2C(s)
 N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2 N2O4)。
N2O4)。①实验测得NO2的转化率与时间的关系如图所示:

反应达到平衡时CO2的体积分数为
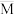 (A)
(A)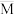 (B) (填“大于”“小于”或“等于”)。
(B) (填“大于”“小于”或“等于”)。②下列能够判断该反应已达到平衡状态的是
A.CO2的质量分数保持不变
B.容器中CO2与N2的百分含量之比保持不变
C.2v逆(NO2)=v正(N2)
D.混合气体的颜色保持不变
(3)羟基自由基(·OH)也可以用于脱硫脱硝。图表示光催化氧化技术可生成·OH,光照时,价带失去电子产生空穴(h+,具有强氧化性),价带上H2O直接转化为·OH,
 在导带获得电子生成H2O2或
在导带获得电子生成H2O2或 ,最终转化为·OH。
,最终转化为·OH。
①价带上H2O遇h+直接转化为·OH的反应式可表示为
②在净化器中·OH与NO反应的化学方程式可表示为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】“科学态度”是科学研究的基本要求,“社会责任”是化学人人生观和价值观的基本体现,“科学态度与社会责任”是化学的核心素养。
Ⅰ.Fenton 法常用于处理含难降解有机物的工业废水,在加入 Fe2+并调好 pH 后再加入 H2O2,该过程中 H2O2所产生羟基自由基(·OH)能氧化降解污染物。现运用该法降解某有机污染物(p-CP),探究有关因素对该降解反应速率的影响。
实验数据:(表中时间,是 p-CP 浓度降低 1.50mol/L 所需时间)
请回答:
(1)V1=___________ mL,V2=___________ mL。
(2)实验①条件下,p-CP 的降解速率为:___________ 。
(3)设置实验①②的目的是:_______ ;由实验①④可得到的结论是:___________ 。
(4)实验⑤在 200s 时没有检测到p-CP 浓度的变化。其原因可能是:___________ 。
Ⅱ.工业上可采用高温热分解 H2S 的方法制取 H2,并在膜反应器中分离 H2,其中发生的反应: △H,已知:①
△H,已知:① △H1;②
△H1;②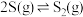 △H2。
△H2。
(5)则△H =___________ (用含△H1、△H2 的式子表示)。
(6)通过盖斯定律可计算。已知在 25℃、101 kPa 时:①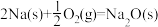 △H=−412kJ∙mol−1; ②
△H=−412kJ∙mol−1; ②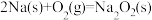 △H=−511kJ∙mol−1,写出 Na2O2 与 Na 反应生成 Na2O 的热化学方程式
△H=−511kJ∙mol−1,写出 Na2O2 与 Na 反应生成 Na2O 的热化学方程式___________ 。
Ⅰ.Fenton 法常用于处理含难降解有机物的工业废水,在加入 Fe2+并调好 pH 后再加入 H2O2,该过程中 H2O2所产生羟基自由基(·OH)能氧化降解污染物。现运用该法降解某有机污染物(p-CP),探究有关因素对该降解反应速率的影响。
实验数据:(表中时间,是 p-CP 浓度降低 1.50mol/L 所需时间)
实验编号 | H2O2 溶液 | Fe2+溶液 | 蒸馏水 | pH | 温度 | 时间 | ||
| cmol·L-1 | V/mL | cmol·L-1 | V/mL | V/mL | T/K | t/s | ||
| ① | 6.0×10-3 | 1.50 | 3.0×10-2 | 3.50 | 10.00 | 3 | 298 | 200 |
| ② | 6.0×10-3 | 1.50 | 3.0×10-2 | 3.50 | 10.00 | 3 | 313 | 60 |
| ③ | 6.0×10-3 | 3.50 | 3.0×10-2 | 3.50 | V1 | 3 | 298 | 140 |
| ④ | 6.0×10-3 | 1.50 | 3.0×10-2 | 4.50 | 9.00 | 3 | 298 | 170 |
| ⑤ | 6.0×10-3 | 1.50 | 3.0×10-2 | 3.50 | V2 | 12 | 298 | 0 |
(1)V1=
(2)实验①条件下,p-CP 的降解速率为:
(3)设置实验①②的目的是:
(4)实验⑤在 200s 时没有检测到p-CP 浓度的变化。其原因可能是:
Ⅱ.工业上可采用高温热分解 H2S 的方法制取 H2,并在膜反应器中分离 H2,其中发生的反应:
 △H,已知:①
△H,已知:① △H1;②
△H1;②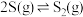 △H2。
△H2。(5)则△H =
(6)通过盖斯定律可计算。已知在 25℃、101 kPa 时:①
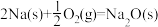 △H=−412kJ∙mol−1; ②
△H=−412kJ∙mol−1; ②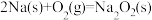 △H=−511kJ∙mol−1,写出 Na2O2 与 Na 反应生成 Na2O 的热化学方程式
△H=−511kJ∙mol−1,写出 Na2O2 与 Na 反应生成 Na2O 的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】工厂烟气(主要污染物 、NO)直接排放会造成空气污染,需处理后才能排放。
、NO)直接排放会造成空气污染,需处理后才能排放。
(1) 氧化。反应物断键吸收的能量越少,反应速率越快,
氧化。反应物断键吸收的能量越少,反应速率越快, 氧化
氧化 、NO反应的能量变化如图1和如图2所示。
、NO反应的能量变化如图1和如图2所示。
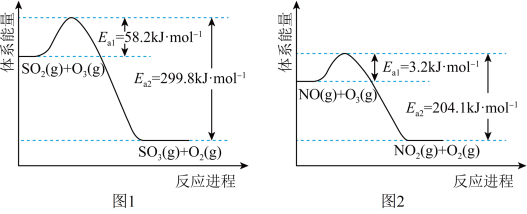
 氧化
氧化 、NO的反应为:
、NO的反应为:
A.
B.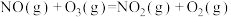
反应A_____ (填”放热”或“吸热”)_____  。
。
(2)某化学兴趣小组构想将NO转化为 脱除,装置如图3,电极为多孔惰性材料。则负极的电极反应式是
脱除,装置如图3,电极为多孔惰性材料。则负极的电极反应式是_____ 。
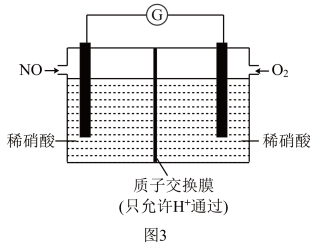
(3)“纳米零价铁— ”体系可将烟气中难溶的NO氧化为可溶的
”体系可将烟气中难溶的NO氧化为可溶的 。
。
在一定温度下,将 溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。

① 催化
催化 分解产生
分解产生 ,
, 将NO氧化为
将NO氧化为 的机理如图4所示,Y的化学式为
的机理如图4所示,Y的化学式为_____ 。
②NO与 反应生成
反应生成 的化学方程式为
的化学方程式为_____ 。
③纳米零价铁的作用是_____ 。
④NO脱除率随温度的变化如图5所示。温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是_____ 。
 、NO)直接排放会造成空气污染,需处理后才能排放。
、NO)直接排放会造成空气污染,需处理后才能排放。(1)
 氧化。反应物断键吸收的能量越少,反应速率越快,
氧化。反应物断键吸收的能量越少,反应速率越快, 氧化
氧化 、NO反应的能量变化如图1和如图2所示。
、NO反应的能量变化如图1和如图2所示。
 氧化
氧化 、NO的反应为:
、NO的反应为:A.

B.
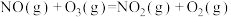
反应A
 。
。(2)某化学兴趣小组构想将NO转化为
 脱除,装置如图3,电极为多孔惰性材料。则负极的电极反应式是
脱除,装置如图3,电极为多孔惰性材料。则负极的电极反应式是
(3)“纳米零价铁—
 ”体系可将烟气中难溶的NO氧化为可溶的
”体系可将烟气中难溶的NO氧化为可溶的 。
。在一定温度下,将
 溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
①
 催化
催化 分解产生
分解产生 ,
, 将NO氧化为
将NO氧化为 的机理如图4所示,Y的化学式为
的机理如图4所示,Y的化学式为②NO与
 反应生成
反应生成 的化学方程式为
的化学方程式为③纳米零价铁的作用是
④NO脱除率随温度的变化如图5所示。温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】Ⅰ.某探究性学习小组利用 溶液和酸性
溶液和酸性 溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。
溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。
(1)通过实验A、B可探究___________ (填外部因素)的改变对反应速率的影响,其中
___________ ;
___________ ;通过实验___________ 可探究温度变化对化学反应速率的影响。
(2)若 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是___________ ;利用实验B中数据计算,用 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为___________ mol/(L·min)。
Ⅱ.在2L密闭容器中进行反应:mX(g)+nY(g)=pZ(g)+qQ(g),式中 为化学计量数。在0~3min内,各物质物质的量的变化如下表所示:
为化学计量数。在0~3min内,各物质物质的量的变化如下表所示:
已知2min内v(Q)=0.3mol·L−1·min−1,v (Z):v (Y)=2:3。
(3)化学方程式中m=___________ ,n=___________ ,p=___________ ,q=___________ 。
 溶液和酸性
溶液和酸性 溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。
溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。| 实验序号 | 实验温度/K |  溶液(含硫酸) 溶液(含硫酸) |  溶液 溶液 |  | 溶液颜色褪至无色时所需时间/s | ||
 | 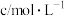 |  | 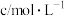 |  | |||
| A | 293 | 2 | 0.02 | 5 | 0.1 | 5 |  |
| B |  | 2 | 0.02 | 4 | 0.1 |  | 8 |
| C | 313 | 2 | 0.02 |  | 0.1 | 6 |  |


(2)若
 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为Ⅱ.在2L密闭容器中进行反应:mX(g)+nY(g)=pZ(g)+qQ(g),式中
 为化学计量数。在0~3min内,各物质物质的量的变化如下表所示:
为化学计量数。在0~3min内,各物质物质的量的变化如下表所示:| X | Y | Z | Q | |
| 起始/mol | 1.2 | 0 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
(3)化学方程式中m=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】化学实验是研究物质变化的重要手段,对于揭示化学反应规律,获得调控反应的理论依据,以及日常生活和工农业生产都具有重要的意义。
(1)用下图所示装置进行中和反应反应热的测定实验,请回答下列问题:
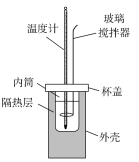
简易量热计示意图
②近似认为50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液的密度都是1 ,中和后生成溶液的比热容c=4.18J/(g∙℃)。则中和热
,中和后生成溶液的比热容c=4.18J/(g∙℃)。则中和热
______ kJ/mol(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是_______ (填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定 溶液的温度
溶液的温度
(2)某化学兴趣小组探究浓度对化学反应速率的影响,选择酸性 溶液与草酸(
溶液与草酸( )溶液的反应作为研究对象,已知
)溶液的反应作为研究对象,已知 。25℃时,测定溶液褪色所需的时间,依据褪色快慢比较浓度对反应速率的影响,小组同学为此设计出两种实验方案。
。25℃时,测定溶液褪色所需的时间,依据褪色快慢比较浓度对反应速率的影响,小组同学为此设计出两种实验方案。
你认为___________ (填“方案一”或“方案二”)可行,理由是___________ 。
(3)工业合成氨是人类科学技术的一项重大突破,对国民经济和社会发展具有重要的意义。已知:
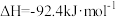 。不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数)如下表所示:
。不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数)如下表所示:
①为了提高平衡混合物中氨的含量,根据化学平衡移动原理,仅从理论上分析合成氨适宜的条件是_________ (填字母)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②实际生产中一般采用的反应条件为400~500℃和10MPa~30MPa,原因可能是_____ 。
(1)用下图所示装置进行中和反应反应热的测定实验,请回答下列问题:

简易量热计示意图
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | 温度差平均值 (t2-t1)℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | ① |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
 ,中和后生成溶液的比热容c=4.18J/(g∙℃)。则中和热
,中和后生成溶液的比热容c=4.18J/(g∙℃)。则中和热
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定
 溶液的温度
溶液的温度(2)某化学兴趣小组探究浓度对化学反应速率的影响,选择酸性
 溶液与草酸(
溶液与草酸( )溶液的反应作为研究对象,已知
)溶液的反应作为研究对象,已知 。25℃时,测定溶液褪色所需的时间,依据褪色快慢比较浓度对反应速率的影响,小组同学为此设计出两种实验方案。
。25℃时,测定溶液褪色所需的时间,依据褪色快慢比较浓度对反应速率的影响,小组同学为此设计出两种实验方案。| 实验方案 | 酸性 溶液 溶液 |  溶液 溶液 | 紫红色溶液退至无色所需时间t/min | |||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | |||
| 方案一 | ① | 4 | 0.01 | 2 | 0.2 | t1 |
| ② | 4 | 0.02 | 2 | 0.2 | t2 | |
| 方案二 | ③ | 4 | 0.01 | 2 | 0.1 | t3 |
| ④ | 4 | 0.01 | 2 | 0.2 | t4 | |
(3)工业合成氨是人类科学技术的一项重大突破,对国民经济和社会发展具有重要的意义。已知:

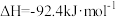 。不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数)如下表所示:
。不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数)如下表所示:| 温度/℃ | 氨的含量/% | ||||
| 0.1MPa | 10MPa | 20MPa | 30MPa | 60MPa | |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 |
| 300 | 2.20 | 52.0 | 64.2 | 71.0 | 84.2 |
| 400 | 0.40 | 25.1 | 38.2 | 47.0 | 65.2 |
| 500 | 0.10 | 10.6 | 19.1 | 26.4 | 42.2 |
| 600 | 0.05 | 4.50 | 9.10 | 13.8 | 23.1 |
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②实际生产中一般采用的反应条件为400~500℃和10MPa~30MPa,原因可能是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某同学进行了 与硫酸反应的有关实验,实验过程的数据记录如下(见表格)
与硫酸反应的有关实验,实验过程的数据记录如下(见表格)
(1)写出 溶液与稀硫酸反应的化学方程式为
溶液与稀硫酸反应的化学方程式为___________ 。
(2)A开始反应时硫代硫酸钠溶液的浓度为___________ mol/L (忽略不同溶液混合的体积变化);
(3)根据你所掌握的知识,在上述实验中,反应速率最快的可能是___________ (填实验序号);实验中,利用出现___________ (填现象)的快慢来比较反应速率的快慢;
(4)A和B的组合研究的是硫代硫酸钠浓度对反应速率的影响,表格中
___________ ;
(5)能说明温度对该反应速率影响的组合是___________ (填实验序号)。
 与硫酸反应的有关实验,实验过程的数据记录如下(见表格)
与硫酸反应的有关实验,实验过程的数据记录如下(见表格)| 实验序号 | 反应温度 | 硫代硫酸钠 | 硫酸 | 水 | ||
体积( ) ) | 浓度( ) ) | 体积( ) ) | 浓度( L L | )体积( ) ) | ||
| A |  | 10 | 0.1 | 10 | 0.1 | 0 |
| B |  | 5 | 0.1 | 10 | 0.1 | V |
| C |  | 10 | 0.1 | 5 | 0.1 | 5 |
| D |  | 10 | 0.1 | 10 | 0.1 | 0 |
 溶液与稀硫酸反应的化学方程式为
溶液与稀硫酸反应的化学方程式为(2)A开始反应时硫代硫酸钠溶液的浓度为
(3)根据你所掌握的知识,在上述实验中,反应速率最快的可能是
(4)A和B的组合研究的是硫代硫酸钠浓度对反应速率的影响,表格中

(5)能说明温度对该反应速率影响的组合是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】为探究硫酸亚铁的分解产物,将已加热至恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
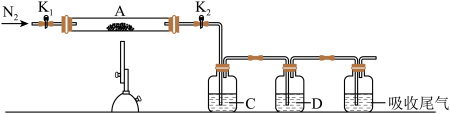
①C、D中的溶液依次为___ 、___ (填标号)。C、D中有气泡冒出,并可观察到的现象分别为___ 。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式___ 。

①C、D中的溶液依次为
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】回答下列问题:
(1)某化学学习小组为探究NO2和SO2的反应,进行如下实验(如图所示)。
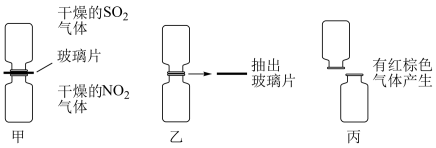
①图甲两集气瓶中_______ (填“上”或“下”)瓶颜色深。
②图丙中“有红棕色气体产生”说明SO2和NO2反应的产物中有_______ ,说明NO2在该反应中显_______ 性。
③由图乙和图丙中的现象写出NO2和SO2反应的化学方程式:_______ 。
(2)某课外活动小组探究镁与NO2的反应。已知镁与CO2反应如下:2Mg+CO2 2MgO+C
2MgO+C
①该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测,写出Mg与NO2反应的化学方程式:_______ 。
②设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)
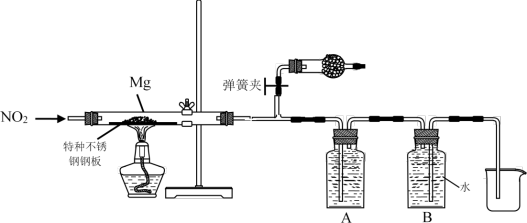
资料信息:2NO2+2NaOH=NaNO3+NaNO2+H2O
Ⅰ.装置A中的试剂是_______ 。
Ⅱ.干燥管和装置B的作用分别是_______ 、_______ 。
Ⅲ.实验开始时正确的操作步骤是_______ 。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
(1)某化学学习小组为探究NO2和SO2的反应,进行如下实验(如图所示)。

①图甲两集气瓶中
②图丙中“有红棕色气体产生”说明SO2和NO2反应的产物中有
③由图乙和图丙中的现象写出NO2和SO2反应的化学方程式:
(2)某课外活动小组探究镁与NO2的反应。已知镁与CO2反应如下:2Mg+CO2
 2MgO+C
2MgO+C①该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测,写出Mg与NO2反应的化学方程式:
②设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)

资料信息:2NO2+2NaOH=NaNO3+NaNO2+H2O
Ⅰ.装置A中的试剂是
Ⅱ.干燥管和装置B的作用分别是
Ⅲ.实验开始时正确的操作步骤是
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验:
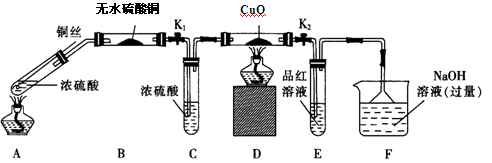
(1)F装置的烧杯中发生反应的离子方程式是_____________ ;B装置中的现象是__________ 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是_________ 。
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是_________ 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是_________ 。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4=cCu2S+dCuSO4+eH2O,则a∶b=______
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量 KI溶液中振荡,以淀粉溶液为指示剂,用0.36 mol·L-1的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为___ 。
(已知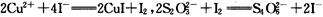 )
)
实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验:

(1)F装置的烧杯中发生反应的离子方程式是
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4=cCu2S+dCuSO4+eH2O,则a∶b=
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量 KI溶液中振荡,以淀粉溶液为指示剂,用0.36 mol·L-1的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为
(已知
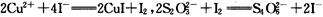 )
)
您最近一年使用:0次



