铝渣主要成分为Al2O3,含少量Fe3O4、CuO、PbCO3、MnCO3。 以铝渣为原料制备半导体AlN的基本工艺流程如下图所示。
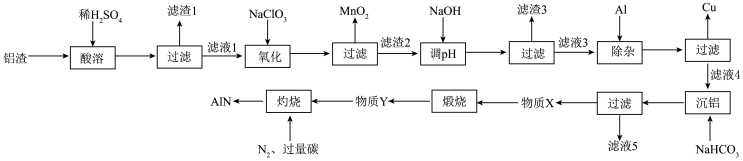
已知:I.“酸溶”时铝渣中金属元素的化合价均未发生变化。
II.“氧化”时锰以及部分铁元素化合价发生了变化。
回答下列问题:
(1)能够加快“酸溶”速率的措施有___________ (答一 条即可), 滤渣1的主要成分是___________ (填化学式) 。
(2)“氧化”时生成MnO2的离子方程式为___________ ;若 “氧化”过程中溶液中n(H+)未变,则铝渣中Fe3O4与MnCO3的物质的量之比为___________ 。
(3)常温下,Ksp[Al(OH)3] =4.0 ×10-33。“氧化” 后滤液2中c(Al3+)= 0.1 mol·L-1,若将滤液2的pH调至3.5,___________ (填 “会”或“不会”)产生Al(OH)3沉淀。
(4)“沉铝”时,反应的离子方程式为____________ ,写出该反应的一个用途___________ 。
(5)“灼烧”时得到AlN的化学方程式为___________ ; 该过程反应后期需通入一定量的空气,其目的是___________ (从提高 AlN纯度角度考虑)。

已知:I.“酸溶”时铝渣中金属元素的化合价均未发生变化。
II.“氧化”时锰以及部分铁元素化合价发生了变化。
回答下列问题:
(1)能够加快“酸溶”速率的措施有
(2)“氧化”时生成MnO2的离子方程式为
(3)常温下,Ksp[Al(OH)3] =4.0 ×10-33。“氧化” 后滤液2中c(Al3+)= 0.1 mol·L-1,若将滤液2的pH调至3.5,
(4)“沉铝”时,反应的离子方程式为
(5)“灼烧”时得到AlN的化学方程式为
更新时间:2022/01/24 09:28:55
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。铝土矿的主要成分是Al2O3、Fe2O3和SiO2等(SiO2为酸性氧化物)。从铝土矿中提炼Al2O3的流程如下:
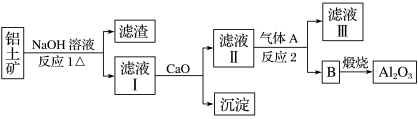
回答下列问题:
(1)写出反应1中Al2O3发生反应的化学方程式_______ 。
(2)滤液Ⅰ中加入CaO生成的沉淀是CaSiO3,反应2的离子方程式为_______ 。
(3)反应2中不用盐酸(或H2SO4)的理由是_______ 。

回答下列问题:
(1)写出反应1中Al2O3发生反应的化学方程式
(2)滤液Ⅰ中加入CaO生成的沉淀是CaSiO3,反应2的离子方程式为
(3)反应2中不用盐酸(或H2SO4)的理由是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:

(1)沉淀A、B的成分分别是________ 、__________ ;步骤①中的试剂a是___________ ;
(2)步骤①②中加入试剂后进行的操作Ⅰ、Ⅱ的名称是___________ ;
(3)步骤②中加入过量NaOH溶液发生反应的离子方程式是_________ 、_________ 、___________ ;
(4)步骤③中通入过量CO2气体而不加入过量盐酸的理由是___________________________________ ;
(5)准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10 mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为____________ 。


(1)沉淀A、B的成分分别是
(2)步骤①②中加入试剂后进行的操作Ⅰ、Ⅱ的名称是
(3)步骤②中加入过量NaOH溶液发生反应的离子方程式是
(4)步骤③中通入过量CO2气体而不加入过量盐酸的理由是
(5)准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10 mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如图:
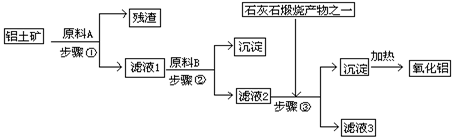
(1) 原料A的名称是_______ ,步骤①反应的离子方程式是_______ 。
(2) 滤液1中要加入稍过量原料B,原料B的化学式是_______ ,步骤②反应的离子方程式是_______
(3) 步骤③的化学方程式是:_______ 。
(4) 如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化铝的提取有什么影响_______ 。

(1) 原料A的名称是
(2) 滤液1中要加入稍过量原料B,原料B的化学式是
(3) 步骤③的化学方程式是:
(4) 如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化铝的提取有什么影响
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】2021年我国制氢量位居世界第一,煤气化制氢途径的原理如下:
Ⅰ.

Ⅱ.
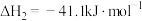
回答下列问题:
(1)

_______  。
。
(2)一定温度下,向体积固定的密闭容器中加入足量的 和
和 ,起始压强为
,起始压强为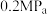 ,发生煤气化制氢反应。
,发生煤气化制氢反应。
①反应Ⅰ的平衡常数表达式
_______ 。
②平衡时向容器中充入情性气体,平衡_____ 移动(填“正向”“逆向”或“不”,下同),加入固体 ,平衡
,平衡____ 移动。
③下列能说明反应Ⅰ到达平衡状态的是_______ 。
A.混合气体的密度保持不变 B.容器内的压强保持不变
C. 的体积保持不变 D.断裂
的体积保持不变 D.断裂 的同时,生成
的同时,生成 键
键
(3)常温下,保持压强为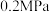 不变,向密闭容器中加入足量的
不变,向密闭容器中加入足量的 和
和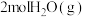 ,反应达平衡时,
,反应达平衡时, 物质的量为
物质的量为
 的物质的量为
的物质的量为 ;反应Ⅱ的平衡常数
;反应Ⅱ的平衡常数
_______ (以分压表示,分压=总压×物质的量分数)
(4) 时,潮湿的石膏雕像表面会发生反应:
时,潮湿的石膏雕像表面会发生反应: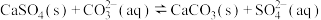 ,其平衡常数
,其平衡常数
________ 。[已知 ,
,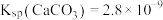 ]
]
Ⅰ.


Ⅱ.

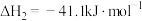
回答下列问题:
(1)


 。
。(2)一定温度下,向体积固定的密闭容器中加入足量的
 和
和 ,起始压强为
,起始压强为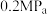 ,发生煤气化制氢反应。
,发生煤气化制氢反应。①反应Ⅰ的平衡常数表达式

②平衡时向容器中充入情性气体,平衡
 ,平衡
,平衡③下列能说明反应Ⅰ到达平衡状态的是
A.混合气体的密度保持不变 B.容器内的压强保持不变
C.
 的体积保持不变 D.断裂
的体积保持不变 D.断裂 的同时,生成
的同时,生成 键
键(3)常温下,保持压强为
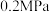 不变,向密闭容器中加入足量的
不变,向密闭容器中加入足量的 和
和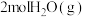 ,反应达平衡时,
,反应达平衡时, 物质的量为
物质的量为
 的物质的量为
的物质的量为 ;反应Ⅱ的平衡常数
;反应Ⅱ的平衡常数
(4)
 时,潮湿的石膏雕像表面会发生反应:
时,潮湿的石膏雕像表面会发生反应: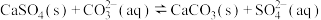 ,其平衡常数
,其平衡常数
 ,
,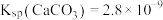 ]
]
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】以钛白酸废液(主要含有TiO2+、Fe2+、Ca2+、SO42-等)为原料,获取磷酸钛(2TiO2•P2O5•H2O)和氧化铁黑(Fe3O4)的部分流程如图:__ 。工业生产中能提高该反应转化速率的合理措施有__ 。
a.将H3PO4改为Na3PO4 b.搅拌反应液 c.适当加热反应液
(2)反应Ⅰ后过滤得到的磷酸钛滤渣经充分洗涤,洗涤液须与滤液合并的原因是__ 。
(3)若除钙后所得溶液中c(F-)=2.0×10-3mol•L-1,则溶液中c(Ca2+)=__ 。[已知:Ksp(CaF2)=4.0×10-11]
(4)反应Ⅱ在80℃条件下进行,反应过程中通入空气速率与产物中Fe3O4纯度的关系如图所示。__ (填“增大”或“不变”或“减小”)。
②过程中若通入空气速率过快,氧化铁黑产品中可能会混有的杂质为__ 。
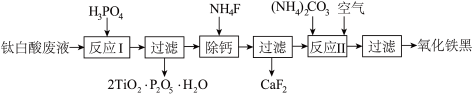
a.将H3PO4改为Na3PO4 b.搅拌反应液 c.适当加热反应液
(2)反应Ⅰ后过滤得到的磷酸钛滤渣经充分洗涤,洗涤液须与滤液合并的原因是
(3)若除钙后所得溶液中c(F-)=2.0×10-3mol•L-1,则溶液中c(Ca2+)=
(4)反应Ⅱ在80℃条件下进行,反应过程中通入空气速率与产物中Fe3O4纯度的关系如图所示。
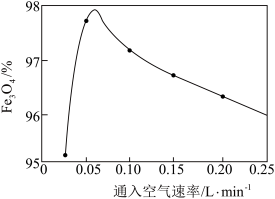
②过程中若通入空气速率过快,氧化铁黑产品中可能会混有的杂质为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
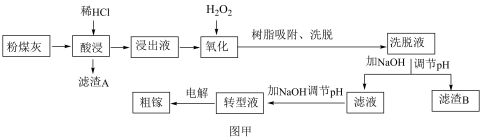
【推荐3】我国某地粉煤灰中镓含量丰富,其主要成分以Ga2O3的形式存在,除此之外还含有Al2O3、Fe3O4、SiO2等杂质。已知从粉煤灰中回收镓的工艺流程如图甲所示。 的形式存在,
的形式存在,
(ⅱ)Ksp[Ga(OH)3]=1.4×10-34,Ksp[Fe(OH)3]=2.7×10-39,Ksp[Al(OH)3]=1.9×10-33,Ksp[Fe(OH)2]=4.87×10-17。
回答下列问题:
(1)滤渣A中一定含有的成分是________ 。
(2)“氧化”过程中加入H2O2的目的是________ ,该过程中发生反应的离子方程式为_______ 。
(3)洗脱液中还有少量的Fe3+、Ga3+,其中Ga3+浓度为1.4×10-4mol/L,列式计算 当Fe3+恰好沉淀完全时[c(Fe3+)≤1.0×10-5mol/L],Ga3+是否开始沉淀_______ 。
(4)流程图第一次调节pH的目的是________ 。
(5)电解法可以提纯粗镓,具体原理如图乙所示:①粗镓与电源_____ 极相连(填“正”或“负”)。②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成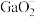 ,
,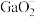 在阴极放电的电极反应式为
在阴极放电的电极反应式为_______ 。
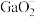 的形式存在,
的形式存在,(ⅱ)Ksp[Ga(OH)3]=1.4×10-34,Ksp[Fe(OH)3]=2.7×10-39,Ksp[Al(OH)3]=1.9×10-33,Ksp[Fe(OH)2]=4.87×10-17。
回答下列问题:
(1)滤渣A中一定含有的成分是
(2)“氧化”过程中加入H2O2的目的是
(3)洗脱液中还有少量的Fe3+、Ga3+,其中Ga3+浓度为1.4×10-4mol/L,
(4)流程图第一次调节pH的目的是
(5)电解法可以提纯粗镓,具体原理如图乙所示:①粗镓与电源
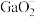 ,
,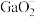 在阴极放电的电极反应式为
在阴极放电的电极反应式为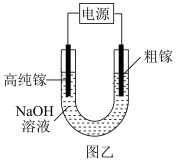
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】工业上采用软锰矿(主要成分为MnO2)来制取硫酸锰,工艺流程如下:
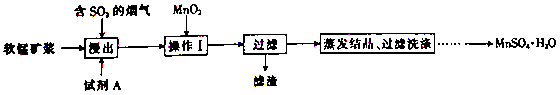
已知:浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+。回答下列问题:
(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、烧杯和______ 。
(2)浸出后,锰主要以Mn2+的形式存在,写出MnO2与SO2反应的离子方程式:____________ 。
(3)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将不利于软锰矿浆继续吸收SO2。欲消除生成的硫酸,可选用的试剂A是______ (填字母)。
A.MnCO3 B.MnO2 C.Mn(OH)2 D.MnSO4
(4)操作I的目的是__________ 和调节溶液的pH至3~4。检验过滤后的滤液中是否含有Fe3+的操作是_______________ 。

已知:浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+。回答下列问题:
(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、烧杯和
(2)浸出后,锰主要以Mn2+的形式存在,写出MnO2与SO2反应的离子方程式:
(3)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将不利于软锰矿浆继续吸收SO2。欲消除生成的硫酸,可选用的试剂A是
A.MnCO3 B.MnO2 C.Mn(OH)2 D.MnSO4
(4)操作I的目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】氯化铁可用作金属蚀刻、有机合成的催化剂,研究其制备及性质是一个重要的课题。
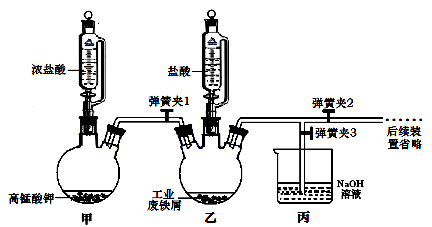
(1)氯化铁晶体的制备:
①实验过程中装置乙发生反应的离子方程式有___________________ ,仪器丙的作用为___________ 。
②为顺利达成实验目的,上述装置中弹簧夹打开和关闭的顺序为_____________________ 。
③反应结束后,将乙中溶液边加入_______ ,边进行加热浓缩、______________ 、过滤、洗涤、干燥即得到产品。
(2)氯化铁的性质探究:
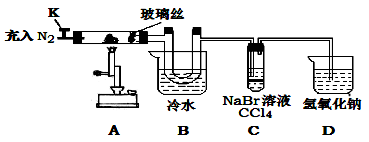
某兴趣小组将饱和FeCl3溶液进行加热蒸发、蒸干灼烧,在试管底部没有得到预期的红棕色固体。为进一步探究该固体的成分设计了如下实验。(查阅文献知:①FeCl3溶液浓度越大,水解程度越小②氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2 ③FeCl2熔点670℃)

(1)氯化铁晶体的制备:
①实验过程中装置乙发生反应的离子方程式有
②为顺利达成实验目的,上述装置中弹簧夹打开和关闭的顺序为
③反应结束后,将乙中溶液边加入
(2)氯化铁的性质探究:
某兴趣小组将饱和FeCl3溶液进行加热蒸发、蒸干灼烧,在试管底部没有得到预期的红棕色固体。为进一步探究该固体的成分设计了如下实验。(查阅文献知:①FeCl3溶液浓度越大,水解程度越小②氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2 ③FeCl2熔点670℃)

| 操作步骤 | 实验现象 | 解释原因 |
| 打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因 |
| 关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因 |
| 实验结束,振荡C静置 | ③ | ④ (用相关的方程式说明) |
| ⑤结合以上实验和文献资料,该未知固体可以确定的成分有 | ||
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】胆矾(CuSO4 • 5H2O)可用于治疗风痰、癫痫等疾病,工业上用铜镍矿石(主要成分:CuS、NiS、FeS、SiO2及不溶于酸的杂质)生产胆矾的流程如下:

已知有机萃取剂HR可以萃取Cu2+,却不能萃取Ni2+,其萃取原理如下(org为有机相):Cu2+(aq)+2(HR)org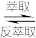 (CuR2)org+2H+(aq),据此回答下列问题:
(CuR2)org+2H+(aq),据此回答下列问题:
(1)焙烧前粉碎的目的是___________ ;为减少污染,焙烧产生的烟气可用酸性KMnO4溶液吸收,写出吸收反应的离子方程式:___________ 。
(2)“氧化”的目的是___________
(3)25℃时,“调节pH”后滤液中c(Fe3+)=10-8mol·L-1,且滤渣2已有Fe(OH)3沉淀,则该滤液的pH为___________ ;若在滤渣2中未检测出Cu(OH)2沉淀,则滤液中c(Cu2+)≤___________ mol·L-1。已知Ksp[Fe(OH)3]=8.0×10-38;Ksp[Cu(OH)2]=5.2×10-20;Ksp[Ni(OH)2]=2.0×10-15;lg5≈0.7。
(4)最佳试剂X为___________ (填化学式)。
(5)操作I需要用到的主要玻璃仪器是___________
(6)为测定产品纯度,取2.00g样品,溶于锥形瓶中,加入过量KI溶液,发生反应:2Cu2++4I-=2CuI↓+I2,之后用0.50mol• L-1的Na2S2O3溶液滴定,重复上述实验两到三次,测得平均消耗Na2S2O3标准液15.00mL,则产品的纯度为___________ %。(滴定反应为:2S2O +I2=S4O
+I2=S4O +2I-)
+2I-)

已知有机萃取剂HR可以萃取Cu2+,却不能萃取Ni2+,其萃取原理如下(org为有机相):Cu2+(aq)+2(HR)org
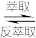 (CuR2)org+2H+(aq),据此回答下列问题:
(CuR2)org+2H+(aq),据此回答下列问题:(1)焙烧前粉碎的目的是
(2)“氧化”的目的是
(3)25℃时,“调节pH”后滤液中c(Fe3+)=10-8mol·L-1,且滤渣2已有Fe(OH)3沉淀,则该滤液的pH为
(4)最佳试剂X为
(5)操作I需要用到的主要玻璃仪器是
(6)为测定产品纯度,取2.00g样品,溶于锥形瓶中,加入过量KI溶液,发生反应:2Cu2++4I-=2CuI↓+I2,之后用0.50mol• L-1的Na2S2O3溶液滴定,重复上述实验两到三次,测得平均消耗Na2S2O3标准液15.00mL,则产品的纯度为
 +I2=S4O
+I2=S4O +2I-)
+2I-)
您最近一年使用:0次



