氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法不正确的是
| A.一定温度下,反应2H2(g)+O2(g)=2H2O(g)能自发进行,该反应的△H<0 |
| B.氢能有可能成为人类未来的主要能源 |
| C.氢氧燃料电池放电过程中消耗11.2LH2,则转移电子的数目为6.02×1023 |
| D.反应2H2(g)+O2(g)=2H2O(g)的△H可通过下式估算:△H=反应中断裂旧共价键的键能之和-反应中形成新共价键的键能之和 |
更新时间:2022-01-23 21:22:37
|
相似题推荐
单选题
|
较易
(0.85)
解题方法
【推荐1】如图是某些化学键的键能,
对于反应:
 ,a的值为
,a的值为
| 化学键 |  |  |  |
键能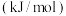 | 436 | 496 | 463 |
对于反应:

 ,a的值为
,a的值为| A.242 | B. | C.484 | D. |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】已知断裂1mol H2(g)中的H—H键需要吸收436.4kJ的能量,断裂1molO2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1mol H—O键能放出462.8kJ的能量。下列说法正确的是
| A.断裂1mol H2O中的化学键需要吸收925.6kJ的能量 |
| B.2H2(g)+ O2(g)=2H2O (g) △H=-480.4 kJ·mol-1 |
| C.2H2O(l) = 2H2 (g) + O2(g) △H=-471.6 kJ·mol-1 |
| D.H2(g)+ 1/2O2(g)=H2O (l) △H=-240.2 kJ·mol-1 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐1】下列说法中,正确的是
| A.同一物质固、液、气三种状态的熵值相同 |
| B.凡是熵增大的反应都是自发反应 |
| C.要判断反应进行的方向,必须综合考虑体系的焓变和熵变 |
| D.过程的自发性不仅能用于判断过程的方向,还能确定过程是否一定能迅速发生 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列说法正确的是
A.常温下,若反应A(s)+B(g)=C(g)+D(g)不能自发进行,则该反应的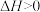 |
B.应该投入大量资金研究2CO(g)→2C(s)+O2(g) 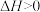 该过程发生的条件,以解决含碳燃料不充分燃烧引起的环境问题 该过程发生的条件,以解决含碳燃料不充分燃烧引起的环境问题 |
| C.熵增的反应都是自发的,自发反应的现象一定非常明显 |
D.已知C(s)+CO2(g)=2CO(g) 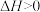 ,该反应吸热,一定不能自发进行 ,该反应吸热,一定不能自发进行 |
您最近一年使用:0次
【推荐1】金属钾的冶炼可采用如下两种方法,方法一:K2CO3+2C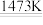 2K↑+3CO↑,方法二:2KF+CaC2
2K↑+3CO↑,方法二:2KF+CaC2 CaF2+2K↑+2C。下列有关说法合理的是
CaF2+2K↑+2C。下列有关说法合理的是
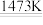 2K↑+3CO↑,方法二:2KF+CaC2
2K↑+3CO↑,方法二:2KF+CaC2 CaF2+2K↑+2C。下列有关说法合理的是
CaF2+2K↑+2C。下列有关说法合理的是| A.方法一中碳元素只被氧化 |
| B.方法二CaC2中碳的化合价为+1 |
| C.方法二中氧化剂和还原剂的物质的量之比为2∶1 |
| D.两种方法中,当生成相同物质的量的K时,转移的电子数相同 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】我国研究人员研发了一种新型纳米催化剂,实现CO2和H2反应得到CH4,部分微粒转化过程如图(吸附在催化剂表面上的物种用*标注)。下列说法不正确 的是
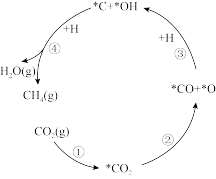

| A.过程②吸收热量 |
| B.过程③涉及极性键的断裂和形成 |
| C.结合过程③,过程④的方程式为*C+2*OH+6H→CH4+2H2O |
| D.整个过程中制得1molCH4转移电子的物质的量为6mol |
您最近一年使用:0次

 反应过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
反应过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
 变小
变小 ,则
,则
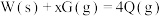

 一定小于0
一定小于0


