水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示。单位为mg·L-1。我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg·L-1.某化学小组同学设计了下列装置(夹持装置略) ,测定某河水的DO。
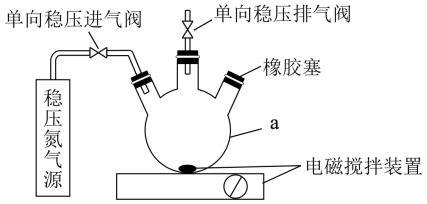
I.测定原理:
①在碱性条件下,O2将Mn2+氧化为MnO(OH)2;
②在酸性条件下,MnO(OH)2将I-氧化为I2,反应为MnO(OH)2+2I-+4H+=Mn2++I2 + 3H2O
③用Na2S2O3标准溶液滴定生成的I2,反应为2 +I2=
+I2= +2I-。
+2I-。
II.测定步骤:
i.安装好装置,检验装置的气密性,充入氮气一段时间后,停止充氮气;
ii.向仪器a中加入200 mL水样;
iii.用注射器向仪器a中依次迅速加入1 mL MnSO4无氧溶液(过量)、2 mL碱性KI无氧溶液(过量) ,开启搅拌器,进行①中反应至完全;
iv.搅拌并用注射器向仪器a中加入2 mLH2SO4无氧溶液,至②中反应完全,溶液为中性或弱酸性;
v.用注射器从仪器a中取出40 mL溶液,用淀粉作指示剂,用0.01 mol·L-1 Na2S2O3溶液进行滴定,记录数据;
vi.重复步骤V的操作2~3次;
vii.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)仪器a的名称为___________ 。
(2)写出①中反应的离子方程式:___________
(3)步骤i中起始充入氮气的目的是___________ 。
(4)步骤v中达到滴定终点的标志为___________ 。
(5)若某次滴定消耗Na2S2O3标准溶液3. 5 mL,则水样的DO=___________ mg·L-1.若为饮用水,则此次测得的DO___________ (填“已”或“未”)达标,判断的理由是___________ (写出具体的计算过程)。

I.测定原理:
①在碱性条件下,O2将Mn2+氧化为MnO(OH)2;
②在酸性条件下,MnO(OH)2将I-氧化为I2,反应为MnO(OH)2+2I-+4H+=Mn2++I2 + 3H2O
③用Na2S2O3标准溶液滴定生成的I2,反应为2
 +I2=
+I2= +2I-。
+2I-。 II.测定步骤:
i.安装好装置,检验装置的气密性,充入氮气一段时间后,停止充氮气;
ii.向仪器a中加入200 mL水样;
iii.用注射器向仪器a中依次迅速加入1 mL MnSO4无氧溶液(过量)、2 mL碱性KI无氧溶液(过量) ,开启搅拌器,进行①中反应至完全;
iv.搅拌并用注射器向仪器a中加入2 mLH2SO4无氧溶液,至②中反应完全,溶液为中性或弱酸性;
v.用注射器从仪器a中取出40 mL溶液,用淀粉作指示剂,用0.01 mol·L-1 Na2S2O3溶液进行滴定,记录数据;
vi.重复步骤V的操作2~3次;
vii.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)仪器a的名称为
(2)写出①中反应的离子方程式:
(3)步骤i中起始充入氮气的目的是
(4)步骤v中达到滴定终点的标志为
(5)若某次滴定消耗Na2S2O3标准溶液3. 5 mL,则水样的DO=
更新时间:2022-03-10 10:25:23
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】铅单质及其化合物在新能源领域应用广泛,工业上利用方铅精矿(主要成分为PbS)制备PbSO4的工艺流程如下:

已知:①PbCl2(s)+2Cl-(aq) PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。
PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。
(1)步骤Ⅰ中发现有淡黄色沉淀生成,请写出离子反应方程式:_______________________ ;
(2)步骤Ⅰ原料预处理过程中写出一种除搅拌外加快反应速率的办法:_________________ ;反应温度不宜过高,且需加入过量盐酸保证溶液呈强酸性,原因是:____________________ ;
(3)操作①应为:_______ ;操作②应为:_________ ;
A、趁热过滤 B、蒸发浓缩,冷却结晶; C、蒸发结晶 D、重结晶
(4)写出步骤III中PbCl2生成PbSO4的离子反应方程式:___________________________ ,该反应的平衡常数K=_______ ;
(5)铅蓄电池(Pb-PbO2-H2SO4)充电时的阳极反应方程式:_________________________ ;
(6)某铅蓄电池放电时电流为0.2A,可持续放电时间96500s,此时参加反应的Pb的质量为41.4g,求该电池放电的能量转化率α=_________ 。(电池能量转化率的定义:α=实际输出电量/理论输出电量×100%,结果保留两位有效数字,已知法拉第常数为96500C/mol)

已知:①PbCl2(s)+2Cl-(aq)
 PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。
PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。(1)步骤Ⅰ中发现有淡黄色沉淀生成,请写出离子反应方程式:
(2)步骤Ⅰ原料预处理过程中写出一种除搅拌外加快反应速率的办法:
(3)操作①应为:
A、趁热过滤 B、蒸发浓缩,冷却结晶; C、蒸发结晶 D、重结晶
(4)写出步骤III中PbCl2生成PbSO4的离子反应方程式:
(5)铅蓄电池(Pb-PbO2-H2SO4)充电时的阳极反应方程式:
(6)某铅蓄电池放电时电流为0.2A,可持续放电时间96500s,此时参加反应的Pb的质量为41.4g,求该电池放电的能量转化率α=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】重晶石(BaSO4)是重要的化工原料,用重晶石制备氢氧化钡晶体[Ba(OH)2·8H2O]的流程如下:
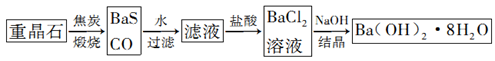
已知: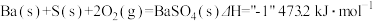
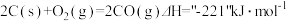
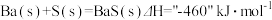
(1)写出煅烧时发生反应的热化学方程式:_______________ 。
(2)写出氢氧化钡晶体与氯化铵混合反应的化学方程式:__________________ 。
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PbCl2溶液中,出现黑色沉淀并产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:__________________ 。
(4)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3。发生的反应可表示为BaSO4(s)+ CO32-(aq) BaCO3(s)+ SO42- (aq)。现有0.20 mol BaSO4,加入1.0 L 2.0 mol·L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0,平衡时,平衡常数K=4.0×10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(不考虑溶液体积变化与离子水解,写出计算过程,结果保留2位有效数字)
BaCO3(s)+ SO42- (aq)。现有0.20 mol BaSO4,加入1.0 L 2.0 mol·L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0,平衡时,平衡常数K=4.0×10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(不考虑溶液体积变化与离子水解,写出计算过程,结果保留2位有效数字)
__________________
(5)试从平衡的角度解释BaSO4可转化为BaCO3的原因:_______________ 。

已知:
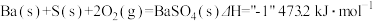
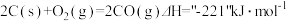
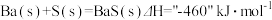
(1)写出煅烧时发生反应的热化学方程式:
(2)写出氢氧化钡晶体与氯化铵混合反应的化学方程式:
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PbCl2溶液中,出现黑色沉淀并产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:
(4)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3。发生的反应可表示为BaSO4(s)+ CO32-(aq)
 BaCO3(s)+ SO42- (aq)。现有0.20 mol BaSO4,加入1.0 L 2.0 mol·L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0,平衡时,平衡常数K=4.0×10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(不考虑溶液体积变化与离子水解,写出计算过程,结果保留2位有效数字)
BaCO3(s)+ SO42- (aq)。现有0.20 mol BaSO4,加入1.0 L 2.0 mol·L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0,平衡时,平衡常数K=4.0×10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(不考虑溶液体积变化与离子水解,写出计算过程,结果保留2位有效数字)(5)试从平衡的角度解释BaSO4可转化为BaCO3的原因:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】钛( )的性质稳定,有良好的耐高温、耐低温、抗酸碱、高强度、低密度等特性,其合金广泛应用于航天、军事、医学、化工等行业。工业上常用钛铁矿(主要含
)的性质稳定,有良好的耐高温、耐低温、抗酸碱、高强度、低密度等特性,其合金广泛应用于航天、军事、医学、化工等行业。工业上常用钛铁矿(主要含 和少量
和少量 、
、 等)冶炼获得金属钛,同时得到副产品
等)冶炼获得金属钛,同时得到副产品 。其工艺流程如图:
。其工艺流程如图:
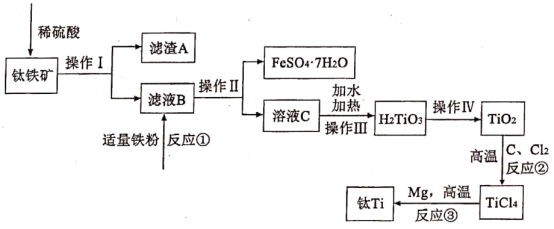
已知:① ;
;
② 不溶于水。
不溶于水。
(1)加稀硫酸进行酸溶时需将矿石粉碎,其目的是_______ (写一点即可)。
(2)写出反应①的离子方程式_______ ,检验溶液C中无 的方法是
的方法是_______ 。
(3)反应②除了生成 外,还生成了一种可燃性气体,请写出其化学反应方程式
外,还生成了一种可燃性气体,请写出其化学反应方程式_______ 。
(4)反应③是在1070K下并在氩气氛围中进行。要在氩气氛围中进行的原因是_______ 。
(5)操作Ⅰ、Ⅱ、Ⅲ、Ⅳ中完全相同的是_______ (填编号)。
 )的性质稳定,有良好的耐高温、耐低温、抗酸碱、高强度、低密度等特性,其合金广泛应用于航天、军事、医学、化工等行业。工业上常用钛铁矿(主要含
)的性质稳定,有良好的耐高温、耐低温、抗酸碱、高强度、低密度等特性,其合金广泛应用于航天、军事、医学、化工等行业。工业上常用钛铁矿(主要含 和少量
和少量 、
、 等)冶炼获得金属钛,同时得到副产品
等)冶炼获得金属钛,同时得到副产品 。其工艺流程如图:
。其工艺流程如图:
已知:①
 ;
;②
 不溶于水。
不溶于水。(1)加稀硫酸进行酸溶时需将矿石粉碎,其目的是
(2)写出反应①的离子方程式
 的方法是
的方法是(3)反应②除了生成
 外,还生成了一种可燃性气体,请写出其化学反应方程式
外,还生成了一种可燃性气体,请写出其化学反应方程式(4)反应③是在1070K下并在氩气氛围中进行。要在氩气氛围中进行的原因是
(5)操作Ⅰ、Ⅱ、Ⅲ、Ⅳ中完全相同的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.镁元素在自然界分布广泛,是人体的必需元素之一、目前,世界上金属镁的主要生产方法有以下两种:
方法1:皮江法:
反应①:CaCO3·MgCO3=CaO·MgO+2CO2
反应②:2CaO·MgO(s)+Si(s) 2CaO·SiO2 (l)+2Mg(g)
2CaO·SiO2 (l)+2Mg(g)
方法2:电解法
(1)工业上冶炼金属镁一般电解___________。
(2)根据上题选项,写出电解法冶炼金属镁的电极反应方程式:阳极反应___________ ;阴极反应___________ 。
Ⅱ.工业上以煅白(CaO·MgO,M = 96 g/mol)为原料与硅铁(硅含量固定)混合置于密闭还原炉,1200℃下发生反应②:
(3)平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将___________ (填“升高”“降低”或“不变”)。
Ⅲ.氢氧化镁是一种应用广泛的无机阻燃剂。一种利用卤水-氨水法制备氢氧化镁阻燃剂的工艺流程如下。

已知:①用EDTA滴定法测定金属离子的浓度的定量关系:n(金属离子)=n(EDTA);
②碳酸盐的溶度积常数:Ksp(CaCO3)=3.8×10-9、Ksp(MgCO3)=1.1×10-5。
沉钙前,需用EDTA滴定法测定粗制卤水中金属离子的浓度,结果如下表:
(4)滴定过程所需玻璃仪器有___________ 。
(5)粗制卤水中c(Mg2+)为___________ ,加入Na2CO3溶液“沉钙”时,溶液中c(CO )的范围为
)的范围为___________ 。
(6)沉淀时,温度对Mg2+的沉淀有较大影响,选择25℃作为适宜的反应温度的原因是___________ 。
方法1:皮江法:
反应①:CaCO3·MgCO3=CaO·MgO+2CO2
反应②:2CaO·MgO(s)+Si(s)
 2CaO·SiO2 (l)+2Mg(g)
2CaO·SiO2 (l)+2Mg(g)方法2:电解法
(1)工业上冶炼金属镁一般电解___________。
| A.MgO悬浊液 | B.熔融的MgO | C.熔融的MgCl2 | D.MgCl2溶液 |
(2)根据上题选项,写出电解法冶炼金属镁的电极反应方程式:阳极反应
Ⅱ.工业上以煅白(CaO·MgO,M = 96 g/mol)为原料与硅铁(硅含量固定)混合置于密闭还原炉,1200℃下发生反应②:
(3)平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将
Ⅲ.氢氧化镁是一种应用广泛的无机阻燃剂。一种利用卤水-氨水法制备氢氧化镁阻燃剂的工艺流程如下。

已知:①用EDTA滴定法测定金属离子的浓度的定量关系:n(金属离子)=n(EDTA);
②碳酸盐的溶度积常数:Ksp(CaCO3)=3.8×10-9、Ksp(MgCO3)=1.1×10-5。
沉钙前,需用EDTA滴定法测定粗制卤水中金属离子的浓度,结果如下表:
| 滴定序号 | 卤水样品用量/mL | 0.025mol/LEDTA用量/mL | |
| 滴定Ca2+、Mg2+ | 滴定Ca2+ | ||
| ① | 25.00 | 28.06 | 12.06 |
| ② | 25.00 | 28.70 | 12.53 |
| ③ | 25.00 | 28.74 | 12.91 |
(4)滴定过程所需玻璃仪器有
(5)粗制卤水中c(Mg2+)为
 )的范围为
)的范围为(6)沉淀时,温度对Mg2+的沉淀有较大影响,选择25℃作为适宜的反应温度的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】亚氯酸钠(NaClO2)是一种高效漂白剂,其有效氯含量相当于漂白粉的7倍。可用ClO2与过氧化氢为原料制取亚氯酸钠,相关实验装置如图所示。请回答:
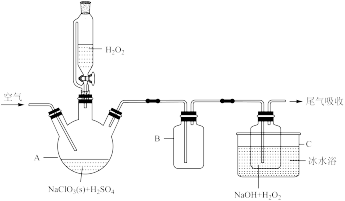
已知:
①2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O;
②2ClO2+2NaOH=NaClO2+NaClO3+H2O;
③已知NaClO2饱和溶液在温度低于38℃时析出NaClO2·3H2O晶体,高于38℃时析出NaClO2晶体,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)仪器B的作用是___________ 。
(2)写出装置C中制备NaClO2固体的化学方程式:___________ 。冰水浴冷却的目的是___________ (写两种)。
(3)在装置A中发生反应生成NaClO2,反应过程中放出大量的热。
①研究表明,实验时装置C中H2O2与NaOH的物料比需要控制在0.8左右,原因可能是___________ 。
②在吸收液中H2O2和NaOH的物料比、浓度和体积不变的条件下,控制反应在0~3℃进行,实验中可采取的措施是___________ 。
(4)尾气吸收时,一般用___________ 溶液吸收过量的ClO2。
(5)为了测定NaClO2粗品的纯度,取上述粗产品a g溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1 Na2S2O3标准液滴定,达到滴定终点时用去标准液V mL,试计算NaClO2粗品的纯度___________ (提示:2Na2S2O3+I2=Na2S4O6+2NaI)
(6)下列关于该实验及样品组成分析的说法,正确的是___________ (填字母)。
A.装置C中制得的NaClO2固体中可用略低于38℃的热水洗涤2~3遍
B.装置C中制得的NaClO2固体后的操作包括过滤、洗涤和干燥
C.如果撤去装置C中的冰水浴,可能导致产品中混有的杂质是NaClO3和NaCl
D.装置A中空气流速过快或过慢,均会增大NaClO2的产率

已知:
①2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O;
②2ClO2+2NaOH=NaClO2+NaClO3+H2O;
③已知NaClO2饱和溶液在温度低于38℃时析出NaClO2·3H2O晶体,高于38℃时析出NaClO2晶体,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)仪器B的作用是
(2)写出装置C中制备NaClO2固体的化学方程式:
(3)在装置A中发生反应生成NaClO2,反应过程中放出大量的热。
①研究表明,实验时装置C中H2O2与NaOH的物料比需要控制在0.8左右,原因可能是
②在吸收液中H2O2和NaOH的物料比、浓度和体积不变的条件下,控制反应在0~3℃进行,实验中可采取的措施是
(4)尾气吸收时,一般用
(5)为了测定NaClO2粗品的纯度,取上述粗产品a g溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1 Na2S2O3标准液滴定,达到滴定终点时用去标准液V mL,试计算NaClO2粗品的纯度
(6)下列关于该实验及样品组成分析的说法,正确的是
A.装置C中制得的NaClO2固体中可用略低于38℃的热水洗涤2~3遍
B.装置C中制得的NaClO2固体后的操作包括过滤、洗涤和干燥
C.如果撤去装置C中的冰水浴,可能导致产品中混有的杂质是NaClO3和NaCl
D.装置A中空气流速过快或过慢,均会增大NaClO2的产率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】滴定操作不仅适用于酸碱中和反应,还可应用于氧化还原反应的定量测定,实验室可用已知浓度的KMnO4,溶液滴定未知浓度的Na2C2O4溶液。
原理: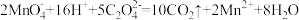 。
。
步骤:量取 未知浓度的
未知浓度的 溶液于锥形瓶中,用
溶液于锥形瓶中,用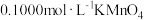 溶液进行滴定,数据记录如表:
溶液进行滴定,数据记录如表:
(1)滴定时,将 标准溶液注入
标准溶液注入_____ (填“酸式”或“碱式”)滴定管中。滴定到达终点的标志是______ 。
(2)第三次滴定终点读数如图所示,则:a=_____ 。结合表中数据计算待测溶液中 的物质的量浓度为
的物质的量浓度为_____ 。
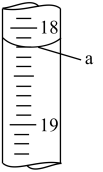
(3)以下操作会造成测得的 浓度偏高的是___________(填字母)。
浓度偏高的是___________(填字母)。
(4)已知 、
、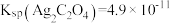 ,向
,向 、
、 浓度均为
浓度均为 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液,最先出现的沉淀是
溶液,最先出现的沉淀是_____ (填化学式)。
原理:
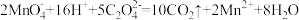 。
。步骤:量取
 未知浓度的
未知浓度的 溶液于锥形瓶中,用
溶液于锥形瓶中,用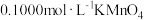 溶液进行滴定,数据记录如表:
溶液进行滴定,数据记录如表:| 滴定次数 |  溶液起始读数/ 溶液起始读数/ |  溶液终点读数/ 溶液终点读数/ |
| 第一次 | 1.02 | 19.03 |
| 第二次 | 2.00 | 19.99 |
| 第三次 | 0.20 | a |
 标准溶液注入
标准溶液注入(2)第三次滴定终点读数如图所示,则:a=
 的物质的量浓度为
的物质的量浓度为
(3)以下操作会造成测得的
 浓度偏高的是___________(填字母)。
浓度偏高的是___________(填字母)。| A.滴定终点读数时,俯视滴定管的刻度 |
| B.锥形瓶用蒸馏水洗后未用待测溶液润洗 |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
D.量取 溶液的滴定管用蒸馏水洗后未用标准液润洗 溶液的滴定管用蒸馏水洗后未用标准液润洗 |
 、
、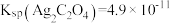 ,向
,向 、
、 浓度均为
浓度均为 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液,最先出现的沉淀是
溶液,最先出现的沉淀是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】纯碱在日常生活和工业生产中有着广泛的应用。化工专家侯德榜发明的“侯氏制碱法”为我国纯碱工业和国民经济发展做出了重要贡献。“侯氏制碱法”的反应原理是:
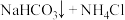 ,实验室先用下图装置模拟“侯氏制碱法”制备纯碱,然后再对纯碱样品进行含量测定和分离提纯。
,实验室先用下图装置模拟“侯氏制碱法”制备纯碱,然后再对纯碱样品进行含量测定和分离提纯。

请回答下列问题:
(1)在饱和食盐水中应该由先由_____ 管通_____ 、再由_____ 管通_____ 。
(2)将反应后溶液进行_____ ,得到纯碱样品。
(3)经过分析,纯碱样品中可能含有的杂质为NaCl,如何证明含有NaCl,请写出检验方法_____ 。
(4)为了测定纯碱样品中 的质量分数,设计如下实验方案:称取6.0g纯碱样品,加入足量稀盐酸,将产生的气体通入碱石灰中进行吸收,测得碱石灰的质量增加2.4g,进而计算碳酸钠的质量分数。请问该实验方案是否可行
的质量分数,设计如下实验方案:称取6.0g纯碱样品,加入足量稀盐酸,将产生的气体通入碱石灰中进行吸收,测得碱石灰的质量增加2.4g,进而计算碳酸钠的质量分数。请问该实验方案是否可行_____ (“可行”或“不可行”),若可行,请计算出碳酸钠的质量分数_____(保留小数点后一位)。如果不可行,请写出改进方案:_____ 。
(5)如图为NaCl、 在水中的溶解度曲线。请结合溶解度曲线,分析除去纯碱样品中的氯化钠杂质的具体操作为
在水中的溶解度曲线。请结合溶解度曲线,分析除去纯碱样品中的氯化钠杂质的具体操作为_____ 。


 ,实验室先用下图装置模拟“侯氏制碱法”制备纯碱,然后再对纯碱样品进行含量测定和分离提纯。
,实验室先用下图装置模拟“侯氏制碱法”制备纯碱,然后再对纯碱样品进行含量测定和分离提纯。
请回答下列问题:
(1)在饱和食盐水中应该由先由
(2)将反应后溶液进行
(3)经过分析,纯碱样品中可能含有的杂质为NaCl,如何证明含有NaCl,请写出检验方法
(4)为了测定纯碱样品中
 的质量分数,设计如下实验方案:称取6.0g纯碱样品,加入足量稀盐酸,将产生的气体通入碱石灰中进行吸收,测得碱石灰的质量增加2.4g,进而计算碳酸钠的质量分数。请问该实验方案是否可行
的质量分数,设计如下实验方案:称取6.0g纯碱样品,加入足量稀盐酸,将产生的气体通入碱石灰中进行吸收,测得碱石灰的质量增加2.4g,进而计算碳酸钠的质量分数。请问该实验方案是否可行(5)如图为NaCl、
 在水中的溶解度曲线。请结合溶解度曲线,分析除去纯碱样品中的氯化钠杂质的具体操作为
在水中的溶解度曲线。请结合溶解度曲线,分析除去纯碱样品中的氯化钠杂质的具体操作为
您最近一年使用:0次
【推荐2】无机盐A由4种常见的元素组成,为探究A的组成,设计并完成如下实验:
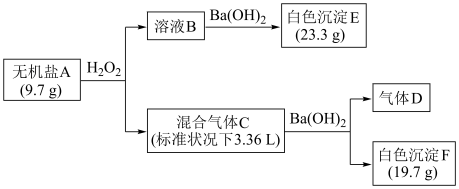
已知:D为单质,在标准状况下的密度为1.25 g/L;溶液B显酸性。
(1)混合气体C含两种气体,其中气体D的结构式为___________ ,另一种气体的电子式为___________ 。
(2)白色沉淀F可溶于盐酸,反应的离子方程式为___________ 。
(3)加入足量H2O2反应后,检验溶液B中主要阴离子的实验操作是___________ 。
(4)写出无机盐A所含的金属元素在周期表中的位置___________ 。
(5)写出A与H2O2反应的离子方程式___________ 。

已知:D为单质,在标准状况下的密度为1.25 g/L;溶液B显酸性。
(1)混合气体C含两种气体,其中气体D的结构式为
(2)白色沉淀F可溶于盐酸,反应的离子方程式为
(3)加入足量H2O2反应后,检验溶液B中主要阴离子的实验操作是
(4)写出无机盐A所含的金属元素在周期表中的位置
(5)写出A与H2O2反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某兴趣小组用如图所示装置(夹持装置略)收集某葡萄酒中的 ,并对其含量进行测定。
,并对其含量进行测定。
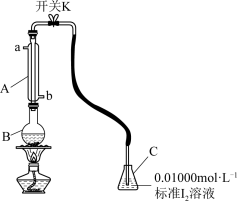
回答下列问题:
(1)实验开始前,首先应___________ ,方法是___________ 。
(2)仪器B的名称为_______ ,冷却水的进出方向为_______ (填“a进b出”或“b进a出”)。
(3)向仪器B中加入 葡萄酒和适量的稀硫酸,仪器C中加入
葡萄酒和适量的稀硫酸,仪器C中加入 标准
标准 溶液,加热使
溶液,加热使 全部进入仪器C中(不考虑气体逸出)。
全部进入仪器C中(不考虑气体逸出)。
①量取 标准
标准 溶液时,应选用
溶液时,应选用___________ (填标号)。
a.量筒b.酸式滴定管c.移液管
②仪器C中发生反应的离子方程式为___________ 。
③若仪器C中标准 溶液与
溶液与 恰好完全反应,则
恰好完全反应,则 的含量为
的含量为___________  。
。
 ,并对其含量进行测定。
,并对其含量进行测定。
回答下列问题:
(1)实验开始前,首先应
(2)仪器B的名称为
(3)向仪器B中加入
 葡萄酒和适量的稀硫酸,仪器C中加入
葡萄酒和适量的稀硫酸,仪器C中加入 标准
标准 溶液,加热使
溶液,加热使 全部进入仪器C中(不考虑气体逸出)。
全部进入仪器C中(不考虑气体逸出)。①量取
 标准
标准 溶液时,应选用
溶液时,应选用a.量筒b.酸式滴定管c.移液管
②仪器C中发生反应的离子方程式为
③若仪器C中标准
 溶液与
溶液与 恰好完全反应,则
恰好完全反应,则 的含量为
的含量为 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某小组同学研究影响双氧水分解反应速率的因素。实验所用试剂:10%H2O2、蒸馏水、MnO2粉末
(1)实验1、2的目的是研究________ 对双氧水分解反应速率的影响。
(2)通过对比实验_______ (填序号),可研究催化剂对双氧水分解反应速率的影响。
(3)为了准确地比较反应速率的快慢,观测的方法是:收集相同体积的气体,__________ 。
(4)利用上述实验试剂,并结合已有实验方案,进一步设计实验研究双氧水浓度对其分解反应速率的影响。请将实验方案补全。
| 实验序号 | H2O2浓度 | V(H2O2溶液) | 温度 | 催化剂 | 实验现象 |
1 | 10% | 20mL | 室温 | 无 | 无明显现象 |
2 | 10% | 20mL | 50℃水浴 | 无 | 有较多气泡产生 |
3 | 10% | 20mL | 室温 | MnO2(0.2g) | 有较多气泡产生 |
(1)实验1、2的目的是研究
(2)通过对比实验
(3)为了准确地比较反应速率的快慢,观测的方法是:收集相同体积的气体,
(4)利用上述实验试剂,并结合已有实验方案,进一步设计实验研究双氧水浓度对其分解反应速率的影响。请将实验方案补全。
| 实验序号 | H2O2浓度 | 实验现象 | ||||
4 | 10% | ① | ② | ③ | ④ | ⑤ |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】研究金属腐蚀和防护的原理很有现实意义。
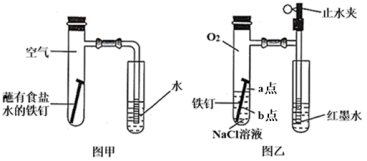
(1)图甲为探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置进行实验,发现导管中水柱上升缓慢,下列措施可以更快、更清晰地观察到水柱上升现象的有_______(填序号)。
(2)该小组将图甲装置改进成图乙装置并进行实验,导管中红墨水液柱高度随时间的变化如表所示,根据数据可判断腐蚀的速率随时间变化逐渐_______ (填“加快”“减慢”或“不变”),你认为影响钢铁腐蚀的因素为_______ 。
(3)为探究图乙中a、b两点所发生的反应,进行以下实验,请完成表中空白:
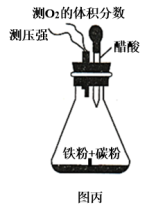
(4)设计图丙装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化如图丁所示,从图丁中可分析,t1~t2s之间主要发生_______ (填“吸氧”或“析氢”)腐蚀,原因是_______ 。
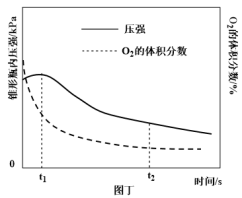
(5)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下,Fe钝化形成致密Fe3O4氧化膜,试写出该阳极的电极反应_______ 。

(1)图甲为探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置进行实验,发现导管中水柱上升缓慢,下列措施可以更快、更清晰地观察到水柱上升现象的有_______(填序号)。
| A.用纯氧气代替具支试管内空气 |
| B.用酒精灯加热具支试管提高温度 |
| C.将铁钉换成铁粉和碳粉混合粉末并加入少许食盐水 |
| D.将玻璃导管换成更细的导管,水中滴加红墨水 |
| 时间/min | 1 | 3 | 5 | 7 | 9 |
| 液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
| 实验操作 | 实验现象 | 实验结论 |
| 向NaCl溶液中滴加2~3滴酚酞溶液 | a点附近溶液出现红色 | a点电极反应为 |
| 一段时间后再滴加2~3滴铁氰化钾溶液 | b点周围出现蓝色沉淀 | b点电极反应为Fe-2e-=Fe2+ |


(5)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下,Fe钝化形成致密Fe3O4氧化膜,试写出该阳极的电极反应
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】Ⅰ:某化学兴趣小组为探究 的性质,按如图所示装置进行实验。(已知:
的性质,按如图所示装置进行实验。(已知: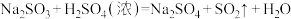 )
)
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是___________ 、___________ 。
(2)反应后,装置B中产生的现象是___________ ,发生反应的离子方程式为___________ 。
(3)装置C中的现象是___________ ,表现了 的
的___________ ,装置D中的现象是___________ ,发生反应的化学方程式为___________ 。
(4)F装置的作用是___________ ,倒扣漏斗的作用是___________ 。
Ⅱ:除了该方法制取 外也可以用铜与浓硫酸制备,用如图所示装置进行有关实验。将Cu片和浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的
外也可以用铜与浓硫酸制备,用如图所示装置进行有关实验。将Cu片和浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的 和Cu剩余。
和Cu剩余。
(5)写出Cu与浓硫酸反应的化学方程式:___________ 。
(6)烧瓶中有一定量的余酸,但未能使Cu完全溶解,你认为原因是___________ 。
(7)下列足量药品能够用来证明反应结束后的烧瓶中确有余酸的是___________(填字母)。
 的性质,按如图所示装置进行实验。(已知:
的性质,按如图所示装置进行实验。(已知: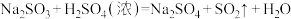 )
)
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是
(2)反应后,装置B中产生的现象是
(3)装置C中的现象是
 的
的(4)F装置的作用是
Ⅱ:除了该方法制取
 外也可以用铜与浓硫酸制备,用如图所示装置进行有关实验。将Cu片和浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的
外也可以用铜与浓硫酸制备,用如图所示装置进行有关实验。将Cu片和浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的 和Cu剩余。
和Cu剩余。
(5)写出Cu与浓硫酸反应的化学方程式:
(6)烧瓶中有一定量的余酸,但未能使Cu完全溶解,你认为原因是
(7)下列足量药品能够用来证明反应结束后的烧瓶中确有余酸的是___________(填字母)。
| A.Fe粉 | B. 溶液 溶液 | C.Ag | D. 溶液 溶液 |
您最近一年使用:0次



