钴及其化合物有重要的用途,研究其结构有重要意义。
(1)基态Co的价层电子排布式是3d74s2,轨道表示式是 。
。____ 在元素周期表中,该元素属于____ (填“d”或“ds”)区。
(2)[Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。
①该配合物的一种配体是NH3。NH3的空间结构呈____ 形,是_____ (填“极性”或“非极性”)分子。
②该配合物中Co3+参与杂化的6个能量相近的空轨道分别是2个3d、1个_____ 和3个____ 。
③设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。
实验如下:称取2.51g该配合物,先加水溶解,再加足量AgNO3溶液,____ (补全实验操作和数据)。
相对分子质量:[Co(NH3)5Cl]Cl2-250.5,AgCl-143.5。
(3)钴蓝可用于青花瓷的颜料。钴蓝晶体是由图1所示的结构平移构成。图1包含Ⅰ型和Ⅱ型两种小立方体。图2是钴蓝的晶胞。
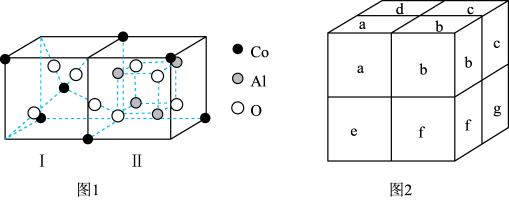
①图2中Ⅱ型小立方体分别是b、____ (填字母序号)。
②钴蓝晶体中三种原子个数比N(Co):N(Al):N(O)=____ 。
(1)基态Co的价层电子排布式是3d74s2,轨道表示式是
 。
。(2)[Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。
①该配合物的一种配体是NH3。NH3的空间结构呈
②该配合物中Co3+参与杂化的6个能量相近的空轨道分别是2个3d、1个
③设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。
实验如下:称取2.51g该配合物,先加水溶解,再加足量AgNO3溶液,
相对分子质量:[Co(NH3)5Cl]Cl2-250.5,AgCl-143.5。
(3)钴蓝可用于青花瓷的颜料。钴蓝晶体是由图1所示的结构平移构成。图1包含Ⅰ型和Ⅱ型两种小立方体。图2是钴蓝的晶胞。

①图2中Ⅱ型小立方体分别是b、
②钴蓝晶体中三种原子个数比N(Co):N(Al):N(O)=
2022·北京东城·一模 查看更多[5]
北京市东城区2022届高三一模化学试题(已下线)【奋进985】08-备战2022年高考化学名校进阶模拟卷(通用版)湖南省武冈市第一中学2021-2022学年高三下学期第三次模拟考试化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(广东专用)(已下线)化学-2022年高考押题预测卷03(北京卷)
更新时间:2022-04-09 13:51:51
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】钛、铬、铁、溴、铜等金属及其化合物在工业上有重要用途。
(1)制备CrO2Cl2的反应为:K2Cr2O2+3CCl4=2Kl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是__________ (用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为___________ ,中心原子的杂化方式为_____________ 。
(2)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO____________ FeO(填”<”、 “=”或 “>”)。
(3)Ni和La的合金晶细胞结构如图所示。
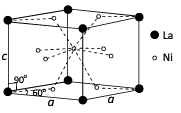
①该晶体的化学式为____________ 。
②已知该物质的摩尔质量M gmol-1,密度为d gcm-3.设Ni为阿伏加德罗常数 的值,则该晶胞的体积是____ cm3(用含M、d、Ni的代数式表示)。
(4)铜晶体中原子的堆积方式如右图所示。

①基态铜原子的电子排布式为________ 。
②每个铜原子周围距离最近的铜原子数目______________ 。
(5)某M原子的外围电子排布式为3S23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表M原子)。
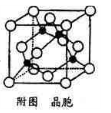
①该晶体的化学式为____________ 。
②已知铜和M电负性分别为1.9和3.0,则铜与M形成的化合物属于_____ (填“离子”或“共价”)化合物。
③已知该晶体的密度p gcm-3,阿伏加德罗常数的值为Na,则该晶体中铜原子与M原子之间的最短距离为_____ pm(只写计算式)。
(1)制备CrO2Cl2的反应为:K2Cr2O2+3CCl4=2Kl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(2)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO
(3)Ni和La的合金晶细胞结构如图所示。

①该晶体的化学式为
②已知该物质的摩尔质量M gmol-1,密度为d gcm-3.设Ni为阿伏加德罗常数 的值,则该晶胞的体积是
(4)铜晶体中原子的堆积方式如右图所示。

①基态铜原子的电子排布式为
②每个铜原子周围距离最近的铜原子数目
(5)某M原子的外围电子排布式为3S23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表M原子)。

①该晶体的化学式为
②已知铜和M电负性分别为1.9和3.0,则铜与M形成的化合物属于
③已知该晶体的密度p gcm-3,阿伏加德罗常数的值为Na,则该晶体中铜原子与M原子之间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】根据所学物质结构知识,回答下列问题
(1) LiCoO2、 LiFePO4常用作锂离子电池的正极材料。基态Co原子的外围电子排布式为______________________ 。第四电离能:Ⅰ4(Co)___________ I4(Fe)(填“>”或“<”)。PO43-的空间构型为______________________ 。
(2)B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图所示,则B原子的杂化方式为______________________ 。
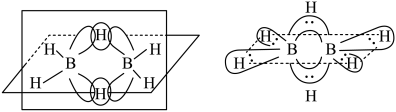
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,氨硼烷(NH3BH3)的结构式为______________________ (标出配位键),写出一种与氨硼烷互为等电子体的分子的化学式:______________________ 。
(3)常温常压下,硼酸(H3BO3)晶体结构为层状,其二维平面结构如图所示,1mol H3BO3晶体中含有氢键的数目为___________ (用NA表示阿伏伽德罗常数的值);请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:______________________ 。

(4)干冰晶体以及Cu晶体的结构都如图表示(○表示一个CO2分子或一个Cu原子),晶体中正八面体和正四面体空隙数的比值为___________ 。铜的硫化物有三种晶体,其中一种是Cu2+为面心立方最密堆积,而晶体中全部正四面体空隙的二分之一被S2-占据,如果两个最近的离子核间距为acm,NA表示阿伏伽德罗常数的值,则该晶体的密度为___________ g/cm3(用含a、NA的代数式表示)。

(1) LiCoO2、 LiFePO4常用作锂离子电池的正极材料。基态Co原子的外围电子排布式为
(2)B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图所示,则B原子的杂化方式为

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,氨硼烷(NH3BH3)的结构式为
(3)常温常压下,硼酸(H3BO3)晶体结构为层状,其二维平面结构如图所示,1mol H3BO3晶体中含有氢键的数目为

(4)干冰晶体以及Cu晶体的结构都如图表示(○表示一个CO2分子或一个Cu原子),晶体中正八面体和正四面体空隙数的比值为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】 晶体具有优良的光学特性,是当今光电转换领域的研究热点和太阳能电池吸收层的理想材料。回答下列问题:
晶体具有优良的光学特性,是当今光电转换领域的研究热点和太阳能电池吸收层的理想材料。回答下列问题:
(1)硒( )是人体内必需的微量元素之一。基态
)是人体内必需的微量元素之一。基态 原子的电子排布式为
原子的电子排布式为
_______ 。 、
、 和
和 的沸点由低到高的顺序为
的沸点由低到高的顺序为_______ ,(填化学式,下同),还原性由弱到强的顺序为_______ ,键角由小到大的顺序为_______ 。 分子存在角形和直线形两种异构体,其中直线形分子的键长较长,
分子存在角形和直线形两种异构体,其中直线形分子的键长较长,_______ 分子的能量较大。
(2)铟( )为ⅢA族元素,
)为ⅢA族元素,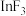 和
和 的熔点分别是1170℃和210℃,熔点差异的原因是
的熔点分别是1170℃和210℃,熔点差异的原因是_______ 。在乙醚中 和
和 反应生成
反应生成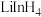 ,
,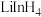 中阴离子的空间结构为
中阴离子的空间结构为_______ 。
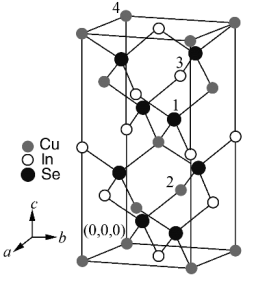
(3)四方晶系 的晶胞结构如图所示,晶胞参数为
的晶胞结构如图所示,晶胞参数为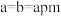 ,
,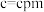 ,
,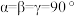 。设阿伏加德罗常数的值为
。设阿伏加德罗常数的值为 ,
, 的相对质量为M,则该晶体密度
的相对质量为M,则该晶体密度
_______  (用含有a、c、M和
(用含有a、c、M和 的代数式表示)。该晶胞中,原子坐标分别为1号
的代数式表示)。该晶胞中,原子坐标分别为1号 原子
原子_______ ,2号 原子
原子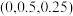 ,3号
,3号 原子
原子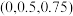 。晶体中有
。晶体中有_______ 个 原子距离4号
原子距离4号 原子最近。
原子最近。
 晶体具有优良的光学特性,是当今光电转换领域的研究热点和太阳能电池吸收层的理想材料。回答下列问题:
晶体具有优良的光学特性,是当今光电转换领域的研究热点和太阳能电池吸收层的理想材料。回答下列问题:(1)硒(
 )是人体内必需的微量元素之一。基态
)是人体内必需的微量元素之一。基态 原子的电子排布式为
原子的电子排布式为
 、
、 和
和 的沸点由低到高的顺序为
的沸点由低到高的顺序为 分子存在角形和直线形两种异构体,其中直线形分子的键长较长,
分子存在角形和直线形两种异构体,其中直线形分子的键长较长,(2)铟(
 )为ⅢA族元素,
)为ⅢA族元素,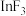 和
和 的熔点分别是1170℃和210℃,熔点差异的原因是
的熔点分别是1170℃和210℃,熔点差异的原因是 和
和 反应生成
反应生成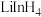 ,
,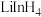 中阴离子的空间结构为
中阴离子的空间结构为(3)四方晶系
 的晶胞结构如图所示,晶胞参数为
的晶胞结构如图所示,晶胞参数为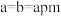 ,
,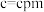 ,
,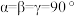 。设阿伏加德罗常数的值为
。设阿伏加德罗常数的值为 ,
, 的相对质量为M,则该晶体密度
的相对质量为M,则该晶体密度
 (用含有a、c、M和
(用含有a、c、M和 的代数式表示)。该晶胞中,原子坐标分别为1号
的代数式表示)。该晶胞中,原子坐标分别为1号 原子
原子 原子
原子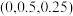 ,3号
,3号 原子
原子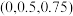 。晶体中有
。晶体中有 原子距离4号
原子距离4号 原子最近。
原子最近。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】X、Y、Z、W、R、Q六种前四周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,W元素的焰色试验呈黄色,R的最外层电子数与其电子总数之比为3:8,X能与W形成离子化合物且W+的半径大于X-的半径,Y的氧化物是形成酸雨的物质之一,Q原子p能级轨道上有三个单电子。请回答下列问题:
(1)Q元素在周期表中的位置为_________ ,QX3分子的空间构型为___________ 。
(2) 、
、 、W、R这四种元素简单离子的半径从大到小的顺序是
、W、R这四种元素简单离子的半径从大到小的顺序是______________  用离子符号表示
用离子符号表示 。
。
(3)M和N均为上述六种元素中的三种组成的化合物,且M和N都为强电解质,M和N溶液反应既有沉淀出现又有气体产生,写出M和N反应的化学方程式:_______________________ 。
(4)基态Q原子的简化电子排布式为___________ ,单质Q的气态分子构型如图所示,在其中4条棱上各插入1个R原子,形成Q4R4,俗称雄黄,则雄黄可能有_______ 种不同的结构,0.5molQ4R4中含有_______ molQ-R键。
(1)Q元素在周期表中的位置为
(2)
 、
、 、W、R这四种元素简单离子的半径从大到小的顺序是
、W、R这四种元素简单离子的半径从大到小的顺序是 用离子符号表示
用离子符号表示 。
。(3)M和N均为上述六种元素中的三种组成的化合物,且M和N都为强电解质,M和N溶液反应既有沉淀出现又有气体产生,写出M和N反应的化学方程式:
(4)基态Q原子的简化电子排布式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】Ⅰ、镍及其化合物是重要的合金材料和催化剂。
(1)基态镍原子的价电子排布式为___________ ,能量最高的电子所占能级的原子轨道有___________ 个伸展方向。
(2)镍能形成多种配合物,如正四面体形的Ni(CO)4和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有___________(填标号)。
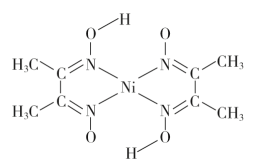
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“→”和“…”分别表示出配位键和氢键。
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如表所示。
NiO晶胞中Ni2+的配位数为___________ ,NiO的熔点比NaCl高的原因是___________ 。
Ⅱ、利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其立方晶胞的结构如图所示。
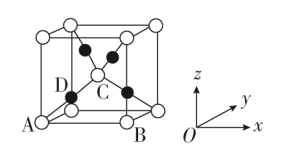
(5)该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为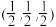 。则D原子的坐标参数为
。则D原子的坐标参数为___________ ,它代表___________ (填元素符号)原子。
(6)若Cu2O晶体密度为dg·cm-3,晶胞参数为apm,则阿伏加德罗常数的值NA=___________ 。
(1)基态镍原子的价电子排布式为
(2)镍能形成多种配合物,如正四面体形的Ni(CO)4和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有___________(填标号)。
| A.CO分子内σ键和π键的数目之比为1∶2 |
| B.NH3的空间结构为平面三角形 |
| C.Ni2+在形成配合物时,其配位数只能为4 |
| D.Ni(CO)4和[Ni(CN)4]2-中,Ni均采取sp3杂化 |

(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如表所示。
| Na+ | 102pm | Cl- | 181pm |
| Ni2+ | 69pm | O2- | 140pm |
Ⅱ、利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其立方晶胞的结构如图所示。

(5)该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为
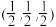 。则D原子的坐标参数为
。则D原子的坐标参数为(6)若Cu2O晶体密度为dg·cm-3,晶胞参数为apm,则阿伏加德罗常数的值NA=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】2022北京冬奥会普通纪念币使用材料是黄铜(铜锌合金),锌、铜及其化合物在生产生活中应用广泛。回答下列问题:
(1)基态Zn的价层电子排布式为_______ 。
(2)一种香豆素衍生物(CHP)可作为测定 的荧光探针,其原理如下图所示。
的荧光探针,其原理如下图所示。

①CHP所含元素(C、O、N)电负性从大到小的顺序为_______ 。
②CHP-Zn中N原子的杂化类型为_______ 。
(3)硫酸锌溶于足量氨水形成 溶液。
溶液。
① 中阴离子的立体构型是
中阴离子的立体构型是_______ 。
②锌的氨合离子 中存在的化学键有
中存在的化学键有_______ (填标号)。
A.离子键 B.极性键 C.配位键 D.氢键 E.σ键 F.π键
③氢氧化锌溶于氨水的离子方程式为_______ 。
(4)铜的第一电离能为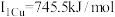 ,第二电离能为
,第二电离能为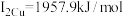 ,锌的第一电离能为
,锌的第一电离能为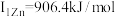 ,第二电离能为
,第二电离能为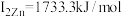 ,
,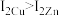 的原因是
的原因是_______ 。
(5)锌黄锡矿(K型)是制备薄膜太阳能电池的重要原料,其晶胞结构如图所示(每个棱夹角均为90°)。

①该晶体的化学式为_______ 。
②密度
_______ 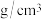 (用含有a、NA的代数式表示)。
(用含有a、NA的代数式表示)。
(1)基态Zn的价层电子排布式为
(2)一种香豆素衍生物(CHP)可作为测定
 的荧光探针,其原理如下图所示。
的荧光探针,其原理如下图所示。
①CHP所含元素(C、O、N)电负性从大到小的顺序为
②CHP-Zn中N原子的杂化类型为
(3)硫酸锌溶于足量氨水形成
 溶液。
溶液。①
 中阴离子的立体构型是
中阴离子的立体构型是②锌的氨合离子
 中存在的化学键有
中存在的化学键有A.离子键 B.极性键 C.配位键 D.氢键 E.σ键 F.π键
③氢氧化锌溶于氨水的离子方程式为
(4)铜的第一电离能为
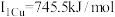 ,第二电离能为
,第二电离能为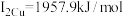 ,锌的第一电离能为
,锌的第一电离能为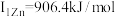 ,第二电离能为
,第二电离能为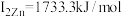 ,
,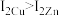 的原因是
的原因是(5)锌黄锡矿(K型)是制备薄膜太阳能电池的重要原料,其晶胞结构如图所示(每个棱夹角均为90°)。

①该晶体的化学式为
②密度

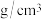 (用含有a、NA的代数式表示)。
(用含有a、NA的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)铟与镓同是ⅢA族元素,写出铟基态原子的电子排布式:_________ 。
(2)硒为第4周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为____ 。(用元素符号表示)
(3)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。某化合物Y与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图甲所示的离子。该离子中含有化学键的类型有__ (填序号);向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的晶胞结构如图乙所示。写出该反应的离子方程式:__________ 。
A.极性键 B.离子键 C.非极性键 D.配位键

(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、磷化镓及铜铟硒薄膜电池等。其中元素P、As、Se第一电离能由小到大的顺序为:______ 。
(5)已知由砷与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构与金刚石相似,其晶胞结构如图所示,请写出化合物A的化学式____ ;化合物A可由(CH3)3Ga和AsH3在700 ℃下反应制得,反应的化学方程式为______________ 。设化合物A的晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为____ g(用NA表示阿伏伽德罗常数的值)。

(1)铟与镓同是ⅢA族元素,写出铟基态原子的电子排布式:
(2)硒为第4周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为
(3)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。某化合物Y与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图甲所示的离子。该离子中含有化学键的类型有
A.极性键 B.离子键 C.非极性键 D.配位键

(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、磷化镓及铜铟硒薄膜电池等。其中元素P、As、Se第一电离能由小到大的顺序为:
(5)已知由砷与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构与金刚石相似,其晶胞结构如图所示,请写出化合物A的化学式

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
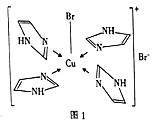
【推荐2】铁和碘、氮的相关化合物在化工、材料等领域有着广泛的应用。回答下列问题:
(1)基态Fe原子中,核外未成对电子数为________ 个,铁的第三电离能I3(Fe)比锰的第三电高能I3(Mn)小其原因是__________________________________________________ 。
(2)NaNO2可用作肉类食品的发色剂,阴离子NO2-的几何构型为_________ ,中心原子的杂化轨道类型为_________ 。
(3)Cu2+的一种配合物的分子结构如图1所示,配位原子为________ ,配体 分子中σ键总数为
分子中σ键总数为________ 个,分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为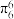 ),则
),则 中的大π键应表示为
中的大π键应表示为________________ 。
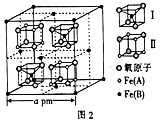
(4)一种铁的氧化物由不同价态的铁原子[Fe(A)和Fe(B)]与氧原子构成,其晶胞内部有图示Ⅰ、Ⅱ两种结构,晶胞的部分结构如图2。
①该铁的氧化物的化学式为_________ ,其熔点为1594.5 ℃,则它属于_________ (填“原子”“离子”或“分子”)晶体。
②该晶胞边长为a pm,则其密度为____________________ g·cm-3(列出表达式即可)。
(1)基态Fe原子中,核外未成对电子数为
(2)NaNO2可用作肉类食品的发色剂,阴离子NO2-的几何构型为
(3)Cu2+的一种配合物的分子结构如图1所示,配位原子为
 分子中σ键总数为
分子中σ键总数为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为

(4)一种铁的氧化物由不同价态的铁原子[Fe(A)和Fe(B)]与氧原子构成,其晶胞内部有图示Ⅰ、Ⅱ两种结构,晶胞的部分结构如图2。
①该铁的氧化物的化学式为
②该晶胞边长为a pm,则其密度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】铝和硅在地壳中含量丰富,其单质和化合物具有广泛的应用价值。请回答下列问题:
(1)①基态Si原子的价电子排布式为___________ 。
②写出一种与SiCl4互为等电子体的离子的化学式___________ 。
(2)AlCl3的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物(Al2Cl6),结构如图所示:
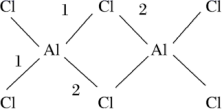
①二聚物中Al原子的杂化轨道类型为___________ 。
②从键的形成角度分析1键和2键的区别:___________ 。
(3)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇。
CH3COOH CH3CH2OH
CH3CH2OH
①AlH 的VSEPR模型名称是
的VSEPR模型名称是___________ 。
②CH3COOH分子中π键和σ键的数目之比为___________
(4)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如图所示:

晶胞中Al的配位数是___________ ,若该晶胞的边长为a pm,则该晶体的密度为___________ g·cm-3.(用NA表示阿伏加德罗常数的值) 相对分子质量 Al-27 N-14
(1)①基态Si原子的价电子排布式为
②写出一种与SiCl4互为等电子体的离子的化学式
(2)AlCl3的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物(Al2Cl6),结构如图所示:

①二聚物中Al原子的杂化轨道类型为
②从键的形成角度分析1键和2键的区别:
(3)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇。
CH3COOH
 CH3CH2OH
CH3CH2OH①AlH
 的VSEPR模型名称是
的VSEPR模型名称是②CH3COOH分子中π键和σ键的数目之比为
(4)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如图所示:

晶胞中Al的配位数是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】云阳龙缸云端廊桥曾被詟为“世界第一悬挑玻璃景观廊桥”,所用钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制.
(1)基态硫原子价层电子的轨道表达式(电子排布图)为____________ ,基态镍原子中核外电子占据最高能层的符号为_____________ .
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___________ 晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为___________ ,写出与配体互为等电子体的阴离子__________________________________________________________ (任写一种).
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式)______ ,理由是_______________________________________________________________ .
(4)H2S的键角__________ (填“大于”“小于””等于”)H2O的键角,请从电负性的角度说明理由___________________________________________________ .
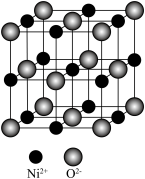
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙__________ 中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为________ g/cm3(只列出计算式).
(1)基态硫原子价层电子的轨道表达式(电子排布图)为
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式)
(4)H2S的键角
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】科学家发现铂金按一定比例混合可以获得迄今为止最强的合金。该合金的耐磨性比高强度钢高100倍,可用于制造新型发电系统,发动机和其他设备。已知金为第六周期元素,与铜均属ⅠB族。回答下列问题:
(1)基态Au原子中,核外电子占据的最低能层符号是_________ ,其价电子层的电子排布式为___________ ,简要说明Au熔点低于Cu熔点的原因__________ 。
(2)金、氯两种元素的电负性如下表。AuCl属于_________ (填“共价”或“离子”)化合物。
(3)Au易溶于王水的原因是形成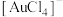 。
。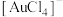 的配位数是
的配位数是____ ,该离子的结构式为____ 。
(4)用 作催化剂可完成甲醇脱氢,最优路径为
作催化剂可完成甲醇脱氢,最优路径为 。等物质的量的甲醇与一氧化碳中
。等物质的量的甲醇与一氧化碳中 键的数目比为
键的数目比为_____________ 。
(5)利用X—射线衍射法发现金(Au)晶体的晶胞如图所示。该晶体的密度为 ,晶胞的边长为apm,则阿伏加 德罗常数为
,晶胞的边长为apm,则阿伏加 德罗常数为_______________ (用含 的代数式表示)
的代数式表示) 。
。

(1)基态Au原子中,核外电子占据的最低能层符号是
(2)金、氯两种元素的电负性如下表。AuCl属于
| 元素 | Au | Cl |
| 电负性 | 2.54 | 3.2 |
(3)Au易溶于王水的原因是形成
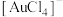 。
。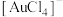 的配位数是
的配位数是(4)用
 作催化剂可完成甲醇脱氢,最优路径为
作催化剂可完成甲醇脱氢,最优路径为 。等物质的量的甲醇与一氧化碳中
。等物质的量的甲醇与一氧化碳中 键的数目比为
键的数目比为(5)利用X—射线衍射法发现金(Au)晶体的晶胞如图所示。该晶体的密度为
 ,晶胞的边长为apm,则阿伏加 德罗常数为
,晶胞的边长为apm,则阿伏加 德罗常数为 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】2020年12月17日,“嫦娥五号”首次成功实现地外天体采样返回,标志着我国航天向前迈出了一大步。其制作材料中包含了Al、Cr、Cu、C、N、O、Si等多种元素。回答下列问题:
(1)上述元素中基态原子未成对电子数与Al相同的有_______ 。
(2)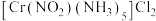 中
中 的配位数为
的配位数为_______ 。配位体原子给出电子能力越强,则配位体与中心离子形成的配位键越强,配合物越稳定, 作为配体时提供孤电子对的原子是
作为配体时提供孤电子对的原子是_______ 。粒子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 的大π键可表示为
的大π键可表示为_______ 。
(3)氮化铝晶体是第三代半导体材料的典型代表之一,属于六方晶系,结构如图a所示,其晶体类型为_______ ,其晶胞结构如图b所示。Al原子位于氮原子形成的_______ 空隙(填“四面体”或“八面体”)。图c是晶胞的俯视图,已知P点的分数坐标为 ,则晶胞内Al原子在图c中的分数坐标是
,则晶胞内Al原子在图c中的分数坐标是_______ 。

(4)已知晶胞的密度为 ,两种原子半径分别为
,两种原子半径分别为 nm和
nm和 nm,阿伏加德罗常数值为
nm,阿伏加德罗常数值为 ,则该晶胞中原子的体积占晶胞体积的百分率为
,则该晶胞中原子的体积占晶胞体积的百分率为_______ (列出表达式)。
(1)上述元素中基态原子未成对电子数与Al相同的有
(2)
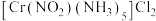 中
中 的配位数为
的配位数为 作为配体时提供孤电子对的原子是
作为配体时提供孤电子对的原子是 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 的大π键可表示为
的大π键可表示为(3)氮化铝晶体是第三代半导体材料的典型代表之一,属于六方晶系,结构如图a所示,其晶体类型为
 ,则晶胞内Al原子在图c中的分数坐标是
,则晶胞内Al原子在图c中的分数坐标是
(4)已知晶胞的密度为
 ,两种原子半径分别为
,两种原子半径分别为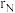 nm和
nm和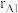 nm,阿伏加德罗常数值为
nm,阿伏加德罗常数值为 ,则该晶胞中原子的体积占晶胞体积的百分率为
,则该晶胞中原子的体积占晶胞体积的百分率为
您最近一年使用:0次



