钒、钨、锌在工业上用途广泛。
(1)基态钒(V)元素在周期表中的位置为_______ ,其最高化合价为_______ ,与其同周期且未成对电子数相同的元素符号为_______ ;
(2)钒能形成多种配合物。钒的两种配合物X、Y化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来),所用试剂及所得现象如表所示:
则X的配离子为_______ ,Y的配体为_______ 。
(3)NaxWO3是一类色彩丰富的非整比化合物,其晶体结构如图2所示,若Na+无空缺,化学式为NaWO3,完全空缺则为WO3,每填入1个Na+,相应有1个W6+还原为W5+。NaxWO3的颜色与x值的对应关系如图1所示,已知NaxWO3晶体中n(W6+):n(W5+)=2:3,则其颜色为_______ 色。

(4)如图3是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。其中心的原子位于立方体的体心。实验测得金属钨的半径为rcm,假定金属钨为等直径的刚性球,请回答以下各题:

①每一个晶胞中分摊到_______ 个钨原子。
②计算晶胞的空间利用率_______ (写出表达式,不计算具体数值)。
(1)基态钒(V)元素在周期表中的位置为
(2)钒能形成多种配合物。钒的两种配合物X、Y化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来),所用试剂及所得现象如表所示:
| 原溶液 | X溶液 | X溶液 | Y溶液 | Y溶液 |
| 所加试剂 | BaCl2溶液 | AgNO3溶液 | BaCl2溶液 | AgNO3溶液 |
| 现象 | 白色沉淀 | 无明显变化 | 无明显变化 | 白色沉淀 |
则X的配离子为
(3)NaxWO3是一类色彩丰富的非整比化合物,其晶体结构如图2所示,若Na+无空缺,化学式为NaWO3,完全空缺则为WO3,每填入1个Na+,相应有1个W6+还原为W5+。NaxWO3的颜色与x值的对应关系如图1所示,已知NaxWO3晶体中n(W6+):n(W5+)=2:3,则其颜色为

(4)如图3是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。其中心的原子位于立方体的体心。实验测得金属钨的半径为rcm,假定金属钨为等直径的刚性球,请回答以下各题:

①每一个晶胞中分摊到
②计算晶胞的空间利用率
更新时间:2022-04-03 22:52:34
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
【推荐1】元素 、
、 、
、 、
、 、
、 、
、 均为原子序数小于18的常见元素,且原子序数依次增大。已知
均为原子序数小于18的常见元素,且原子序数依次增大。已知 原子最外层电子数与核外电子总数之比为
原子最外层电子数与核外电子总数之比为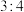 ,
, 原子的最外层电子数与次外层电子数之比为
原子的最外层电子数与次外层电子数之比为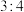 ;
; 比
比 的原子序数小1;
的原子序数小1; 与
与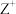 的电子层结构相同;化合物
的电子层结构相同;化合物 在常温下为气体。请回答下列问题:
在常温下为气体。请回答下列问题:
(1)写出 的简单离子的结构示意图:
的简单离子的结构示意图:______ 。
(2)由 、
、 、
、 三种元素形成的盐的化学式为
三种元素形成的盐的化学式为____________ 。
(3) 与
与 可形成2种分子,分别为10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:
可形成2种分子,分别为10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:____________ 。
(4)写出 的单质的一种工业用途:
的单质的一种工业用途:____________ 。
(5)如图表示由上述元素中的某两种元素组成的气体分子在密闭容器中,一定条件下充分反应前后的转化关系,该转化过程的化学方程式为____________ 。

(6) 是由
是由 、
、 、
、 、
、 四种元素组成的一种化合物,已知
四种元素组成的一种化合物,已知 既能与盐酸反应,又能与
既能与盐酸反应,又能与 溶液反应,还能和氯水反应,写出
溶液反应,还能和氯水反应,写出 与氯水反应的离子方程式:
与氯水反应的离子方程式:__________________ 。
 、
、 、
、 、
、 、
、 、
、 均为原子序数小于18的常见元素,且原子序数依次增大。已知
均为原子序数小于18的常见元素,且原子序数依次增大。已知 原子最外层电子数与核外电子总数之比为
原子最外层电子数与核外电子总数之比为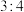 ,
, 原子的最外层电子数与次外层电子数之比为
原子的最外层电子数与次外层电子数之比为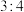 ;
; 比
比 的原子序数小1;
的原子序数小1; 与
与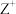 的电子层结构相同;化合物
的电子层结构相同;化合物 在常温下为气体。请回答下列问题:
在常温下为气体。请回答下列问题:(1)写出
 的简单离子的结构示意图:
的简单离子的结构示意图:(2)由
 、
、 、
、 三种元素形成的盐的化学式为
三种元素形成的盐的化学式为(3)
 与
与 可形成2种分子,分别为10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:
可形成2种分子,分别为10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:(4)写出
 的单质的一种工业用途:
的单质的一种工业用途:(5)如图表示由上述元素中的某两种元素组成的气体分子在密闭容器中,一定条件下充分反应前后的转化关系,该转化过程的化学方程式为

(6)
 是由
是由 、
、 、
、 、
、 四种元素组成的一种化合物,已知
四种元素组成的一种化合物,已知 既能与盐酸反应,又能与
既能与盐酸反应,又能与 溶液反应,还能和氯水反应,写出
溶液反应,还能和氯水反应,写出 与氯水反应的离子方程式:
与氯水反应的离子方程式:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】我国部分城市灰霾天比较多,引起灰霾的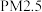 微细粒子包含
微细粒子包含 、
、 、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量可知,目前造成我国灰霾天气的主要原因是交通污染。
、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量可知,目前造成我国灰霾天气的主要原因是交通污染。
(1)基态Zn2+的核外电子排布式为___________ 。
(2) 的空间结构是
的空间结构是___________ 。
(3)灰霾中含有大量有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有 、
、 、
、 、HCOOH、
、HCOOH、 等二次污染物。
等二次污染物。
①下列说法正确的是___________ (填序号)。
A. 分子在四氯化碳里的溶解度高于在水中的溶解度
分子在四氯化碳里的溶解度高于在水中的溶解度
B. 分子中碳原子均采取
分子中碳原子均采取 杂化
杂化
C.相同压强下,HCOOH的沸点比 的低
的低
② 中含
中含 键的数目为
键的数目为___________ (设 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(4)水分子的VSEPR模型是___________ ,空间结构为___________ 。
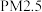 微细粒子包含
微细粒子包含 、
、 、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量可知,目前造成我国灰霾天气的主要原因是交通污染。
、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量可知,目前造成我国灰霾天气的主要原因是交通污染。(1)基态Zn2+的核外电子排布式为
(2)
 的空间结构是
的空间结构是(3)灰霾中含有大量有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有
 、
、 、
、 、HCOOH、
、HCOOH、 等二次污染物。
等二次污染物。①下列说法正确的是
A.
 分子在四氯化碳里的溶解度高于在水中的溶解度
分子在四氯化碳里的溶解度高于在水中的溶解度B.
 分子中碳原子均采取
分子中碳原子均采取 杂化
杂化C.相同压强下,HCOOH的沸点比
 的低
的低②
 中含
中含 键的数目为
键的数目为 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(4)水分子的VSEPR模型是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】雷氏盐是一种铬的配合物(结构简式如图1),常用作分析试剂,制备反应为 (雷氏盐)
(雷氏盐) 。回答下列相关问题:
。回答下列相关问题:

(1) 的核外电子排布式为
的核外电子排布式为______ ;其基态原子核外电子的空间运动状态有______ 种;氟和氯处于同一主族, 的熔点为1100℃,
的熔点为1100℃, 的熔点为83℃,前者比后者高得多,是因为
的熔点为83℃,前者比后者高得多,是因为______ 。
(2)雷氏盐中与铬形成配位键的原子是______ ;中心原子的配位数为______ 。
(3) 中氮原子的杂化方式为
中氮原子的杂化方式为______ ,其立体构型的名称为______ 。
(4) 所含元素中电负性最小的是
所含元素中电负性最小的是______ (填元素符号,下同),它们的基态原子的第一电离能最大的是______ 。
(5)金属铬的晶胞结构如图2所示,设晶胞边长为 ,则铬的原子半径为
,则铬的原子半径为______  。
。
 (雷氏盐)
(雷氏盐) 。回答下列相关问题:
。回答下列相关问题:
(1)
 的核外电子排布式为
的核外电子排布式为 的熔点为1100℃,
的熔点为1100℃, 的熔点为83℃,前者比后者高得多,是因为
的熔点为83℃,前者比后者高得多,是因为(2)雷氏盐中与铬形成配位键的原子是
(3)
 中氮原子的杂化方式为
中氮原子的杂化方式为(4)
 所含元素中电负性最小的是
所含元素中电负性最小的是(5)金属铬的晶胞结构如图2所示,设晶胞边长为
 ,则铬的原子半径为
,则铬的原子半径为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】黄铜矿(主要成分为 )是一种天然矿石。中国在商代或更早就掌握了由它冶炼铜的技术。医药上,黄铜矿有促进骨折愈合的作用。请回答下列问题:
)是一种天然矿石。中国在商代或更早就掌握了由它冶炼铜的技术。医药上,黄铜矿有促进骨折愈合的作用。请回答下列问题:
(1) 的空间结构为
的空间结构为_______ ,其中S原子的杂化方式为_______ 。
(2)基态 比
比 稳定的原因是
稳定的原因是_______ 。
(3)图1为某阳离子的结构,加热时该离子先失去的配位体是_______ (填化学式),加热后生成的配阳离子的颜色为_______ 色。

(4)图1中各元素电负性数值从小到大的顺序为_______ ,N和O元素第一电离能数值从小到大的顺序为_______ 。
(5)图2为金刚石的晶胞,其中碳原子的配位数为_______ 。

 )是一种天然矿石。中国在商代或更早就掌握了由它冶炼铜的技术。医药上,黄铜矿有促进骨折愈合的作用。请回答下列问题:
)是一种天然矿石。中国在商代或更早就掌握了由它冶炼铜的技术。医药上,黄铜矿有促进骨折愈合的作用。请回答下列问题:(1)
 的空间结构为
的空间结构为(2)基态
 比
比 稳定的原因是
稳定的原因是(3)图1为某阳离子的结构,加热时该离子先失去的配位体是

(4)图1中各元素电负性数值从小到大的顺序为
(5)图2为金刚石的晶胞,其中碳原子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】中国科学院从Z-烯丙基底物出发,首次实现了铱催化Z式保留不对称烯丙基的取代反应。已知 与
与 同族,回答下列问题:
同族,回答下列问题:
(1)基态钴原子的价电子排布式为________ 。
(2)铱( )的化合物中常见价态有
)的化合物中常见价态有 和
和 价,其中
价,其中 价更稳定,原因是
价更稳定,原因是________ 。
(3) 是高强度曝光的增敏剂,用于激光照相材料,其阴离子
是高强度曝光的增敏剂,用于激光照相材料,其阴离子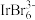 中
中 的价层电子对数为6,该离子的空间结构为
的价层电子对数为6,该离子的空间结构为_____ 。
(4)某种 的配合物阳离子,其结构如图所示。该离子中
的配合物阳离子,其结构如图所示。该离子中 原子的配位数是
原子的配位数是_______ 。

(5)原子分数坐标可用于表示晶胞内部各原子的相对位置。化合物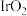 的四方晶格结构如下图所示,晶胞棱边夹角均为
的四方晶格结构如下图所示,晶胞棱边夹角均为 ,晶胞中部分原子的分数坐标如下表所示。
,晶胞中部分原子的分数坐标如下表所示。

其他 原子分数坐标为
原子分数坐标为_______ ,晶体中与 最近的O有
最近的O有______ 个。已知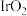 的晶胞参数为
的晶胞参数为 、
、 、
、 ,晶体密度为
,晶体密度为 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则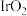 的摩尔质量为
的摩尔质量为_______ (用代数式表示) 。
。
 与
与 同族,回答下列问题:
同族,回答下列问题:(1)基态钴原子的价电子排布式为
(2)铱(
 )的化合物中常见价态有
)的化合物中常见价态有 和
和 价,其中
价,其中 价更稳定,原因是
价更稳定,原因是(3)
 是高强度曝光的增敏剂,用于激光照相材料,其阴离子
是高强度曝光的增敏剂,用于激光照相材料,其阴离子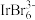 中
中 的价层电子对数为6,该离子的空间结构为
的价层电子对数为6,该离子的空间结构为(4)某种
 的配合物阳离子,其结构如图所示。该离子中
的配合物阳离子,其结构如图所示。该离子中 原子的配位数是
原子的配位数是
(5)原子分数坐标可用于表示晶胞内部各原子的相对位置。化合物
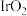 的四方晶格结构如下图所示,晶胞棱边夹角均为
的四方晶格结构如下图所示,晶胞棱边夹角均为 ,晶胞中部分原子的分数坐标如下表所示。
,晶胞中部分原子的分数坐标如下表所示。
| 坐标原子 | x | y | z |
 | 0 | 0 | 0 |
 | 0.25 | 0.25 | 0 |
其他
 原子分数坐标为
原子分数坐标为 最近的O有
最近的O有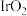 的晶胞参数为
的晶胞参数为 、
、 、
、 ,晶体密度为
,晶体密度为 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则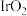 的摩尔质量为
的摩尔质量为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铜单质及其化合物在很多领域有重要的用途.
(一)如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
(1)超细铜粉的某制备方法如下:

 中所含的化学键有
中所含的化学键有 ______ .
(2)氯化亚铜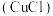 的制备过程是:向
的制备过程是:向 溶液中通入一定量
溶液中通入一定量 ,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为
,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
(二)波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知 的部分结构可表示如下:
的部分结构可表示如下:
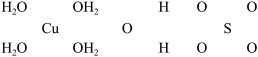
(1)写出铜原子价电子层的电子排布式______ ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有 ______  填元素符号
填元素符号 .
.
(2)请在上图中把 结构中的化学键用短线“--”表示出来.
结构中的化学键用短线“--”表示出来.______
(3)往浓 溶液中加入过量较浓的
溶液中加入过量较浓的 直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的
直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的 并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色
并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色 晶体.实验中所加
晶体.实验中所加 的作用是
的作用是 ______ .
(4) 晶体中呈正四面体的原子团是
晶体中呈正四面体的原子团是 ______ ,杂化轨道类型是 杂化的原子是
杂化的原子是 ______ .
(一)如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和
 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等. (1)超细铜粉的某制备方法如下:

 中所含的化学键有
中所含的化学键有 (2)氯化亚铜
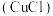 的制备过程是:向
的制备过程是:向 溶液中通入一定量
溶液中通入一定量 ,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为
,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 (二)波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知
 的部分结构可表示如下:
的部分结构可表示如下: 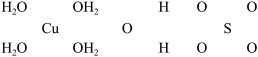
(1)写出铜原子价电子层的电子排布式
 填元素符号
填元素符号 .
.(2)请在上图中把
 结构中的化学键用短线“--”表示出来.
结构中的化学键用短线“--”表示出来.(3)往浓
 溶液中加入过量较浓的
溶液中加入过量较浓的 直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的
直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的 并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色
并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色 晶体.实验中所加
晶体.实验中所加 的作用是
的作用是 (4)
 晶体中呈正四面体的原子团是
晶体中呈正四面体的原子团是  杂化的原子是
杂化的原子是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】青蒿素(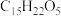 )是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
)是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。

(1)提取青蒿素
在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚(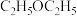 )提取,效果更好。乙醇的沸点高于乙醚,原因是
)提取,效果更好。乙醇的沸点高于乙醚,原因是_______ 。
(2)确定结构
①图中晶胞的棱长分别为 ,晶体的密度为
,晶体的密度为_______  。(用
。(用 表示阿伏加德罗常数,青蒿素的相对分子质量为282)
表示阿伏加德罗常数,青蒿素的相对分子质量为282)
②能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是_______ 。
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效
一定条件下,用 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。

①双氢青蒿素分子中碳原子的杂化轨道类型为_______ 。
② 的空间结构为
的空间结构为_______ 。
双氢青蒿素比青蒿素水溶性更好,治疗疟疾的效果更好。
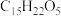 )是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
)是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
(1)提取青蒿素
在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚(
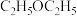 )提取,效果更好。乙醇的沸点高于乙醚,原因是
)提取,效果更好。乙醇的沸点高于乙醚,原因是(2)确定结构
①图中晶胞的棱长分别为
 ,晶体的密度为
,晶体的密度为 。(用
。(用 表示阿伏加德罗常数,青蒿素的相对分子质量为282)
表示阿伏加德罗常数,青蒿素的相对分子质量为282)②能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效
一定条件下,用
 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。
①双氢青蒿素分子中碳原子的杂化轨道类型为
②
 的空间结构为
的空间结构为双氢青蒿素比青蒿素水溶性更好,治疗疟疾的效果更好。
您最近一年使用:0次
【推荐2】氮化镓(GaN)是一种重要的半导体材料,用于制造高功率、高频率的电子器件。一种综合利用炼锌矿渣[主要含铁酸镓 、铁酸锌
、铁酸锌 、
、 ]制备GaN的工艺流程如图所示:
]制备GaN的工艺流程如图所示:
②常温下,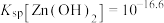 ,
,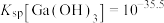 ,
, 。
。
③ 、
、 在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系如下表。
在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系如下表。
回答下列问题:
(1)基态Ga原子的价层电子排布式为___________ 。
(2)“酸浸”时 发生反应的离子方程式为
发生反应的离子方程式为___________ 。“酸溶”所得滤渣的主要成分是___________ (填化学式)。
(3)“酸浸”所得浸出液中 、
、 浓度分别为0.21 g⋅L
浓度分别为0.21 g⋅L 、6.5 g⋅L
、6.5 g⋅L 。常温下,为尽可能多地提取
。常温下,为尽可能多地提取 并确保不混入
并确保不混入 ,用CaO“调pH”时须不大于
,用CaO“调pH”时须不大于___________ (假设调pH时溶液体积不变)。
(4)“反萃取”时,所用盐酸的浓度
___________ mol/L(选填上表中盐酸的浓度)。
(5)“沉镓”时,若加入NaOH的量过多,会导致 的沉淀率降低,原因是
的沉淀率降低,原因是___________ (用离子方程式表示)。
(6)利用CVD(化学气相沉积)技术,将热分解得到的 与
与 在高温下反应可制得GaN,同时生成另一种产物,该产物的电子式为:
在高温下反应可制得GaN,同时生成另一种产物,该产物的电子式为:___________ 。
(7)GaN晶体的一种立方晶胞如图所示,该晶胞中镓原子的配位数为___________ 。若该晶胞边长为a pm,则该晶胞密度为___________ g/cm (列出计算式,NA为阿伏加德罗常数的值)。
(列出计算式,NA为阿伏加德罗常数的值)。
 、铁酸锌
、铁酸锌 、
、 ]制备GaN的工艺流程如图所示:
]制备GaN的工艺流程如图所示:
②常温下,
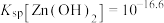 ,
,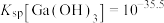 ,
, 。
。③
 、
、 在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系如下表。
在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系如下表。| 盐酸浓度/mol/L | 反萃取率/% | |
 |  | |
| 2.3 | 86.9 | 9.4 |
| 4.1 | 69.1 | 52.1 |
| 6.2 | 17.5 | 71.3 |
(1)基态Ga原子的价层电子排布式为
(2)“酸浸”时
 发生反应的离子方程式为
发生反应的离子方程式为(3)“酸浸”所得浸出液中
 、
、 浓度分别为0.21 g⋅L
浓度分别为0.21 g⋅L 、6.5 g⋅L
、6.5 g⋅L 。常温下,为尽可能多地提取
。常温下,为尽可能多地提取 并确保不混入
并确保不混入 ,用CaO“调pH”时须不大于
,用CaO“调pH”时须不大于(4)“反萃取”时,所用盐酸的浓度

(5)“沉镓”时,若加入NaOH的量过多,会导致
 的沉淀率降低,原因是
的沉淀率降低,原因是(6)利用CVD(化学气相沉积)技术,将热分解得到的
 与
与 在高温下反应可制得GaN,同时生成另一种产物,该产物的电子式为:
在高温下反应可制得GaN,同时生成另一种产物,该产物的电子式为:(7)GaN晶体的一种立方晶胞如图所示,该晶胞中镓原子的配位数为
 (列出计算式,NA为阿伏加德罗常数的值)。
(列出计算式,NA为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】三草酸合铁酸钾: 是制备铁触媒的主要原料,在光照下能分解:
是制备铁触媒的主要原料,在光照下能分解: 。回答下列问题:
。回答下列问题:
(1)基态Fe原子的价电子排布式为_______ 。
(2)三草酸合铁酸钾所含有的元素中,电负性最大的是_______ (填元素符号,下同),该元素所在的周期中,第一电离能比它大的所有元素为_______ 。
(3) 分子中σ键和π键的个数比为
分子中σ键和π键的个数比为_______ ,C原子的杂化方式为_______ 。 分子的立体构型为
分子的立体构型为_______ 。
(4)金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。

①若图中原子A的坐标为(0,0,0),原子B的坐标为(1,0,0),则原子C的坐标为_______ 。
②若金刚石的晶胞边长为apm,则其中碳碳键的键长d=_______ (用含a的代数式表示)pm。
(5)铁有δ、γ、α三种同素异形体(如图),三种晶体在不同温度下能发生转化。

①δ-Fe晶胞与γ-Fe晶体晶胞中铁原子的配位数之比为_______ 。
②若δ-Fe晶胞边长为ncm,α-Pe晶胞边长为mcm,则两种晶胞空间利用率之比为_______ 。(用含n、m的代数式表示)
 是制备铁触媒的主要原料,在光照下能分解:
是制备铁触媒的主要原料,在光照下能分解: 。回答下列问题:
。回答下列问题:(1)基态Fe原子的价电子排布式为
(2)三草酸合铁酸钾所含有的元素中,电负性最大的是
(3)
 分子中σ键和π键的个数比为
分子中σ键和π键的个数比为 分子的立体构型为
分子的立体构型为(4)金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。

①若图中原子A的坐标为(0,0,0),原子B的坐标为(1,0,0),则原子C的坐标为
②若金刚石的晶胞边长为apm,则其中碳碳键的键长d=
(5)铁有δ、γ、α三种同素异形体(如图),三种晶体在不同温度下能发生转化。

①δ-Fe晶胞与γ-Fe晶体晶胞中铁原子的配位数之比为
②若δ-Fe晶胞边长为ncm,α-Pe晶胞边长为mcm,则两种晶胞空间利用率之比为
您最近一年使用:0次



